Respuestas sorprendentes a preguntas cotidianas
2. ¿Por qué la sal desaparece cuando se disuelve?
Página 7 de 33
CAPÍTULO
2
¿Por qué la sal desaparece cuando se disuelve?
Es probable que lo de introducir un capítulo en un libro de ciencia con una historia de la Segunda Guerra Mundial ya esté muy visto, pero hay una anécdota de esta época que está relacionada con la química y que me parece muy interesante: la del laureado con el Premio Nobel que disolvió las medallas de oro de sus compañeros para esconderlas de los nazis.1
Pongámonos narrativos.
El año es 1940 y estamos en Copenhague, en el Instituto Niels Bohr. Hubiera sido un día cualquiera, tanto para el propio Niels Bohr como para George de Hevesy, si no fuera porque los nazis acababan de ocupar Dinamarca y habían prohibido sacar oro fuera del país... Una noticia preocupante, teniendo en cuenta que el instituto guardaba las medallas de oro de dos de sus colegas, Max von Laue y James Franck, también ganadores del Premio Nobel.
Mientras las tropas nazis ocupaban la ciudad, el pánico se apoderó de Bohr y Hevesy cuando se dieron cuenta de que sus colegas podrían tener problemas si a los nazis se les ocurría registrar el instituto y encontraban las dos medallas de oro, con sus nombres claramente grabados en ellas. En este contexto, estos dos científicos llegaron a la conclusión de que lo mejor sería ocultarlas. La idea inicial de enterrar las medallas no parecía un método lo bastante infalible, pero a Hevesy se le ocurrió una manera muy astuta de esconder el oro que impediría que los nazis las encontraran, incluso aunque lo tuvieran delante de las narices: decidió disolver las medallas.
Hevesy se pasó un día entero disolviendo las medallas de oro mientras los soldados nazis tomaban las calles de Copenhague. Cuando el proceso terminó, lo único que quedó de este valioso metal fue un bote lleno de un líquido amarillento que no levantaba ninguna sospecha entre el resto de los tarros del laboratorio. Es más, el plan de Hevesy funcionó tan bien que este bote permaneció intacto en una estantería hasta que la guerra terminó, y, cuando pasó el peligro, uno de los hijos de Bohr volvió a extraer el oro de la solución y lo envió a la Real Academia de las Ciencias de Suecia, donde se utilizó para fabricar dos medallas nuevas que fueron entregadas a Laue y Franck en 1950.
Ahora bien, si alguna vez has tenido que ocultar unas medallas de oro para que no las encuentren tus enemigos, es posible que pienses que disolverlas fue una decisión muy precipitada e incluso innecesaria, teniendo en cuenta que se puede conseguir el mismo efecto de una manera mucho más sencilla triturándolas o encerrándolas en un bloque de plomo. De hecho, es probable que los nazis estuvieran mucho más interesados en la información sobre física nuclear que guardaba el instituto que en las medallas de oro de Laue y Franck. Aun así, teniendo en cuenta que Hevesy tenía una amplia experiencia refinando metales, tampoco resulta demasiado extraño que la presión y la incertidumbre del momento lo llevaran a poner en práctica esta idea de bomber...
¡Espera, espera, que aún estoy procesando toda esta información! ¡Yo nunca he visto un puñetero anillo de oro disolviéndose en el agua como si fuera un terrón de azúcar! ¿Qué puñetas les hizo Hevesy a las medallas para que se desvanecieran?
Bueno, a ver, voz cursiva, que ni el oro ni la sal se «desvanecen» cuando se disuelven. Los átomos de estas sustancias siguen ahí, solo que están suspendidos individualmente entre las moléculas de agua. Además, la sustancia en la que se disolvió la medalla no era agua pura, sino una mezcla de ácid... Un momento, ¿sabes qué te digo? Voy a explicar qué ocurre a nivel molecular cuando una sustancia se disuelve y así entenderemos por qué la idea de Hevesy funcionó.
En el capítulo anterior hemos estado tratando los átomos como si fueran unas pequeñas bolitas rígidas, pero, en realidad, su estructura es un poco más compleja: están hechos de un núcleo que contiene partículas con carga eléctrica positiva y neutra llamados protones y neutrones, que, además, está rodeado de otras partículas con carga negativa llamadas electrones. Centrémonos de momento en estas últimas, porque son las que permiten que los átomos de diferentes elementos se unan entre ellos y formen sustancias nuevas que se pueden disolver.
Resulta que los átomos de cada elemento están rodeados de una cantidad de electrones distinta. Esto se debe a que, como veremos en un par de capítulos, cada uno de los elementos que forman la materia que nos rodea contiene una cantidad distinta de protones en su núcleo, y, como los átomos tienden a la neutralidad eléctrica, esto significa que un átomo siempre va a intentar poseer tantos electrones a su alrededor como protones posee en su núcleo, o, lo que es lo mismo, el mismo número de cargas negativas que positivas.
Otro detalle importante es que los electrones están organizados alrededor del núcleo de los átomos en diferentes capas, de modo que en cada una de ellas cabe un número muy concreto de estas partículas. Y, además, los átomos no empiezan a llenar de electrones sus capas más externas hasta que las más internas están completamente ocupadas.

¿Y qué tiene que ver todo esto con cómo se unen los átomos?
Mucho, voz cursiva, porque los átomos siempre intentan conseguir que su capa más externa albergue tantos electrones como quepan en ella. Como resultado, cuando un átomo de un elemento al que le faltan electrones en su capa más externa se encuentra con otro al que le sobran, los dos átomos pueden acabar interactuando de distintas maneras para acercarse a su objetivo de llenar su capa más externa. Y, durante el proceso, los dos átomos se suelen combinar y formar una molécula que tiene propiedades distintas a las que tenía cada átomo individual por separado.
Por ejemplo, la sal que utilizamos para condimentar nuestros platos está hecha de átomos de cloro y sodio que permanecen unidos porque los de sodio tienen un solo electrón solitario en su capa más externa, mientras que a los de cloro solo les falta uno para completar la suya. Por tanto, cuando dos átomos de estos elementos se encuentran, el de cloro tiende a «robar» el electrón exterior del de sodio para completar su órbita externa. Al perder un electrón, el átomo de sodio ahora posee más protones en su núcleo que electrones a su alrededor y adopta una carga eléctrica positiva, mientras que el de cloro acaba teniendo un electrón de más y adquiere una carga negativa. Como resultado, los dos átomos acaban adoptando cargas eléctricas opuestas que los atraen y se quedan pegados, formando cloruro de sodio... O sal común, que es lo mismo.
Pero tengo entendido que el sodio es un elemento que explota cuando entra en contacto con el agua y que el cloro es un gas que resulta letal si lo inhalas. ¿Cómo es posible que la sal que tomamos no nos reviente en la boca ni nos intoxique?
En el capítulo anterior he mencionado que las moléculas no tienen las mismas propiedades que los átomos individuales de los elementos que las componen, y el motivo es que el comportamiento químico de un átomo o de una molécula (o, lo que es lo mismo, la forma con la que interacciona con el resto de los elementos y sustancias) está determinado por su número de electrones y cómo están distribuidos alrededor de los núcleos atómicos. Por tanto, cuando dos o más átomos se unen para formar una molécula, los electrones que los rodean se reestructuran y la molécula adopta unas propiedades químicas diferentes.
Volviendo al tema de la sal de mesa, esa unión entre los átomos de cloro y sodio a través de su atracción eléctrica es lo que se llama enlace iónico y es lo que mantiene unidos los átomos de todas las sales que...
Eh, eh..., para el carro. ¿Cómo que «todas las sales»? Querrás decir «la sal».
Para nada, voz cursiva: en realidad, sal es un término muy genérico.
Una sal es cualquier compuesto que mantenga su cohesión gracias a los enlaces iónicos. La sal de mesa es el compuesto de este tipo que encontramos con más frecuencia en nuestro día a día, pero existen muchas otras sales con propiedades distintas, como el cloruro de potasio —que se utiliza como condimento en las dietas bajas en sodio— o el cloruro de magnesio —una alternativa para descongelar carreteras que es menos agresiva con la vida vegetal que la sal común.
Ahora bien, aunque las sales que he mencionado hasta ahora están compuestas por átomos de dos elementos, las hay que contienen más. En estos casos, las moléculas siguen teniendo una sección con carga positiva y otra negativa que se mantienen unidas por su atracción electrostática, pero cada una de esas secciones contiene más de un átomo. Un ejemplo es el carbonato de calcio, la sal que compone las conchas de los moluscos; o la piedra caliza, que consiste en átomos de calcio unidos por su atracción electrostática con un ion de carbonato, un grupo de átomos que tiene una carga global negativa y está formado por uno de carbono y tres de oxígeno. Otra sal curiosa es el sulfato de cobre, un compuesto azulado formado por átomos de cobre unidos a iones de sulfato (un átomo de azufre acompañado por cuatro de oxígeno) que se utiliza como pesticida.
O sea, que puedes ver que lo que determina que una sustancia sea una sal no es que podamos utilizarla como condimento, sino que sus moléculas estén divididas en dos partes que se mantienen unidas gracias a la atracción electrostática que producen sus cargas eléctricas opuestas.
Dicho esto, los átomos también se pueden unir a través de otros tipos de enlaces que no son iónicos. Por ejemplo, en lugar de robarse electrones entre ellos y permanecer unidos por su atracción electrostática, dos átomos pueden compartir los electrones de sus capas externas y permitir que circulen entre uno y otro, formando lo que se conoce como enlace covalente. Y luego están los átomos de los metales, que permanecen unidos porque los electrones de su capa más externa no están fijos en su órbita, sino que se mueven libremente entre los átomos y forman una especie de «nube» con carga eléctrica negativa que los mantiene anclados en su sitio. Hablaré de este tipo de unión con más detalle en los siguientes capítulos, pero, por ahora, basta con saber que este tipo de unión se llama enlace metálico.

Un nombre muy original. Pero ¿por qué me iba a importar a mí todo esto?
Pues porque el agua solo puede disolver las sustancias que están hechas de átomos unidos por enlaces iónicos... Y ahí está la clave de por qué la sal «desaparece» en este líquido.
Si metes un puñado de sal de mesa en un vaso de agua y lo remueves, los granos de sal irán desapareciendo de tu vista poco a poco, hasta que no quede ni rastro de ellos. El motivo por el que el agua es capaz de disolver la sal de esta manera es que los electrones que rodean el átomo de oxígeno y los dos de hidrógeno que componen cada una de sus moléculas están estructurados de tal manera que el extremo del oxígeno tiene una ligera carga eléctrica negativa, mientras que el del hidrógeno posee carga positiva. Por tanto, salvando muchísimo las distancias, se podría decir que cada molécula de agua actúa como un pequeño imán. La existencia de estos dos polos eléctricos en cada una de sus moléculas es el motivo por el que se dice que el agua es una sustancia polar.
¿Y qué hay del agua que rodea la Antártida y Groenlandia? ¿Podría decirse que es una sustancia polar polar?
Imagino que técnicamente sí, voz cursiva, pero no liemos a nuestros lectores.
La cuestión es que podemos imaginar una masa de agua como si fuera un amasijo de trillones de «imanes» diminutos que se están meneando constantemente y que, cuando se introduce en ella un compuesto iónico, formado por bloques que tienen una carga eléctrica opuesta, los polos eléctricos de las moléculas de agua se verán rápidamente atraídos hacia las secciones que tienen una polaridad opuesta... Y eso es lo que permite que el agua disuelva las sales.
Por ejemplo, si metemos un grano de sal común en el agua, el extremo positivo de las moléculas de este líquido se verá atraído hacia los átomos de cloro (que tienen carga negativa), y el negativo será atraído por los de sodio (con carga positiva). De esta manera, las moléculas de agua se irán pegando a los átomos individuales de cloro y sodio hasta que los acaben rodeando por completo y su tirón electrostático los separe, impidiendo que vuelvan a unirse de nuevo. Cuando este proceso termine, la sal se habrá disuelto.
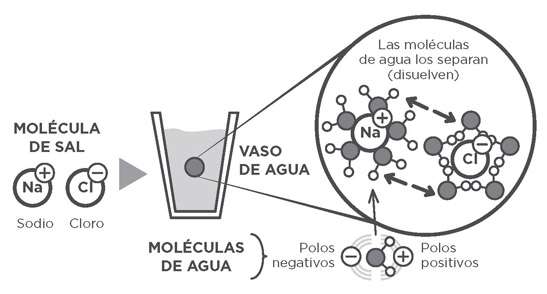
O sea, que el motivo por el que la sal «desaparece» cuando se disuelve es que las moléculas de agua la separan en átomos individuales que quedan dispersos por el líquido. Pero, como hemos visto, la sal no se desvanece de la faz de la Tierra porque los átomos de cloro y sodio siguen ahí, atrapados entre las moléculas de agua. Además, aunque existen muchas sales diferentes compuestas por elementos distintos, el mecanismo que permite que se disuelvan en el agua siempre es el mismo: los polos opuestos de las moléculas de agua rodean la parte positiva y la negativa del compuesto, las separan e impiden que se vuelvan a unir.
Por supuesto, el asunto de las disoluciones tiene muchos matices que no tengo tiempo de tratar en este capítulo. Por ejemplo, las sustancias polares como el agua no son capaces de disolver los compuestos cuyos átomos están unidos por enlaces covalentes, pero, al mismo tiempo, existen sustancias en las que la mayor parte de los átomos que componen sus moléculas están unidos por enlaces covalentes, pero que también poseen algún enlace iónico que permite que el agua las disuelva, como ocurre con la glucosa.
Es más, también hay que tener en cuenta que no todos los compuestos iónicos son solubles en el agua, porque, si la atracción entre sus átomos es lo bastante intensa, los polos eléctricos opuestos de las moléculas de agua no podrán tirar de ellos con suficiente fuerza como para separarlos y no se disolverán. Ese es el caso del fluoruro de calcio, una sal que debe su insolubilidad a la fuerza con la que están unidos sus átomos de flúor y de calcio.
OK, existen sustancias solubles e insolubles. Captado. Ya podemos cambiar de tem...
Lo que dices no es del todo correcto, voz cursiva, porque las sustancias no se dividen en solubles y no solubles, sino que existe todo un espectro de solubilidades diferentes. Ahora bien, ¿qué determina cómo de soluble es una sustancia? La regla es sencilla: cuanta mayor sea la cantidad de sustancia que se puede disolver en un mismo volumen de un líquido determinado, más soluble se considera. Por ejemplo, se pueden disolver hasta 360 gramos de cloruro de sodio en cada litro de agua a temperatura ambiente, pero solo 2,1 gramos de una sustancia mucho menos soluble llamada sulfato de calcio.
¿Y eso?
Exacto, voz cursiva.
¿Qué?
Digo que me parece una buena puntualización. «Sulfato de calcio» es la fórmula química de lo que llamamos yeso.
Menuda conversación de besugos... Te estaba intentando preguntar por qué el agua deja de ser capaz de disolver una sal a partir de una cantidad determinada.
¡Ah, vale! Lo que ocurre es que cualquier masa de agua contiene una cantidad de moléculas finita que solo puede separar y disolver un número limitado de átomos. Por tanto, si empezamos a añadir sal a un recipiente con agua, llegará un momento en el que sus moléculas no serán capaces de disolver más material, por lo que se dice que la solución se habrá saturado. Cualquier cantidad de sal adicional que añadamos a partir de este punto simplemente se hundirá hacia el fondo del recipiente sin disolverse.
De hecho, las diferencias de solubilidad que existen entre unos compuestos y otros son muy útiles, porque permiten separarlos con relativa facilidad. Para poner un ejemplo sencillo, supongamos que tenemos en nuestras manos un polvo que contiene yeso y sal común, y queremos separar los dos compuestos. Una manera de hacerlo sería coger unas pinzas y empezar a separar las dos sustancias grano por grano, pero, como sabemos algo de química, tenemos a nuestra disposición una manera mucho más rápida: si metemos el polvo en el agua, casi toda la sal se disolverá en ella y el yeso permanecerá en el fondo, porque es muy poco soluble. Llegados a este punto, podremos recuperar la sal metiendo la disolución en otro recipiente y calentándolo hasta que toda el agua se haya evaporado, dejando el fondo lleno de los cristales de sal.
Además, las diferencias de solubilidad entre los diferentes compuestos que hay en nuestro planeta también son el motivo por el que nuestros océanos contienen tanto sodio disuelto: como casi todas las sales que produce el sodio al combinarse con otros elementos son muy solubles, los ríos disuelven estos compuestos con facilidad en tierra firme y los transportan hasta los océanos, donde también se acumulan en grandes cantidades gracias a su gran solubilidad. En cambio, hay otros elementos que son mucho más abundantes en la corteza terrestre que el sodio, como el hierro o el silicio, pero, como la mayor parte de sus compuestos que ocurren en nuestro entorno son muy insolubles, simplemente se hunden hacia el fondo de cualquier masa de agua en forma de barro o arcillas.
Por otro lado, el origen del cloro que hay disuelto en nuestros océanos es un poco distinto: como este elemento se encuentra en la mezcla de gases que expelen los volcanes, se cree que el cloro se ha estado acumulando en el agua de los mares a lo largo de la historia de la Tierra como resultado de la actividad volcánica, tanto terrestre como submarina.
¡Pero si el cloro es un gas! ¿Cómo va a disolverse en el agua? ¿Es que los gases también son solubles?
Claro, voz cursiva. El cloro es un mal ejemplo porque no es muy soluble en el agua en estado gaseoso. En este caso, el motivo por el que el cloro acaba disolviéndose en el agua es que reacciona con sus moléculas y forma ácido clorhídrico, una sustancia que sí es soluble.
De todas maneras, el hecho de que una sustancia se encuentre en estado sólido, líquido o gaseoso no es un impedimento para las moléculas de agua, ya que, siempre que puedan separar los átomos que la componen, la podrán disolver. Es más, el aire que respiran los buceadores no tiene la misma composición que el que inhalamos en la superficie, precisamente porque el agua que contiene su sangre es capaz de disolver distintos gases entre sus moléculas.
Me explico.
El aire de nuestra atmósfera está compuesto en un 78 % por nitrógeno y un 21 % de oxígeno. Cuando inspiramos, nuestros pulmones absorben parte del oxígeno que hemos inhalado, y los glóbulos rojos incorporan este gas a su estructura molecular para repartirlo por las células de nuestro cuerpo a través del torrente sanguíneo. El agua de nuestra sangre también disuelve un poco de oxígeno y nitrógeno gaseosos durante el proceso, pero eso no representa ningún peligro en condiciones normales.
Ahora bien, como la presión a la que está sometido el cuerpo de los buceadores se incrementa cuanto más se adentran en las profundidades, sus bombonas también deben suministrarles gas respirable a una presión mayor para que sus pulmones se puedan hinchar con más facilidad bajo todo el peso del agua. Pero, claro, esto genera un problema, porque la solubilidad del nitrógeno en la sangre y los tejidos aumenta junto con la presión. Por tanto, si no se toman medidas para prevenirlo, la respiración del buceador disolverá cada vez más nitrógeno en su torrente sanguíneo hasta alcanzar niveles potencialmente peligrosos.
Sí, bueno, «peligrosos». Ya me dirás tú qué daño te puede hacer un poco de gas disuelto en la sangre.
Más del que crees, voz cursiva. Por un lado, un nivel elevado de nitrógeno en sangre puede producir un efecto narcótico que puede hacer que los buceadores se pongan inusualmente eufóricos, relajados o adormilados durante la inmersión, llegando incluso a perder la noción del tiempo o a olvidarse de hacer un seguimiento de sus instrumentos. Y, como puedes imaginar, ese no es un estado de ánimo apropiado cuando tienes una capa de decenas de metros de agua sobre tu cabeza y una reserva de aire limitada.
Además, el nitrógeno disuelto en la sangre puede ser peligroso durante la vuelta a la superficie porque, mientras un buceador asciende, la presión a la que su cuerpo está sometido va disminuyendo y la solubilidad del nitrógeno que hay en su sangre se vuelve cada vez menor. ¿Y qué crees que pasa con todo ese gas que ya no puede mantenerse disuelto, voz cursiva?
Imagino que desaparece mágicamente sin causar problemas a nadie, ¿no?
Pues no; desgraciadamente, no: si la presión a la que está sometida la sangre disminuye, los átomos de todas esas moléculas de nitrógeno que ya no tienen espacio para permanecer disueltas se volverán a unir y recuperarán su forma gaseosa, así que un buceador que ascienda demasiado rápido a la superficie también corre el riesgo de que se formen burbujas de gas en su sangre o sus tejidos, lo que puede producir desde molestias en las articulaciones hasta daños pulmonares o nerviosos.2 Por tanto, para evitar que se disuelva demasiado nitrógeno en su sangre y les complique la vida, los buceadores utilizan combinaciones de gases diferentes mezclados en distintas proporciones en función de la profundidad a la que tengan pensado sumergirse.
Este proceso, en el que una sustancia disuelta deja de estarlo, es lo que se llama precipitación, y le ocurre a cualquier tipo de sustancia, no solo a los gases: si las condiciones a las que está sometida una solución cambian de la manera adecuada, entonces la cantidad de átomos que sus moléculas de agua son capaces de mantener separados disminuirá, y estos se volverán a combinar otra vez, formando el compuesto original. En el caso de que este compuesto sea un sólido más denso que el agua, se precipitará hacia el fondo del recipiente en cuanto deje de estar disuelto... Y de ahí el nombre de este fenómeno.
Entre los motivos por los que una sustancia disuelta se puede empezar a precipitar está una disminución de la presión, como acabo de comentar, pero el que observamos con más frecuencia en nuestro día a día es la evaporación del propio líquido que mantiene la sustancia disuelta. Un ejemplo muy cotidiano es el agua salada que se acumula en los agujeros de las rocas en las zonas costeras: a medida que el agua de estos charcos salados se evapora, el número de moléculas de esta sustancia disminuye y los átomos de cloro y sodio que quedan libres se vuelven a combinar entre ellos formando la sal común que se hunde hacia el fondo del charco y crea una corteza salada sobre la roca.
De hecho, este mecanismo es el motivo por el que hoy en día existe una gruesa capa de sedimentos salinos de hasta tres kilómetros de espesor3 enterrados bajo el fondo del mar Mediterráneo. Siendo más concretos, hace 5,96 millones de años, el movimiento de las placas tectónicas cerró el estrecho de Gibraltar, y este mar dejó de recibir agua del océano Atlántico. Como los ríos que rodean el Mediterráneo no vierten agua en él a un ritmo lo bastante elevado como para compensar la cantidad de líquido que pierde por evaporación, el mar se empezó a secar y toda la sal que contenía se precipitó, acumulándose en el fondo marino.
A lo largo de 600.000 años, el mar Mediterráneo fue recuperando un poco de agua y secándose de nuevo a medida que la tectónica de placas abría y cerraba pequeños canales en el estrecho de Gibraltar, hasta que, finalmente, hace 5,33 millones de años, el Estrecho se abrió definitivamente y el Mediterráneo se volvió a llenar de agua a un ritmo sin precedentes: el estudio de la topografía submarina de la región sugiere que el caudal de la corriente debió de ser unas mil veces mayor que el del río Amazonas y la cuenca pudo recuperar el 90 % de su agua en solo dos años o incluso en algunos meses.4 A este ritmo, se cree que el nivel del Mediterráneo pudo haber llegado a aumentar hasta diez metros cada día.
Teniendo esto en cuenta, no deja de parecerme interesante que el mismo proceso que secó el Mediterráneo se pueda replicar en casa con un simple vaso de agua salada. Al fin y al cabo, el proceso es el mismo: a medida que el agua se evapore, los átomos de cloro y de sodio disueltos que contiene se unirán de nuevo y formarán una capa cada vez más gruesa de pequeños cristales de sal en el fondo.
Espera, espera, que me acabo de perder. ¿Cómo que «cristales» de sal? ¿Es el mismo material de los cristales de las ventanas?
Ah, no, no, perdona, voz cursiva. En nuestro día a día solemos llamar cristal al material transparente del que están compuestas las ventanas o las botellas, pero, en realidad, una palabra más apropiada para esta sustancia sería vidrio.
Si nos ponemos técnicos, un cristal es cualquier sólido que esté compuesto por átomos que forman una estructura ordenada. Por tanto, cuando digo que la sal se cristaliza cuando el agua se evapora, me refiero a que los átomos de cloro y de sodio se van uniendo con un patrón concreto y formando pequeñas masas de sal cada vez más grandes cuyos átomos están ordenados siguiendo un patrón concreto.
Los átomos de cada elemento se tienden a unir con los demás siguiendo orientaciones diferentes en función de cómo estén estructurados sus electrones, y, como resultado, producen cristales con formas geométricas distintas cuando se agrupan. Si, por ejemplo, observamos un puñado de sal con una lupa, veremos que está compuesto por pequeños cubitos blanquecinos. Esto se debe a que los átomos de cloro y sodio que la componen se combinan formando ángulos de 90º, así que los cristales que forman adoptan una forma cúbica mientras crecen.

Ahora bien, los cristales no tienen que ser tan pequeños como los que encontramos en un paquete de sal; de hecho, podemos producir cristales de sal enormes en nuestra propia casa.
¿Estás proponiendo un experimento disimuladamente a nuestros lectores?
Exacto, voz cursiva.
La cantidad de sal que se puede disolver en el agua también depende de la temperatura, y, por regla general, cuanto más caliente esté un líquido, mayor será la solubilidad de cualquier sustancia que se nos ocurra echarle. Por ejemplo, se pueden disolver hasta 360 gramos de sal común en un litro de agua a 20 ºC, pero esa cantidad aumenta hasta los 400 gramos a 100 ºC.
Este detalle es interesante porque nos permite producir nuestros propios cristales. Para conseguirlo, basta con calentar un volumen de agua, disolver sal en él hasta que se sature y dejar que se enfríe hasta que alcance la temperatura ambiente. A medida que la temperatura de la solución descienda, la solubilidad de la sal también se reducirá y los átomos «sobrantes» se irán combinando y precipitando, formando cristales. El secreto para conseguir que esos átomos formen cristales grandes durante el proceso es que la solución se enfríe tan despacio como sea posible. De esta manera, en lugar de aparecer una gran cantidad de cristales pequeños que se limitarán el crecimiento unos a otros, se formarán pocos cristales más espaciados que podrán alcanzar un tamaño mayor sin chocar con sus vecinos. Además, los átomos del precipitado tendrán más tiempo para colocarse de forma ordenada, siguiendo el patrón correspondiente.
En cuanto la solución haya alcanzado la temperatura ambiente, lo ideal es separar los cristales más grandes que se hayan formado, colocarlos en el fondo de un recipiente nuevo y verter en él la solución fría que ha quedado. A lo largo de los siguientes días o semanas, el agua se irá evaporando lentamente y la sal se irá precipitando sobre esos cristales muy poco a poco, produciendo mazacotes geométricos tan grandes como queramos. Si tienes dudas sobre el proceso, en mi canal de YouTube hay un tutorial en el que enseño cómo hacer unos cristales azules muy llamativos con sulfato de cobre, pero estas mismas instrucciones sirven para cristalizar cualquier otra sal.
Estos procesos de cristalización no solo tienen lugar continuamente en la naturaleza, sino que son los responsables de que entre la tierra y las rocas irregulares que nos rodean se puedan encontrar minerales, cristales de diferentes minerales que poseen una gran variedad de colores vivos y formas geométricas que, a primera vista, parecen haber sido fabricados por la mano humana. Pero nada más lejos de la realidad: esas estructuras geométricas y coloridas se forman de manera completamente natural, ya sea a través de la precipitación de los compuestos disueltos que contienen los fluidos que circulan entre las rocas o por la lenta solidificación de las diferentes sustancias que contiene alguna masa de magma.
Por desgracia para los que nos gusta coleccionar y buscar minerales, la mayor parte de los cristales que se pueden encontrar en la naturaleza se forman bastante deprisa y tienen un tamaño diminuto y una forma irregular, pero existen algunos casos excepcionales que son realmente impresionantes, como el de la cueva de los Cristales, en Naica (México).
Resulta que esta cueva ha permanecido unos 500.000 años inundada con agua caliente cargada de sulfato de calcio disuelto. Durante todo este tiempo, la cámara de magma sobre la que descansa y que mantiene el agua a una temperatura elevada se ha ido enfriando muy lentamente a lo largo de ese medio millón de años, por lo que el sulfato de calcio de la cueva de los Cristales se ha podido precipitar muy poco a poco sobre las paredes de la cueva y ha formado cristales de un mineral llamado selenita (que no es más que yeso cristalizado) que alcanzan hasta ocho metros de longitud. Si no conoces esta cueva, te recomiendo que busques alguna foto por internet y verás que no estoy exagerando.
Tampoco creo que unas cuantas piedras sean para tant... ¡¿Pero qué diablos es esto?! ¡No me creo que esta cueva pueda existir de verdad!
Pues créetelo, voz cursiva, porque esos cristales se han formado gracias al tiempo, a la naturaleza polar de las moléculas de agua y a la capacidad que tienen los átomos de unirse formando estructuras ordenadas.
Pues qué barbaridad, la naturaleza es fascinante. Eso sí, un pequeño apunte: nada de lo que has dicho hasta ahora explica cómo se las apañó Hevesy para disolver las medallas de oro.
¡Tienes razón! Los átomos de oro están unidos por fuertes enlaces metálicos que las moléculas de agua no pueden separar, pero, por suerte para Hevesy, una sustancia insoluble como el oro se puede llegar a disolver si se consigue que adopte una forma que las moléculas de agua sí puedan «manipular». Y ahí es donde entran los ácidos.
Simplificando muchísimo, los ácidos son compuestos que pueden cambiar la composición química y las propiedades de las sustancias con las que entran en contacto, ya sea cediéndoles algunos de sus átomos a sus moléculas o robándoselos. En el caso que nos ocupa, lo importante es que un ácido puede alterar la composición de una sustancia insoluble y conseguir que algunos de sus átomos terminen unidos por enlaces iónicos que el agua sí es capaz de disolver.
Por ejemplo, un trozo de hierro no se va a disolver por mucho tiempo que pase metido en un vaso de agua, pero si mezclamos en ella un poco de ácido clorhídrico (formado por parejas de átomos de cloro e hidrógeno unidos por un enlace iónico), los átomos de hidrógeno se separarán y escaparán en forma de gas, mientras que los de cloro que quedarán libres se unirán con los de hierro y producirán cloruro de hierro, una sal que sí que es soluble porque sus átomos están unidos por enlaces iónicos. De esta manera, el ácido habrá conseguido que el hierro adopte una forma que sí se puede disolver.
En la naturaleza, la presencia de pequeñas cantidades de ácido (en este caso, carbónico) en el agua es el motivo por el que esta sustancia es capaz de disolver ciertos compuestos que, de lo contrario, serían insolubles, como el carbonato de calcio de la piedra caliza. Este ácido permite que el agua de la lluvia modifique ligeramente la composición química de estas rocas y las vuelva solubles, algo que contribuye enormemente a la modificación del paisaje en escalas de tiempo largas.
La acidez del agua también es el motivo por el que la arena de las playas está compuesta principalmente por granos de cuarzo. Aunque la arena es una mezcla de varios minerales insolubles diferentes compuestos por óxidos y carbonatos, el ácido carbónico que contiene el agua del océano es capaz de convertir muchos de ellos en formas que sí son solubles. Ahora bien, como el dióxido de silicio que compone el cuarzo es una sustancia muy inerte químicamente y mantiene su forma insoluble porque no reacciona con este ácido, la proporción de este mineral en la arena va aumentando con el tiempo a medida que el agua disuelve el resto.5
Con estos ejemplos quería mostrar que incluso las sustancias insolubles se pueden disolver en el agua si esta contiene algún ácido que reaccione químicamente con ellas y modifique la composición de sus moléculas... Y el caso del oro no es muy diferente.
El oro es más difícil de disolver porque es extremadamente inerte, lo que significa que sus átomos están muy cómodos en solitario y se niegan a combinarse con otros para formar moléculas. De hecho, este metal es tan inerte que puede permanecer inalterado y reluciente de forma indefinida, como demuestra el oro de los yacimientos de Pilbara (Australia), que fue depositado hace unos 3.400 millones de años.6
El único ácido que puede convertir el oro en un compuesto soluble por su cuenta es el ácido selénico, pero la manera más común de disolver este metal es sumergirlo en una mezcla de ácido clorhídrico y ácido nítrico a la que llaman agua regia. El papel del ácido nítrico en esta mezcla es arrancar tres electrones a cada átomo de oro para que los átomos de cloro del ácido clorhídrico puedan combinarse con ellos y formar tetracloruro de oro, una sal que el agua sí puede disolver porque los cuatro átomos de cloro que rodean cada uno de oro están unidos a él por enlaces iónicos... Y, por supuesto, este es el método que utilizó Hevesy para disolver las tres medallas de oro del Nobel.

¡Por fin! Cómo has estirado la explicación. Pero, oye, ¿cómo se las apañó luego para recuperar el oro de la solución? ¿Evaporó el agua y ya está?
No, voz cursiva, porque entonces no recuperarías el oro puro metálico, sino el tetracloruro de oro amarillento que está disuelto, igual que cuando evaporas agua salada obtienes una costra de sal, en lugar de sodio y cloro puros.
En realidad, el oro puro se extrae de la solución amarillenta de tetracloruro de oro introduciendo algún otro compuesto que provoque que los átomos de oro se separen de los de cloro y se precipiten en su forma metálica hacia el fondo del recipiente. Este efecto se puede conseguir con varias sustancias diferentes, pero, en cualquier caso, el resultado será un amasijo de polvo de oro que se acumulará en el fondo del recipiente y se podrá separar fácilmente del resto de la solución para luego secarlo, fundirlo y producir una masa sólida de metal dorado.
Increíble. Casi parece magia que puedas coger un metal sólido y denso como el oro y dispersar sus átomos entre las moléculas de agua para mantenerlo oculto ante la vista de todo el mundo. Y, encima, que el oro vuelva a aparecer de entre las aguas, como de la nada, cuando añades otra sustancia a la mezcla. Los nazis no se lo debieron ni oler.
Vaya, voz cursiva, qué comentario más oportuno para introducir el siguiente tema...