PIHKAL
Libro II. La historia química » Feniletilaminas » N.º 166.— 2t-mmda-3a; 3,4-metilendioxi-2-metiltioanfetamina
Página 234 de 251
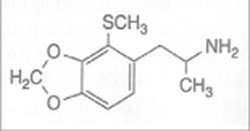
N.º 166.— 2T-MMDA-3a; 3,4-METILENDIOXI-2-METILTIOANFETAMINA
SINTESIS: Una solución de 30 g de piperonal en 25 mL de ciclohexilamina se llevó a ebullición sobre una placa calefactora hasta que no se observó más liberación de agua. El fundido resultante se destiló, con lo que se obtuvieron 45 g de N-ciclohexil-3,4-metilendioxibencilidenimina, la cual destiló a 114-135 °C a 0,2 mmHg en forma de un aceite de color amarillo pálido.
En 400 mL de Et2O anhidro se disolvieron 40,3 g de N-ciclohexil-3,4-metilendioxibencilidenimina y 30 mL de N,N,N’,N’-tetrametiletilendiamina (TMEDA). Esta solución se puso en atmósfera inerte y bajo buena agitación se llevó a -78 °C con un baño de hielo seco/acetona externo, lo que produjo la formación de un precipitado cristalino de color blanco. Entonces se añadieron 120 mL de butil-litio 1,5 M, lo que produjo un oscurecimiento inmediato y la disolución del precipitado fino. Tras 10 minutos bajo agitación, se añadieron 20 mL de disulfuro de dimetilo. El color desapareció al instante y después se produjo la formación de un precipitado de color blanco. Entonces se puso en baño de hielo y después la fracción volátil se eliminó a vacío. El residuo se vertió entonces en 500 mL de H2O y se acidificó con HCl. Tras calentarlo durante 1 hora en baño de vapor, la mezcla de reacción se enfrió y se formó un sólido gomoso que resultó ser, por CCF, una mezcla compleja. Aunque se observó una única mancha fluorescente que mostró ser el producto aldehído y es el que se siguió. La extracción con 3x75 mL de CH2Cl2 proporcionó, tras la combinación de los extractos y su separación del solvente, un residuo que se extrajo mediante cuatro pasos por separado, cada uno con 75 mL de hexano en ebullición. Los cristales precipitados de cada uno se separaron, y todos se recristalizaron, tras su extracción con MeOH en ebullición, con lo que se obtuvieron 3,3 g de 3,4-metilendioxi-2-(metihio)benzaldehído, con un p.f. de 77-80 °C.
A una solución de 3,0 g de 3,4-metilendioxi-2-(metiltio)benzaldehído en 25 mL de IPA se le añadieron 2 mL de nitroetano, 0,11 mL de etilendiamina y 0,1 mL de ácido acético. Esto se mantuvo a reflujo durante 18 horas, y los solventes se eliminaron a vacío. El análisis por CCF mostró ocho manchas del residuo, desde el producto inicial hasta la mancha del producto de nitroestireno. La pulverización de este residuo en 25 mL de MeOH proporcionó un nitroestireno impuro el cual, tras su separación, se recristalizó tras su extracción con 20 mL de MeOH en ebullición. El aislamiento final de 1-(3,4-metilendioxi-2-metihiofenil)-2-nitropropeno proporcionó 0,5 g de un producto que presentó un p.f. de 94-95 °C. El p.f. de la mezcla con el nitroestireno en piperonal (p.f. 97-98 °C) disminuyó extremadamente (p.f. 67-79 °C).
Una solución de AH se preparó mediante una solución de 0,5 g de LAH en 10 mL deTHF, a 0 °C en atmósfera de He, con 0,32 mL de H2SO4 al 100%. Entonces se añadió, gota a gota, una solución de 0,45 g de l-(3,4-metilendioxi)-2-metiltiofenil)-2-nitropropeno en 10 mL de THF, y la agitación se mantuvo durante 1 hora. Tras un breve periodo a reflujo, la mezcla de reacción se dejó que regresara a temperatura ambiente, y entonces el exceso de hidruro se eliminó mediante la cuidadosa adición de IPA. Las sales se convirtieron a una masa filtrable mediante la adición de NaOH al 5% y, tras su filtración y lavado con IPA, el filtrado y los extractos se combinaron y se separaron del solvente a vacío.
El residuo se disolvió entonces en H2SO4, y se lavó con 3x75 mL de CH2Cl2. Tras su alcalinización con NaOH al 25%, el producto se extrajo con 2x75 mL de CH2Cl2. Los extractos se combinaron, y el solvente se eliminó a vacío. La destilación del residuo proporcionó una fracción que destiló a 137-150 °C a 0,3 mmHg y pesó 0,3 g. Esta fracción se disolvió entonces en 1,6 mL de IPA, se neutralizó con 6 gotas de HCl concentrado, se templó para conseguir una solución completa, y se diluyó en 4 mL de Et2O anhidro. Los cristales formados se separaron por filtración y, tras su lavado con Et2O y secado al aire hasta obtener un peso constante, se obtuvieron 0,3 g de hidrocloruro de 3,4-metilendioxi-2-metiltioanfetamina (2T-MMDA-3a).
DOSIS: mayor de 12 mg
DURACIÓN: desconocida
ANEXOS Y COMENTARIO: y visiones de dulces pasaron bailando por sus cabezas. Se han documentado muchos análogos de anfetaminas trisustituidas con distintos grados de actividad. Hay seis TMA y, si se sintetizasen de manera sistemática todos los análogos azufrados posibles de ellas, se tendría un total de dieciséis análogos azufrados de la TMA. Hagámoslo, me dije a mí mismo. Tengamos los 16 análogos azufrados en nuestras manos. Eso es de lo que se trata. Pero, espera un minuto. Todos y cada uno de los isómeros de la MMDA tienen, por definición, tres análogos azufrados posibles, así que, sólo con ellos, hay dieciocho compuestos azufrados más. ¡Claro, vamos a hacer todos! Sería un hito sin precedentes para los estudiantes de la relación estructura-actividad. Saquémonos de la manga unos 34 compuestos, probémoslos todos y quizás empezaremos a entender por qué aquellos que son activos lo son en realidad. O quizás no.
De todas formas, éste fue el más maniaco de todos los proyectos maniacos relacionados con análogos azufrados. Y su realización es una necesidad imperiosa. Otra pista sintética procedía del hecho de que la vainillina también formaba el carbonato cíclico con tiocianato sódico y, en principio, podría usarse en todo momento para obtener la 3-metoxi-5,4-metilentiooxianfetamina ó 5T-MMDA. Eso llevaría a dos de los mágicos análogos y sólo quedaban 32. Qué proyecto tan maravilloso para un estudiante de posgrado (qué proyecto tan horriblemente aburrido para un estudiante de posgrado). Pero, de todas formas, no había ningún estudiante de posgrado y eso parecía ser el final de todo. Sinteticemos todas estas posibilidades, algún día. Una hazaña gloriosa, pero que, a día de hoy, no merece la pena. Otras direcciones son más emocionantes y atractivas.
Una última nota de humor simple. Uno de los compuestos usados en esta síntesis fue la N,N,N’,N’-tetrametiletilendiamina, que se ha abreviado como TMEDA. En cualquier grupo de investigación de químicos con un objetivo hay una costumbre de condensar conceptos complejos en términos aparentemente simples. Protegimos con MOM el grupo hidroxilo de la amina protegida con t-BOC. Hace poco he escuchado referirse en la jerga química al monstruo tetrametilo anterior pronunciando su nombre, en vez de deletreándolo. Suena muy parecido a «tomato» pronunciado por un nativo del Bronx.