PIHKAL
Libro II. La historia química » Feniletilaminas » N.º 167.— 4t-mmda-2; 6-(2-aminopropil)-5-metoxi-1,3-benzozatiol; 2-metoxi-4,5-metilentiooxinfetamina
Página 235 de 251
N.º 167.— 4T-MMDA-2; 6-(2-AMINOPROPIL)-5-METOXI-1,3-BENZOZATIOL; 2-METOXI-4,5-METILENTIOOXINFETAMINA
SINTESIS: A una solución, bajo buena agitación, de 120 g de tiourea en 800 mL de HCl 2 N, se le añadió una solución de 100 g de benzoquinona en 500 mL de ácido acético a lo largo de 15 minutos. La agitación se mantuvo durante 30 minutos adicionales a temperatura ambiente y entonces la mezcla de reacción se calentó en baño de vapor durante 1 hora. Tras enfriarlo en agua helada, se formó una abundante colecta de cristales, los cuales se separaron por filtración y se secaron al aire, con lo que se obtuvieron 90,1 g de 5-hidroxi-1,3-benzoxatiol-2-ona (éster de carbonato de 2-mercaptohidroquinona cíclica) con un p.f. de 170,5-172,5 °C.
A una suspensión de 100 g de K,C0 3 anhidro en polvo en 400 mL de acetona que contenía 50 g de yoduro de metilo se le añadieron 41 g de 5-hidroxi-l,3-benzoaxotiol-2-ona, y la mezcla se agitó durante la noche a temperatura ambiente. Los sólidos se separaron por filtración, y el solvente se eliminó a vacío. El residuo se destiló, tras lo cual se obtuvo una fracción que sufrió una sublimación inversa, en forma de un sólido a una temperatura de horno de 110 °C a 0,1 mmHg. Este sólido amarillento, pesó 27,4 g y presentó un p.f. de 66-72 °C. Mediante recristalización, tras su extracción con MeOH, se obtuvo 5-metoxi-1,3-benzoxatiol-2-ona en forma de un sólido de color blanco con un p.f. de 75,5-76,5 °C.
A una solución de 30 g de KOH al 85% en 75 mL de H2O templada, se le añadió un volumen igual de MeOH templado, 16 g de 5-metoxi-1,3-benzoxatiolmezcla se mantuvo a reflujo durante 2 horas. Tras dejarla enfriar a temperatura ambiente, la mezcla se acidificó con HCl y se extrajo con 2x100 mL de CH2Cl2. La eliminación del solvente de los extractos combinados proporcionó un aceite de color amarillo que cristalizó en reposo. El producto, 2-mercapto-4-metoxifenol, pesó 14 g y presentó un p.f. de 56-57 °C.
Una solución de 10 g de 2-mercapto-4-metoxifenol en 100 mL de MEK se añadió a lo largo de 1 hora a una suspensión bajo agitación enérgica de 25 g de K 2 CO, anhidro y finamente dividido en 200 mL de MEK que contenía 14 g de bromuro de metilo. El reflujo se mantuvo durante 48 horas. Tras dejarlo enfriar, los sólidos se separaron de la mezcla por filtración y la torta de filtrado se lavó con 50 mL de MEK. Los extractos y el filtrado se combinaron y se separaron del solvente a vacío, y el producto se destiló, tras lo cual se obtuvieron 3,3 g de 5-metoxi-1,3-benzoxatiol, en forma de un aceite amarillento que presentó un p.e. de 110-120 °C a 1,7 mmHg. Quedó bastante residuo en el matraz, que se descartó. El espectro de RMN fue excelente, con los protones de metileno en un singlete de dos hidrógenos a 5,6 ppm.
A una mezcla de 3,2 g de POCl3 y 2,8 g de N-metilformanilida, previamente calentada en baño de vapor (hasta la aparición de un intenso color burdeos), se le añadieron 2,3 g de 5-metoxi-1,3-benzoxatiol, y el baño de vapor se mantuvo durante 5 minutos. La mezcla de reacción se vertió entonces en 100 mL de H2O y, tras unos minutos bajo agitación, las partículas insolubles se transformaron en un sólido suelto. Este sólido se separó por filtración, se lavó con H2O y, tras secarlo por succión lo más posible, se recristalizó, tras su extracción con 30 mL de MeOH en ebullición. De esta forma se obtuvieron 1,9 g de 6-formil-5-metoxi-1,3-benzoxatiol en forma de agujas de color parduzco que fundieron a 119-120 °C.
Una solución de 1,5 g de 6-formil-5-metoxi-1,3-benzoxatiol en 50 mL de nitroetano se trató con 0,3 g de acetato de amonio anhidro y se calentó en baño de vapor durante 5 horas. La eliminación del solvente a vacío proporcionó un residuo que cristalizó. Entonces este residuo se recristalizó, tras su extracción con 110 mL de EtOH en ebullición, con lo que se obtuvieron, tras su filtración y secado al aire, 1,3 g de 5-metoxi-6-(2-nitro-1-propenil)-1,3-benzoxatiol en forma de cristales de color naranja al estilo de las camisetas del equipo de San Francisco Giants.
Una solución de AH se preparó mediante una solución de 1,3 g de LAH en 10 mL de THF, a 0 °C en atmósfera de He, con 0,8 mL de H2SO4 al 10%. Entonces se añadieron, gota a gota, una solución de 1,1 g de 5-metoxi-6-(2-nitro-1-propenil)-13-benzoxatiol en 25 mL de THF, y la agitación se mantuvo durante 1 hora. Tras un breve periodo a reflujo, la mezcla de reacción se dejó que regresara a temperatura ambiente, y el exceso de hidruro se eliminó mediante la cuidadosa adición de IPA.
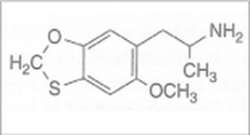
Las sales se convirtieron en una masa filtrable mediante la adición de NaOH al 5% y, tras filtrar y lavar con IPA, el filtrado y los extractos se combinaron y se separaron del solvente a vacío. El residuo se disolvió en H2SO4 que se lavó con 3x75 mL de CH2Cl2 y después, tras basificarlo con NaOH al 25%, el producto se extrajo con 2x75 mL de CH2Cl2. Los extractos se combinaron, y el solvente se eliminó a vacío. La destilación del residuo proporcionó una fracción que destiló a 140-155 °C a 0,3 mmHg y que pesó 0,7 g. Entonces esto se disolvió en 4 mL de IPA, se neutralizó con 14 gotas de HCl concentrado, se calentó para conseguir una solución completa y después se diluyó en 10 mL de Et2O anhidro. Los cristales de color blanco que se formaron se separaron, se lavaron con Et2O y se secaron al aire, tras lo cual se obtuvieron 0,6 g de hidrocloruro de 6-(2-aminopropil)-5-metoxi-1,3-benzoxatiol (4T-MMDA-2).
DOSIS: mayor de 25 mg
DURACIÓN: desconocida
COMENTARIOS CUALITATIVOS: (Con 25 mg) «Tres horas después de tomar la sustancia sentí que tal vez haya habido un poco de excitación. Y puede que algo de temblor y de tensión mandibular. Puede que no sea más que la dosis para llegar al umbral».
ANEXOS Y COMENTARIO: no hay una forma lógica de intentar adivinar cuál sería la dosis activa de este compuesto. En una comparación de 4-oxi con 4-tio y 4-alquilo (como, por ejemplo TMA-2, PARA-DOT y DOM) el análogo con el átomo de azufre está a caballo en potencia entre el átomo de oxígeno y el átomo de carbono. Entonces, quizás la 4T-MMDA-2 debería ser algo más potente que la MMDA-2. Esto es para lo que se ha recurrido a los ensayos y la ausencia de efectos, por lo tanto, hace que consideremos inválido dicho razonamiento. ¿Qué más puede usarse para obtener indicios? Todo el proyecto de benzofuranos, que tenían la misma naturaleza cíclica, resultó no tener actividad. Tenían un carbono donde estaba el azufre de la 4T-MMDA-2, así que, por ese cálculo, este compuesto debería ser incluso menos activo. Quizás ésta es la fórmula a seguir. La conclusión es inevitable. Ninguna de esas extrapolaciones está a la altura del único experimento que puede conducir a hallazgos verosímiles, el ensayo de un nuevo compuesto en humanos.
También se conoce el isómero posicional del carbonato heterocíclico usado aquí. En vez de utilizar la benzoquinona como compuesto de partida con tiourea como la fuente de azufre (dando la orientación 1,4 a los oxígenos), puede comenzarse con resorcinol mediante su reacción con tiocianato amónico como fuente de azufre (en presencia de sulfato de cobre) y obtener el isómero posicional con una orientación de los oxígenos en las posiciones 1,3. Este compuesto (también conocido como tioxolona o 6-hidroxi-1,3-benzoxatiol-2-ona y que está a la venta) debería seguir el mismo procedimiento de síntesis que aquí se muestra para el análogo 5-hidroxilo y dar 5T-MMDA-2 (5-(2-aminopropil)-6-metoxi-1,3-benzoxatiol ó 2-metoxi-5,4-metilentiooxianfetamina) como producto final. Diría, sobre la base de los resultados de la comparación de la 5-TOM con la DOM, que este sería un compuesto de potencia relativamente baja. ¡Al menos debería ser fácil de sintetizar!