Обзор: Acadia Pharmaceuticals (Live)
Долгорукова Антонина, https://t.me/long_handsAcadia Pharmaceuticals (NASDAQ: ACAD)
Терапевтическая область: психиатрия, неврология, хроническая боль
Капитализация (20.07.22): $2.47 млрд, кэш: $446 млн, обязательства: $159,2 млн
На 31 декабря 2021 (за 2021 год):
- траты на R&D: $239.4 млн, (всего $654.6 млн)
- прибыль: $484.1 млн с продаж NUPLAZID® (+10% г/г),
Сотрудники (20.07.22): 500
Год основания: 1993
____________________________
🍄 Фокус компании: разработка новых молекул, в том числе синтетических аналогов эндогенных соединений, для лечения различных психиатрических состояний.
Сотрудничество
Acadia имеет эксклюзивную всемирную лицензию на разработку и коммерциализацию ACP-319 и других соединений программы M1 PAM от Университета Вандербильта (Vanderbilt University).
Acadia начала сотрудничество со Stoke Therapeutics для разработки и коммерциализации новых препаратов на основе РНК для лечения тяжелых и редких генетических заболеваний нервной системы, заплатив предварительно $60 млн.
Acadia и Neuren Pharmaceuticals заключили эксклюзивное Североамериканское лицензионное соглашение на разработку и коммерциализацию трофинетида для лечения синдрома Ретта и других состояний. Neuren сохраняет за собой права на разработку и коммерциализацию трофинетида для всех показаний за пределами Северной Америки.
Разработки на клинической стадии исследований
В пайплайне компании 4 препарата на клинической стадии исследований, один из которых уже одобрен в США и изучается по другим показаниям.
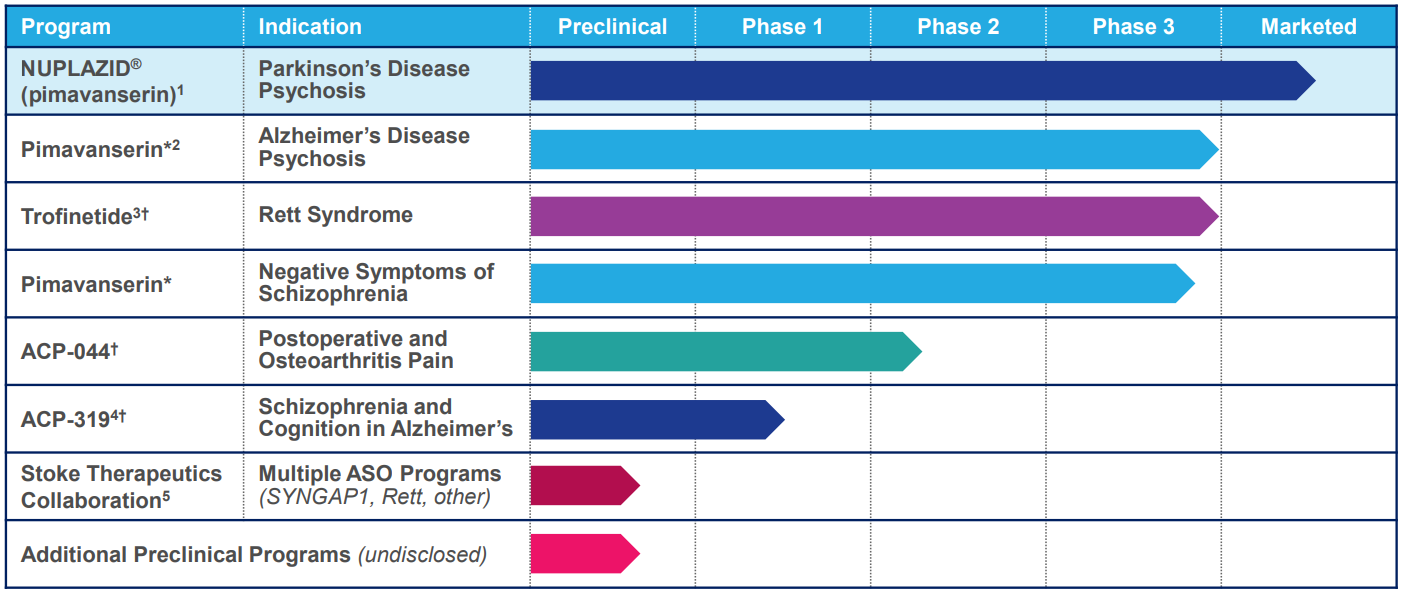
💊 Нуплазид (пимавансерин, pimavanserin tartrate, ACP-103, NUPLAZID®) одобрен FDA для использования в США в дозе 34 мг для лечения галлюцинаций и бреда, связанных с психозом при болезни Паркинсона.
❌ В апреле 2021 Acadia подавала заявку для расширения показаний к применению пимавансерина (sNDA) для лечения тех же симптомов при деменции, но получила отказ.
В CRL среди причин отказа было указано отсутствие статистической значимости в некоторых подгруппах и недостаточное количество пациентов с некоторыми подтипами деменции в КИ 3 фазы HARMONY; отсутствие адекватного дизайна и контроля в КИ психоза при болезни Альцгеймера фазы 2 -019 (1 центр), а также отклонения от протокола.
❗️ На последующей встрече в FDA пояснили, что лучшим путем является проведение дополнительных клинических исследований для каждого из вариантов деменции, для которых Acadia запрашивает одобрение, хотя готовы и обсудить дополнительный анализ исследований HARMONY и -019 и возможность повторной подачи заявки без дополнительного КИ. Acadia пошла по второму пути.
В феврале 2022 Acadia повторно подала sNDA для лечения галлюцинаций и бреда, связанных с психозом, вызванным болезнью Альцгеймера, сузив показания. PDUFA назначена на 4 августа 2022. 17 июня 2022 состоялось заседание консультативного комитета (Psychopharmacologic Drugs Advisory Committee, PDAC). Голоса разделились 9:3 против признания эффективности пимавансерина в лечении галлюцинаций и бреда у пациентов с болезнью Альцгеймера (док FDA).
Механизм действия
Пимавансерин - атипичный антипсихотик. Механизм действия неизвестен, но возможно связан с воздействием препарата на 5-HT2A и 5-HT2C серотониновые рецепторы. Рабочая гипотеза исследователей компании неплохо отражена в обзорной статье.
📖 Стоит добавить, что основное и наиболее эффективное лекарство, назначаемое при болезни Паркинсона - это предшественник дофамина L-3,4-дигидроксифенилаланин (L-DOPA). Однако при длительном приеме L-DOPA у пациентов развиваются неприятные осложнения - дискинезия и психоз. Считается, что в развитии обоих некоторую (до сих пор досконально не изученную) роль играют 5-HT2A рецепторы (Kwan et al., 2019). В то же время, об участии данных рецепторов в развитии психоза при болезни Альцгеймера известно и того меньше.
Безопасность
🔲 В инструкции есть т.н. “black box” – предупреждение о том, что среди пожилых пациентов с психозом на фоне деменции, которые находятся на лечении антипсихотиками, наблюдается повышенный риск общей смертности.
Кроме того, препарат приводит к удлинению интервала QT (признак на ЭКГ, говорящий о нарушении работы сердца). Пимавансерин, таким образом, нельзя принимать с некоторыми антипсихотиками, антибиотиками, антиаритмическими средствами и при некоторых аритмиях.
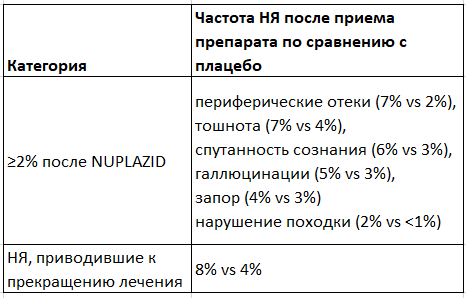
Уже после одобрения препарата сообщалось также о сыпи, крапивнице, реакциях, характерных для ангионевротического отека (например, отек языка, околоротовой отек, стеснение в горле и одышка), сонливости, падениях, возбуждении и агрессивности. Однако согласно отчету о постмаркетинговых исследованиях FDA ничего, несоответствующего описанному в инструкции, выявлено не было.
🤨 Препарат для купирования галлюцинаций у 5% (против 3% в группе плацебо) вызывает галлюцинации после 6 недель лечения. Странно, не правда ли? По сути это рецидив, а он случался в КИ HARMONY у 13% пациентов против 28% в группе плацебо. Не совпадает, так как методы оценки рецидива и НЯ - разные.
На clinicaltrials.gov зарегистрировано аж 32 КИ, 23 из которых завершены. В них участвовали пациенты с синдромом Туретта, тардивной дискинезией (осложнение длительного приёма нейролептиков), психозом на фоне болезни Альцгеймера и Паркинсона, с большим депрессивным расстройством, ажитацией и агрессией на фоне болезни Альцгеймера, с болезнью Паркинсона и депрессией, с шизофренией, пост-травматическим стрессовым расстройством и инсонмией. Другие 9 КИ 2-4 фаз сейчас в ходу.
Клинические исследования - большое депрессивное расстройство
Пимавансерин назначался как вспомогательное лечение в КИ CLARITY-2 и CLARITY-3, которые объединили из-за связанных с COVID-19 проблем с набором пациентов. Это КИ завершилось неудачей, хотя препарат несколько уменьшал нарушения сна/бодрствования - опубликовано в The Journal of Clinical Psychiatry). Исследований по данному направлению больше не начинали.

Клинические исследования - психозы, связанные с болезнью Альцгеймера
➡️ КИ 2 фазы-019 (181 пациент с психозом на фоне болезни Альцгеймера, 1 центр в Лондоне). Проведено с ноября 2013 по октябрь 2016. Пимавансерин назначался в дозе 34 мг на 12 недель. Результаты опубликованы в Lancet Neurology:
- достоверному снижению балла по шкале NPI-NH (оценка выраженности галлюцинаций и бреда, макс. 24 балла, разница с плацебо 1.8 балла (от -3.6 до –0.04), р = 0.0451) через 6 недель, но эффект пропадал через 12 недель;
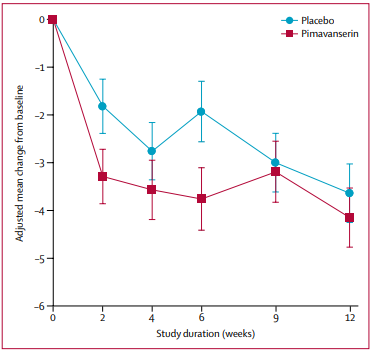
- ответ на лечение (30% улучшение) был у 55% участников лечебной группы и у 37% пациентов контрольной группы;
- смертность составила 4.4% в обеих группах; частота СНЯ составила 16.7% в группе пимавансерина против 11% в группе плацебо; частота НЯ - 74.4% против 76.9% в группе плацебо.
➡️ КИ 2 фазы SERENE (111 пациентов с ажитацией и агрессией на фоне болезни Альцгеймера, 56 центров, 5 стран). Проведено с ноября 2016 по февраль 2018. Пимавансерин назначался в дозе 20 или 34 мг на 12 недель. Завершено досрочно по коммерческим причинам. Результаты опубликованы на clinicaltrials.gov:
- смертность составила 0% в обеих группах; частота СНЯ составила 8.3%-11.4% в группах пимавансерина против 7.5% в группе плацебо; частота НЯ - 41.7-42.9% против 27.5% в группе плацебо;
- для изучения эффективности из-за раннего завершения мощности у КИ не хватило, но те результаты, что есть - не в пользу пимавансерина.
➡️ Открытое КИ 2 фазы безопасности (79 пациентов с болезнью Альцгеймера, 28 центров, 5 стран, продолжение SERENE). Проведено с февраля 2017 по февраль 2019. Пимавансерин назначался в дозе 20 или 34 мг на 7 недель. Результаты опубликованы на clinicaltrials.gov:
- смертность составила 3.85%; частота СНЯ - 15.4%; частота НЯ - 25.6%.
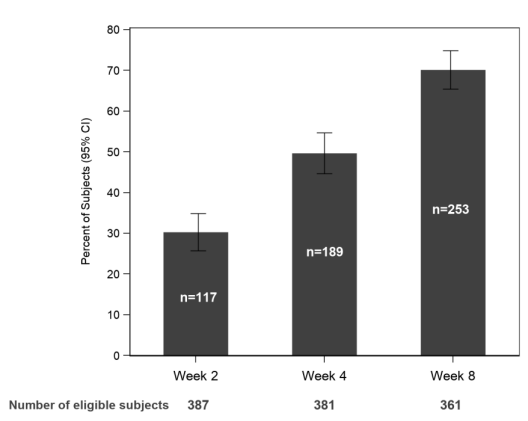
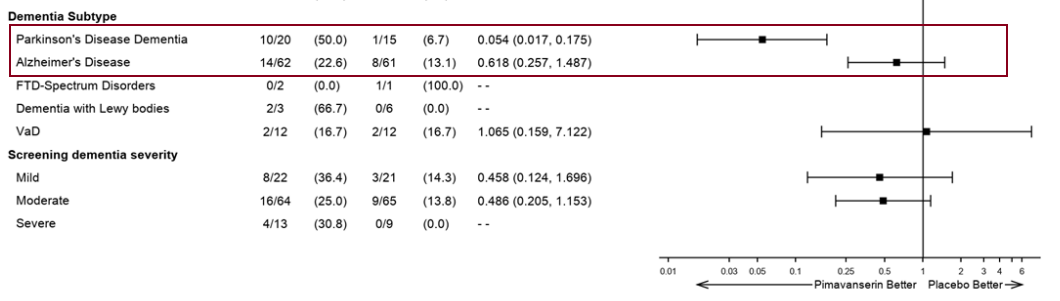
➡️ КИ 3 фазы HARMONY (392 пациента с галлюцинациями и бредом на фоне психоза, связанного с деменцией, 83 центра, 13 стран). В исследование были включены пациенты пяти вариантов деменции: болезнь Альцгеймера, деменция с тельцами Леви, лобно-височная деменция, деменция при болезни Паркинсона и сосудистая деменция. Проведено с сентября 2017 по октябрь 2019. Пимавансерин назначался в дозе 20 или 34 мг на 26 недель. Результаты опубликованы в The New England Journal of Medicine.
- На 8 неделе лечения у 72% (253/351) участников был ответ (30% улучшение по шкале для оценки выраженности психоза SAPS-H+D) на 8 неделе лечения, а на 12 неделе - у 61.8% (217/351). То есть у 14% ответ длится не более 8 недель. На рисунке нам это, правда, не показали.
Назначение пимавансерина по сравнению с плацебо приводило к снижению риска:
- рецидива психоза (HR=0.35, 95%ДИ=0.17-0.73, то есть для пациентов в группе пимавансерина в любой момент времени в течение периода исследования вероятность рецидива была на 65% меньше, чем у пациентов в контрольной группе, и мы на 95% уверены, что истинное значение находится между 27% и 83%);
- прекращения лечения (HR=0.45, 95%ДИ=0.26-0.78, то есть для пациентов в группе пимавансерина в любой момент времени в течение периода исследования вероятность прекращения лечения была на 55% меньше, чем у пациентов в контрольной группе, и мы на 95% уверены, что истинное значение находится между 28% и 74%).
- Смертность составила до 1% среди пациентов, принимавших пимавансерин и 0% в группе плацебо; частота СНЯ составила до 5.1% в лечебной группе против 3.6% в группе плацебо; частота НЯ - до 41% против 36.6% в группе плацебо.
Но если взглянуть пристальнее, есть и анализ в подгруппах, где видно, что эффективность при болезни Альцгеймера хромает...
➡️ КИ 3 фазы (784 пациента с нейропсихиатрическими симптомами, связанными с нейродегенеративным заболеваниями, 104 центра, 12 стран, включая Россию и Украину). Проведено с мая 2018 по май 2022. Пимавансерин назначался в дозе 20 или 34 мг на 8 недель. Результаты не найдены.
➡️ Открытое КИ 3 фазы - продолжение предыдущего для оценки переносимости и безопасности в течение 52 недель наблюдения.
📢 Результаты ожидаются: промежуточные и окончательные в августе 2023.
Вывод по направлению
✅ В повторной заявке Acadia несколько уточнила показания, теперь это не просто галлюцинации и бред на фоне любой деменции, а именно связанные с психозом, вызванным болезнью Альцгеймера (хотя, это самая частая причина деменции). Также новая заявка включает дополнительные анализы КИ HARMONY и КИ-019. Однако новые результаты, к сожалению, не огласили, так что оценить шансы на одобрение можно только по следующим фактам:
- в единственном целевом КИ 2 фазы с участием пациентов с болезнью Альцгеймера эффект краткосрочный и скорее похож на случайный выброс;
- в большем КИ 3 фазы о слабом эффекте в этой популяции говорит анализ риска рецидивов в подгруппах (косвенно, так как изначально мощность КИ для выявления различий в подгруппах не рассчитывалась);
- голоса участников профильного консультативного комитета (Psychopharmacologic Drugs Advisory Committee, PDAC) разделились 9:3 против признания эффективности пимавансерина в лечении галлюцинаций и бреда у пациентов с болезнью Альцгеймера.
- ну и в конце концов, фундаментально, роль воздействия на 5-HT2A рецепторы в развитии или купировании симптомов психоза при болезни Альцгеймера очень мало изучена.
❌ 5 августа компания Acadia Pharmaceuticals ($ACAD) объявила об отказе FDA в расширении показаний пимавансерина.

Клинические исследования - шизофрения
📖 Симптомы при шизофрении подразделяют на негативные и позитивные. К последним относятся галлюцинации, бред, возбуждение и т.п. Их способны купировать антипсихотики. В то же время негативные симптомы, такие как социальная изоляция, апатия, ангедония, потеря мотивации, снижение когнитивных функций - доставляют куда больше проблем пациентам, но методов лечения, утвержденных FDA, не существует.
➡️ КИ 3 фазы ENHANCE-1 (-034) (396 участников с шизофренией и неадекватным ответом на лечение антипсихотиками, 106 центров, 9 стран, включая Россию и Украину). Пимавансерин 10, 20 и 34 мг назначается в качестве дополнительного препарата на 6 недель. Проведено с октября 2016 по июнь 2019. Оценку проводили по шкале PANSS. Результаты опубликованы в Schizophrenia Bulletin Open.
- Препарат оказался не лучше плацебо;
- хотя авторы утверждают, что согласно дополнительным анализам в определенных подгруппах пациентов, пимавансерин оказал небольшой эффект на негативные симптомы.
- частота НЯ тоже была сопоставима в обеих группах ( 39.9% против 36.4% в группе плацебо).
➡️ КИ 2 фазы ADVANCE (403 пациента с преимущественно негативными симптомами шизофрении, достигшие адекватного контроля позитивных симптомов, 101 центр, 10 стран, включая Россию и Украину). Пимавансерин 10, 20 и 34 мг назначается в качестве дополнительного препарата на 26 недель. Проведено с ноября 2016 по октябрь 2019. Результат сообщили в пресс-релизе 25 ноября 2019. "Эффективной" оказалась лишь наивысшая доза:
- выраженность негативных симптомов шизофрении уменьшалась согласно баллу по шкале NSA-16 (макс. возможный балл = 96, -10.4 против -8.5; p=0.043)... мизерный эффект, хотя и статистически значимый.
- вторичные конечные точки не были достигнуты.
- Наиболее частыми НЯ были головная боль и сонливость. Хотя, частота НЯ была сопоставима в обеих группах (39.8% против 35.1% в группе плацебо). СНЯ были зарегистрированы у 2,0% пациентов, принимавших пимавансерин, и у 0,5% пациентов, принимавших плацебо, а количество прекращений лечения из-за нежелательных явлений также было: 5,0% для пимавансерина и 3,0% для плацебо.
➡️ КИ 3 фазы ADVANCE-2 (426 пациентов с преимущественно негативными симптомами шизофрении, достигшие адекватного контроля позитивных симптомов, 83 центра, 12 стран кроме США). Пимавансерин в дозе 34 мг назначается в качестве дополнительного препарата на 26 недель.
📢 Результаты ожидаются: окончание набора - в конце 2022, окончание исследования - в 2023. Эффективность в этот раз измеряют по шкале CGI-SCH-I.
➡️ КИ 3 фазы - расширение КИ -034 и 038. Пациентов, получивших лечение будут наблюдать 52 недели для оценки долгосрочных исходов.
📢 Результаты ожидаются: в 2024 г.
Вывод по направлению
✅ Итак, препарат изучается по данному показанию с 2016. На данный момент есть 2 почти полностью провальных исследования (ENHANCE-1 и ADVANCE) и еще 2 в ходу, причем основное - ADVANCE-2 проводится в 12 странах, включая Россию и Украину, но нет мед. центров в США. Перспективы пимавансерина в качестве средства для лечения негативных симптомов шизофрении видятся удручающими. Даже при удачном раскладе - если исследователи наковыряют-таки значимый эффект, устроит ли FDA заявка на базе двух КИ, одно из которых проведено полностью вне США?

💊 Трофинетид (trofinetide, NNZ-2566) - раствор для приема внутрь или через гастростому. Это синтетический аналог нейропептида инсулиноподобного фактора роста - 1 (ИФР-1, англ. IGF-1), разработанный Neuren Pharmaceuticals.
Имеет статус лекарства для редкого детского заболевания (Rare Pediatric Disease) от FDA, так как изучается в качестве лечения синдрома Ретта (наследственное заболевание, приводящее к тяжелой форме умственной отсталости, в основном встречающееся у девочек). Также имеет статус Fast Track и лекарства для редкого заболевания (Orphan Drug Designation) в США и Европе. Об этих и других статусах можно почитать здесь. 18 июля подана заявка на маркетинг в США на основании положительных результатов 1 КИ 3 фазы LAVENDER.
Трофинетид изучается в качестве терапии синдрома Ретта.
📖 Синдром Ретта это заболевание, которое вызвано в большинстве случаев случайными мутациями гена MECP2 и встречается почти исключительно у женщин (распространенность 1 на 10000 - 15000 тыс. или 0.007-0.01%). Симптомы включают трудности с речью, нарушения дыхания и координации движений, судороги, замедление роста и повторяющиеся движения. Поскольку MECP2 выполняет множество разнообразных функций в головном мозге, механизмы развития синдрома Ретта не установлены, и в настоящее время доступно только симптоматическое лечение. Показано, что у больных синдромом Ретта уровень ИФР-1 ниже обычного (что кстати, верно и для аутизма), а значит нормализация его уровня может положительно влиять на некоторые симптомы заболевания. Но это лишь гипотеза.
В КИ 1 фазы, проведенном учеными Harvard Medical School, другой синтетический аналог ИФР-1 мекасермин (mecasermin, INCRELEX®, Ipsen Biopharmaceuticals, подкожные инъекции) облегчал симптомы нарушения дыхания и поведения, однако в последующем КИ 2 фазы его положительные эффекты не подтвердились, а некоторые показатели напротив ухудшились (опубликовано здесь). Детальнее - эффект измерялся в том числе по шкалам CSBS‐DP (некоторое улучшение) и RSBQ (нет изменений).
INCRELEX® применяется для лечения задержки роста у детей с первичным дефицитом ИФР-1, но также сообщалось, что его прием может повышать риск доброкачественных и злокачественных новообразований.
Механизм действия
Показано, что трофинетид ингибирует выработку воспалительных цитокинов, ингибирует чрезмерную активацию микроглии и астроцитов в мозге и увеличивает количество ИФР-1.
Клинические исследования
Neuren Pharmaceuticals спонсировали ранние КИ трофинетида (всего 8) c участием пациентов с травматическим повреждением мозга (нет эффекта), синдромом умственной отсталости, сцепленным с ломкой хромосомой Х (Fragile X Syndrome), с синдромом Ретта: NCT01703533 (n = 67) и NCT02715115 (n = 82) - результаты здесь и здесь, а также опубликованы в Neurology®.
➡️ КИ фазы 3 LAVENDER (187 пациентов женского пола от 5 до 20 лет с синдромом Ретта, 21 центр США). Трофинетид в дозе 30-60 мл назначался на 12 недель. Проведено с ноября 2019 по октябрь 2021. Результаты огласили 6 декабря 2021.
- Согласно опроснику для оценки поведения при синдроме Ретта (RSBQ) изменение по сравнению с исходным уровнем на 12-й неделе составило -5,1 против -1,7 (p = 0,018).
- снижение балла по шкале общего клинического впечатления (CGI-I) на 12-й неделе составило 3,5 против 3,8 (р=0,003).
- также был значимый эффект по основной вторичной конечной точке (по шкале для оценки поведения (CSBS-DP-IT–Social).
- Частота прекращения лечения в связи с развитием НЯ составила 17,2% в группе трофинетида и 2,1% в группе плацебо. Наиболее частыми побочными эффектами (препарат против плацебо) были диарея (80,6 % vs 19,1%) и рвота (26,9 % vs 9,6%). СНЯ наблюдались у 3,2% участников обеих групп.
➡️ КИ 3 фазы Lilac (n = 180)и Lilac-2 (n = 153) - открытое исследование с участием пациентов из КИ LAVENDER.
📢 Результаты ожидаются: промежуточные и окончательные в октябре 2022.
Из конкурентов можно назвать NLX-101 (F15599, Neurolixis Inc.) - активатор серотониновых рецепторов 5-HT1A.
➡️ КИ 2/3 фазы DAFFODIL™ для оценки долгосрочных исходов. Указано всего 15 участников.
📢 Результаты ожидаются: промежуточные и окончательные в июле 2023.
Вывод по направлению
✅ Показанный эффект сложно назвать клинически значимым, ни по его величине ни по сути. Измеряли исключительно эффекты препарата на поведение и качество жизни, хотя существуют и субъективные методы оценки, а также биомаркеры.

💊 ACP-044, модулятор процессов восстановления - окисления для приема внутрь изучается для лечения острой и хронической боли.
Считается, что механизм действия ACP-044 связан со снижением повышенных уровней активных форм кислорода и азота, таких как пероксинитрит, которые участвуют в передаче болевых сигналов.
Клинические исследования
➡️ В КИ 2 фазы (239 пациентов) ACP-044 назначался в дозах 1600 мг 1 раз в день или 400 мг 4 раза в день после ортопедической операции (бурсэктомия). Согласно результатам, оглашенным 18 апреля 2022, интенсивность боли по 10-ти бальной шкале NRS (Numeric Rating Scale),не различалась в группах ACP-044 и плацебо.
➡️ КИ 2 фазы с участием 240 пациентов с остеоартритом (40 центров США).
📢 Результаты ожидаются: окончательные в 1 половине 2023.
Вывод по направлению
✅ Пока недостаточно данных.

💊 ACP-319 - основной кандидат программы Acadia M1 PAM - позитивный аллостерический модулятор М1 ацетилхолиновых рецепторов. Предполагается, что модуляция этого рецептора может положительно сказаться на когнитивных функциях пациентов с болезнью Альцгеймера.
Клинические исследования
➡️ КИ 1 фазы - подбор дозы.
📢 Результаты ожидаются: промежуточные в xx xxxx, окончательные в xx xxxx.
Вывод по направлению
✅ Пока недостаточно данных.
____________________________
Написанное здесь не является инвестиционной рекомендацией. Это живой обзор, он будет периодически обновляться.
Последнее обновление: 5 августа 2022.