Необычный случай рака эндометрия, побуждающий к новым вопросам и новым темам для размышления
Чиж ГригорийЖирный дисклеймер перед предстоящим обсуждением. На мой взгляд, ограничение и даже некоторая опасность кейс – репортов в том, что мы рискуем совершить ошибку выжившего. В данном кейсе пациентка получила олапариб и выиграла 15 месяцев PFS, но мы ничего не знаем о тех случаях, когда применение олапариба при данном заболевании было безуспешным (мало кому хочется публиковать негативные кейс – репорты).
Сам кейс репорт можно найти и ознакомиться самостоятельно тут. Выжимка того, что происходило с данной пациенткой, изображена на представленной выше хронологической схеме.
Изначально весь этой кейс и найденные данные наводили меня на мысли об условности разделения рака тела матки на молекулярно – генетические подтипы, во всяком случае, в контексте наследственно обусловленных дефектов репарации ДНК.
Ну вот судите сами, разве не может исходно существующий подтип рака тела матки, например copy number low, в результате существования в ней BRCA – ассоциированного дефекта гомологичной рекомбинации (HRD) приобрести мутацию р53 и накопить грубые хромосомные нарушения, укладывающиеся в рамки copy number high? Или накопить такое бешенное количество мутаций, чтобы ее можно было отнести к гипермутированному подтипу? (хотя POLE – мутированным подтипом она от этого не станет без POL – e мутации). А если в ней случится эпигенетическое или мутационное выключение белков MMR и что тогда? Как обозвать эту хрень в рамках молекулярной классификации? Как классифицировать случаи рака тела матки при наличии наследственных мутаций, которые, пусть и не становятся убедительной причиной возникновения рака тела матки, но которые потенциально способны вмешиваться в развернувшийся процесс канцерогенеза? Вопрос, пока остающийся без ответа. Пахнет софистикой, поэтому вернемся к кейсу.
Случай необычный в очень многих отношениях, и очень ценный сам по себе, несмотря на то, что сам кейс – репорт является примером того, «как нужно писать кейс - репорты, чтобы у людей оставались вопросы». Главные вопросы, которые были у меня:
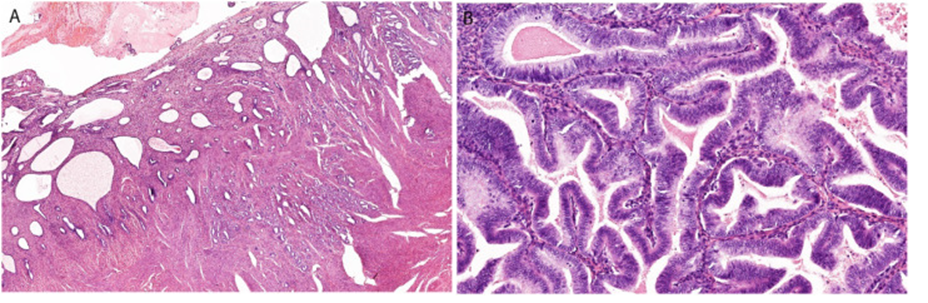
- очень ограниченное количество снимков (№2), а те снимки, что предоставлены, вызывают неоднозначное суждение относительно природы опухолевого очага. Если бы не описания результатов диагностической операции при последнем рецидиве, дважды гистологически верифицированная карцинома эндометрия я бы всерьез задумался, не пытаются ли меня обмануть и выдать за опухоль нечто кистозное и доброкачественное, отталкиваясь от снимков. Я, конечно не МР – диагност, но если вглядеться в снимок до начала лечения олапарибом, то обращают на себя внимание уж очень ровные края опухоли и уж слишком гомогенная структура очага. Как минимум, у меня было бы желание пересмотреть гистологические препараты или даже ре-биопсировать. К слову о пересмотре.
- не возникало ли у исследователей желание пересмотреть гистологические препараты, учитывая нетипичную картину заболевания? Ведь посудите сами – изначально диагностирована эндометриоидная карцинома эндометрия low grade, ничего не обещало столь длительную борьбу с данным заболеванием – высокодифференцированная опухоль, стадия IA, без лимфоваскулярной и периневральной инвазии, без инвазии миометрия… и столь длительно рецидивирующая история. WTF
Можно ли списать столь длительно рецидивирующую историю на наличие у пациентки наследственной BRCA2 – мутации? Я бы не решился – с учетом того, что риск не то, что рецидива - возникновения рака эндометрия при наследственной BRCA 2 – мутации на сегодняшний день убедительно не продемонстрирован. Есть данные насчет BRCA 1 мутации, но они касаются серозной карциномы эндометрия, в нашем же случае – эндометриальная. Да, и по правде говоря, сами данные не то, чтобы прям убедительные.
- По данным Catherine A. Shu и соавт. от 2016 года, носительницы BRCA1 мутации после профилактической билатеральной сальпингоофорэктомии (вынос маточных труб с яичниками без матки), имеют повышенный риск возникновения серозного рака эндометрия. Продемонстрировано это на группе 1000+ пациенток с наследственными BRCA мутациями, у восьми из которых в последующем возникла ЗНО эндометрия.
- Данные по этому вопросу дополнились в 2021 году и дополнились результатами проспективного когортного нидерландского исследования. Согласно им, в зоне риска оказывались пациентки с BRCA 1, но не BRCA 2 мутацией. Риск по - прежнему относился преимущественно к серозной карциноме эндометрия, в меньшей степени эндометриоидной. В отношении BRCA 2 – мутации риск по – прежнему не доказан.
Между тем, сюрпризом для коллег стало обнаружение, помимо зародышевой, еще и соматической мутации BRCA 2 (double kill)
Как я уже отмечал ранее, событие для эндометриальной карциномы редкое, но не сказать, что невозможное – минимум несколько таких кейсов я нашел точно:
К сожалению, я не могу исключить проблемы на диагностическом этапе, поскольку упорно рецидивирующая карцинома эндометрия, с дефектами гомологичной рекомбинации (если мы подозреваем наследственно обусловленную природу опухоли в данном случае), опять же напрашивается мысль, не серозная ли это карцинома эндометрия).
То, что исходит из эндометрия, сомнений нет –придатки матки пациентке снесли еще до начала всей этой истории. А судя по повествованию, других опухолей у пациентки нет, и прилететь откуда бы то ни было, не могло (либо она не дообследована, откуда ж я знаю, это же не написали).Так что давайте разбираться.
Как можно объяснить такое клиническое поведение и ответ на олапариб?
Спорадическая BRCA 2 мутация в опухоли эндометрия – возможна, возможна, по видимому, и в эндометриоидном подтипе рака эндометрия. И если она возникает, да еще и накладывается на уже существующую почву в виде зародышевой мутации BRCA, мы сталкиваемся с уже известным нам дефектом гомологичной рекомбинации, геномной нестабильностью и возможной высокой мутационной нагрузкой - поскольку «починка» дефектов ДНК в условиях HRD страдает. А здесь уже можно выжать эффект из PARP – ингибиторов и даже иммунотерапии.
К такому выводу пришли Evan S. Smith и его команда, просеквенировавшая тринадцать опухолевых образцов (сколько удалось найти среди семи сотен пациенток) рака эндометрия у пациенток с носителями germ -мутации BRCA. У многих из них альтерация BRCA носила биаллельный характер – т.е. дефекты имелись в обеих «версиях» (аллелях) гена BRCA 1 или 2. Прям как у пациентки, которую мы обсуждаем.
В данном случае, очевидно, наличие BRCA 2 – мутаций стало одним из факторов, который детерминировал успех олапариба в данном случае, и я надеюсь, вы прекрасно помните, почему PARP – ингибиторы неплохо работают при BRCA – мутациях.
Эффективность PARP – ингибиторов убедительно продемонстрирована для рака молочной железы и яичников при BRCA - мутациях, но в отношении рака эндометрия известно гораздо – гораздо меньше. Отсюда и ценность подобных кейс – репортов.
Но может ли олапариб, чисто теоретически, быть эффективен в отсутствии дефектов гомологичной рекомбинации? Во всяком случае, если никакие мутации в опухолевой клетке не затрагивают участников этой сложной системы? Для ответа на этот вопрос представляю еще один кейс – репорт.
Кейс № 2: объективный ответ при PTEN - мутированной метастатической карциноме эндометрия без BRCA - мутаций
В нем рассказывается о пациентке с метастатической эндометриальной карциномой эндометрия (поражение печени, легких, брюшины и костей).
Лечилась пациентка долго (более 10 лет) – в анамнезе гистерэктомия, сальпингоофорэктомия, ДЛТ на область малого таза, которые, в прочем, не уберегли от прогрессирования заболевания в виде множественного метастатического поражения. На протяжении 9 лет пациентка несколько раз получала платино – содержащую химиотерапию, паклитаксел, липосомальный доксорубицин. На момент последнего прогрессирования характер распространения опухолевого процесса выглядел следующим образом:
С учетом предлеченности и предшествующего неоднократного ответа на платину, пациентке предложено участие в клиническом исследовании первой фазы, где исследовали олапариб (это было более 10 лет назад). Пациентка согласилась и спокойно себе принимала олапариб по 400 мг в сутки.
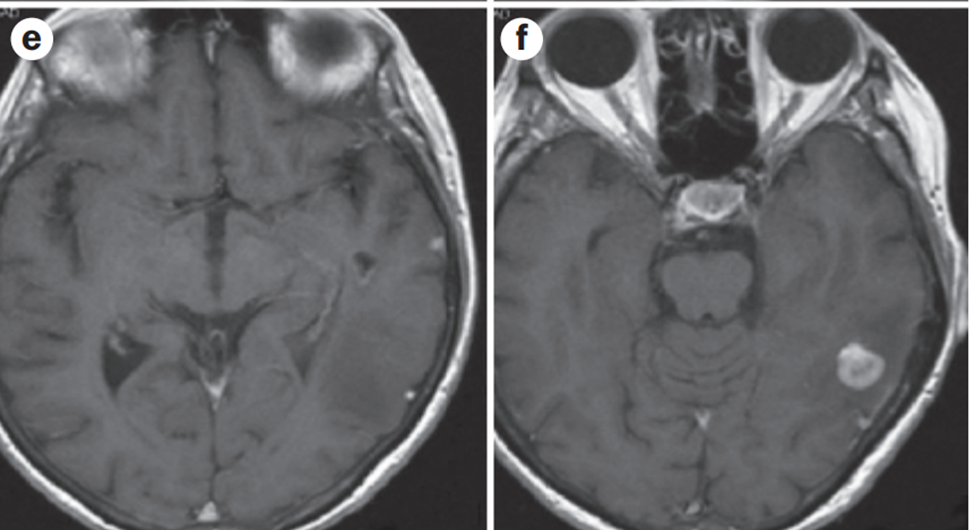
Но через две недели с пациенткой случаются эпизоды транзиторной ишемической атаки. Выясняется также, что это не впервые. Это побуждают к обследованию головного мозга, где находят вот такую картину (4 неделя лечения олапарибом):
Пациентке предлагают лечение кортикостероидами и whole brain – облучение головного мозга, но, в ходе обсуждения и взвешивания всех за и против с пациенткой, принято решение повременить и продолжить олапариб, с условием дисциплинированного прохождения пациенткой регулярного обследования.
Буквально через две недели неврологический статус пациентки улучшается. А на 10 недели лечения олапарибом, к удивлению всех, наблюдалась такая картина:
И стабилизация по экстракраниальным очагам:
К 20 недели лечения – разноплановая динамика по внечерепным очагам (увеличение очага в ребре, уменьшение поражения легких, стабильная картина в печени):
Но в головном мозге – прогрессирование. И пациентку подвергают лучевой терапии, при этом продолжая олапариб.
Суммарно пациентка пробыла на олапарибе 8 месяцев, пока прогрессирование не стало более красноречивым. И тогда пациентке снова дали платину, ее дальнейшая судьба неизвестна…
Стоит отметить, что несмотря на отягощенный наследственный анамнез по раку молочной железы, BRCA – мутаций у пациентки не было. Были ли другие варианты HRD – черт его знает, но случай примечателен не этим.
Исследователи обратили внимание на наличие у пациентки PTEN – мутации. Не то, чтобы в этом что – то особенное, весьма частое явление для рака эндометрия.
Но вот в контексте применения PARP – ингибиторов, взаимоотношения PTEN и системы гомологичной рекомбинации, дело становится интереснее. И тут хотелось бы остановиться чуть подробнее.
Взаимоотношения PTEN и белков системы гомологичной рекомбинации
Мне неизвестно, знали ли вы об этом или нет(я вот не знал), но биологическая роль PTEN белка, оказывается, сводится не только к негативной регуляции PI3k-AKT-mTOR каскада (тут он играет роль онкосупрессора). Биологическая роль PTEN заключается еще и в поддержании стабильности клеточного генома (хромосомной стабильности) и активности системы гомологичной рекомбинации. Это продемонстрировано Shen et al в 2007 году на животных моделях. Но как именно, спросит кто – то?
Когда клетки подвергаются воздействию ионизирующего излучения или химиотерапевтических агентов, повреждающих ДНК, образуются двухцепочечные разрывы (DSBs), которые быстро приводят к ATM – опосредованному фосфорилированию гистона H2AX.
Поскольку фосфорилирование H2AX в Ser 139 (γ-H2AX) обильно, быстро и хорошо коррелирует с каждым DSB, это наиболее чувствительный маркер, который можно использовать для изучения повреждения ДНК и последующего восстановления повреждения ДНК. Что и сделал Shen со своей командой.
Ребята хотели сравнить частоту спонтанных двуцепочечных разрывов ДНК (маркером которых выступает H2AX – P) в зависимости от статуса гена PTEN, что они и сделали с помощью иммуноблоттинга. Мыши, у которых ген PTEN был нокаутирован, прослеживалась более высокая экспрессия H2AX – P (29,5% против 4,1%), хотя, статистического обсчета тут не осуществили…
Это привело исследователей к мысли, что в условиях отсутствия белка PTEN, спонтанные двуцепочечные разрывы наблюдаются чаще в силу нарушения механизма гомологичной рекомбинации (так как это ее ниша). Поэтому,следующим шагом стала оценка экспрессии генов HR в PTEN + и PTEN – клетках. И обнаружили снижение белков RAD51 в клетках, в которых отсутствовал PTEN. Особенно красноречиво связь между PTEN и RAD51 вырисовалась, когда PTEN – нокаутированным мышам вводили вектор Rad51, pcDNA3 / Mr 51, при котором экспрессия H2AX снижалась до того уровня, как это прослеживалось в PTEN – позитивных клетках.
Молекулярная природа функциональной связи между PTEN и RAD51 в деталях остается не особо понятной, но тем же Shen объясняется синергизмом между PTEN и фактором транскрипции E2F-1.
А вот как он реализуется, этот синергизм? Внятным объяснением мне представляется AKT – опосредованное фосфорилирование Chk1 (Chk1 - один из эффекторов системы гомологичной рекомбинации), тем самым блокируя активность данного белка. Но почему тогда выпадает функция только RAD 51 белков? Почему интактной остается экспрессия того же пресловутого BRCA? По видимому, соль не в AKT, хотя негативная и протоонкогенная роль AKT - киназы (гиперфункциональной в отсутствии белка PTEN) становится еще более красноречивой. А нарушение гомологичной репарации ДНК и накопление дефектов и мутаций в ее структуре – еще более закономерными.
Помимо этого, этими же ребятами продемонстрирована роль PTEN в поддержании стабильности центромер во время митотического деления, но это вообще отдельная история.
Заключение
При мутации PTEN вполне ожидаемыми оказываются нарушения в системе гомологичной рекомбинации, не связанные напрямую с мутациями генов – эффекторов этой сложной системы. А если вспомнить, что мутация PTEN – характерное явление для большинства молекулярных подтипов карциномы эндометрия, то тогда все встает на свои места, и причина ответа в представленных кейсах становится понятной.
В первом кейсе нарушения в системе гомологичной рекомбинации могли быть взаимно усиленны наличием мутаций BRCA 2 и мутацией PTEN (напрямую о ней не сообщалось, но вероятность этого не маленькая). Во втором случае, причина ответа на олапариб могла бы быть напрямую связана с PTEN – мутацией и реализацией всех вышеописанных событий. Но почему могла бы быть? Потому что наверняка сказать об этом я не могу. И насколько отношения PTEN - белка и HR – системы (в условиях альтерации PTEN) терапевтически значимы – еще только предстоит выяснить. Потому как то, что красиво выглядит в доклинических моделях и в теории, не всегда конвертируется в новые успехи лекарственной терапии…
Но отдельные исследования по этому поводу уже ведутся.