Дефекты гомологичной рекомбинации и роль в развитии опухоли
Григорий Чиж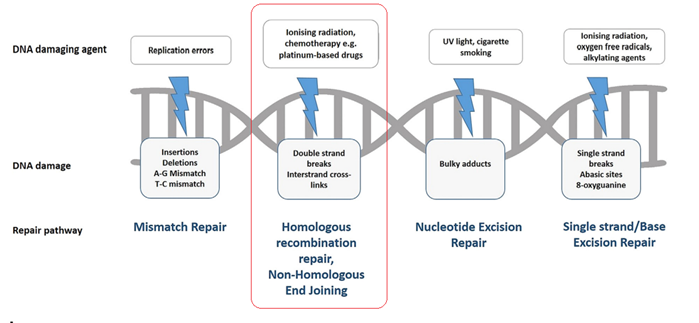
Гомологичная рекомбинация (рекомбинационная репарация ДНК) направлена на восстановление репликативных вилок, застопорившихся на месте повреждений в ДНК. Она наиболее актуально, когда кусок цепи ДНК выходит из чата по самым разным причинам – речь о двухнитевом разрыве ДНК.
Сама по себе гомологичная рекомбинация заключатся в «обмене» участков ДНК между сестринскими хромосомами: ДНК с дефектным участком одной хромосомы обменивается с другой (в рамках одной пары хромосомы) соответствующими участками ДНК. В дальнейшем происходит достраивание цепей ДНК на обеих хромосомах и все счастливы, ошибки нивелированы. (если объяснение показалось сложным – вспомните кроссинговер в мейозе из курса биологии 10 класса – принцип тот же)
Долгое время считалось, что BRCA 1 и BRCA 2 белки являются главными белками данной системы, и что мутация их генов – единственная причина состояния, получившего название дефект гомологичной рекомбинации (HRD). Современные данные свидетельствуют о том, что гомологичная рекомбинация является системой с множеством молекулярных участников, и выпадение любого из них может привести к HRD. Кратко осветим роль каждого участника этой вечеринки.
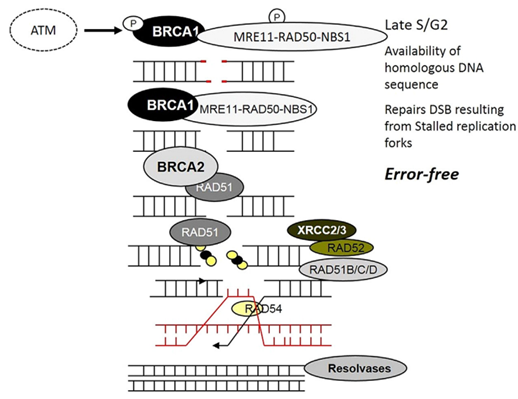
АТМ (протеинкиназа, мутирующая при атаксии – телеангиэктазии) является сенсором, улавливающем повреждение ДНК (посредством геликазы) в виде двухнитевых разрывов. Пока в клетке не происходит ничего разрушительного, АТМ существует в виде мультимеров (в неактивном состоянии) Но в условиях повреждения ДНК происходит аутофосфорилирование АТМ – белка, распад мультимеров на мономеры, которые обладают киназной активностью и готовы активировать всё, что встанет у них на пути.
Долгое время было крайне непонятно, какие именно молекулярные процессы приводят к активации АТМ и где молекулярный мостик между двойными разрывами ДНК и АТМ. Ответ кроется в существовании в ядре поли (АДФ – рибоза) -полимеразы или так называемого PARP – 1 белка.
PARP – 1 считается детектором одноцепочечных повреждений ДНК, т.е. тех повреждений, которые возникают в рамках одной цепи ДНК. Однако, данные in vivo демонстрируют недостаточную активацию АТМ в отсутствие PARP – белков, что наводит на мысль о важности, необходимости PARP – белков в реализации программы и рекомбинантной репарации ДНК.
В действительности, PARP – белки оказываются универсальным сенсором повреждений ДНК.
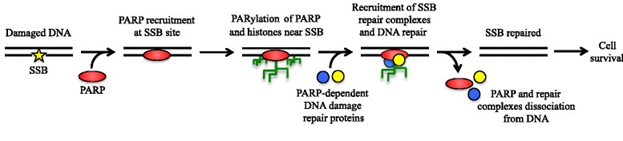
Роль PARP – белков сводится к:
- распознаванию повреждений ДНК, в том числе двухцепочечных разрывов
- рекрутирование и активация различных белков, участвующих в синтезе ДНК и в репарации путём присоединения поли-АДФ – рибозилирования (насильным присоединением к белкам цепочки из АДФ. Одним из которых является АТМ
Иными словами, PARP фиксируют любые повреждения ДНК и сигнализирует об этом клетке, а в случае двухцепочечных разрывов ДНК, PARP способствует активации АТМ – белка. Это ещё не значит, что без PARP – белка АТМ не сможет распознать двойные разрывы ДНК, это лишь означает, что без PARP – белка весь процесс запуска гомологичной рекомбинации идёт туго, но не блокируется полностью.
АТМ, в свою очередь, является эффектором, активирующим «нижележащие» мишени (что – то по аналогии с митогенными сигнальными каскадами). Мишеней достаточно, и это становится ясно, глядя на схему ниже:
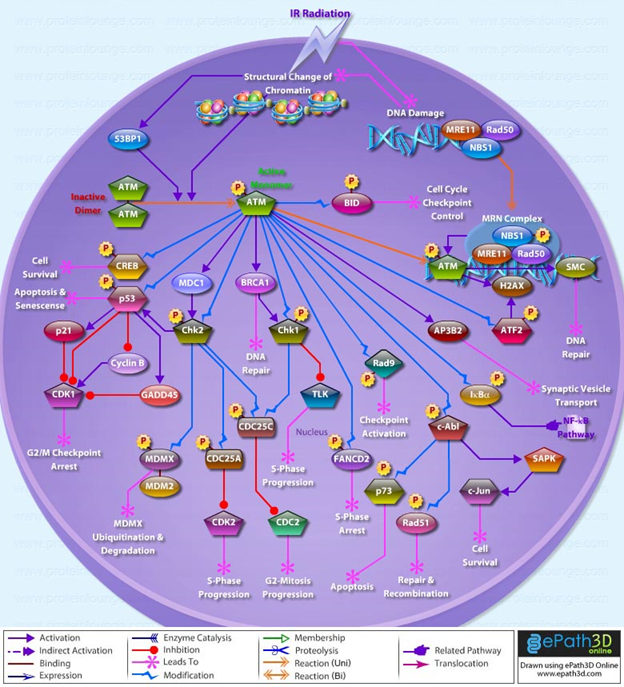
Особого внимания заслуживают следующие эффекторы:
Check2 (CHEK2) – следующий эффектор, который активируется АТМ. CHEK2 запускает несколько осей:
Ось один: остановка клеточного цикла. CHEK 2 выключает Cdc25 (активирующий CDK1 киназу, опосредующую вход клетки в фазу митоза). Выполняя столь героическое действие по Cdc25, CHEK2 стремится остановить клеточный цикл. Эта ось обеспечивает отсутствие перехода в митотическую фазу, пока не будет отрепарирована ДНК.
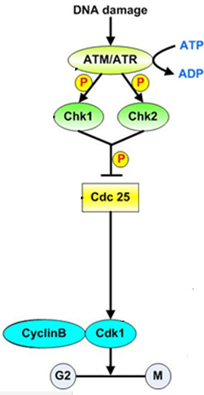
Если повреждение ДНК не удалось исправить в течение опреелённого времени, CHEK2 способствует активации р53 и запуску программы апоптоза:
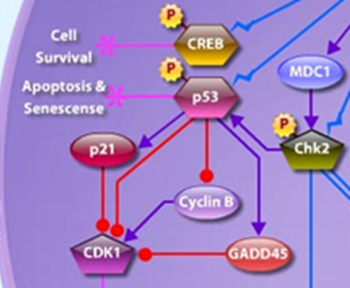
Ось два: активация эффекторов рекомбинантной репарации. К собственно эффектором репарации, белкам, чьими «руками» будет осуществляться восстановление нормальной структуры ДНК, относятся:
- пресловутые BRCA1 и BRCA 2 белки
- PALB2 (Partner And Localizer Of BRCA2) – белок
- RAD51 – рекомбиназа (и её различные варианты – RAD51b, RAD51c, RAD51D, а также RAD52
- BRIP – 1 или FANCJ (на картинке не показано) – усиливает активность BRCA 1, по - видимому, функция аналогично белку PALB2
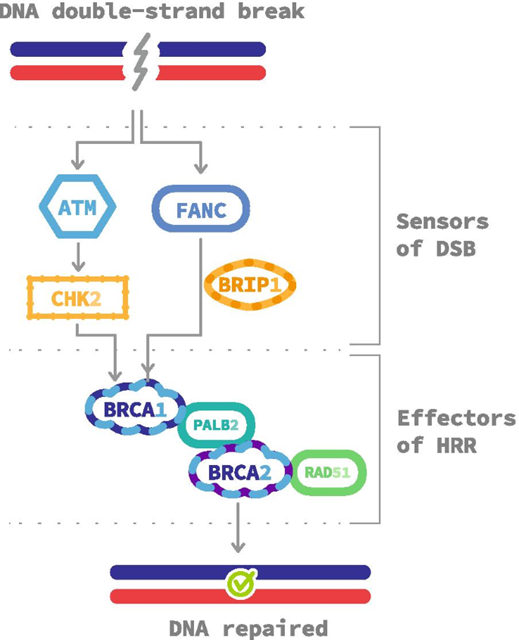
Данные белки собираются в одну огромную репаративную машину, которая непосредственно восстанавливает структуру ДНК: осуществляет эксцизию повреждённого конца ДНК, собственно рекомбинацию участков ДНК и достраивание новых цепей.
Таким образом, гомологичная рекомбинация (рекомбинативная репарация ДНК) является процессом, в реализацию которого вовлечено огромнейшее количество белков, и я коснулся лишь основных из них. Вы не обязаны запоминать их функцию и названия, я лишь хочу донести, что, например, тот же наследственный рак молочной железы или яичников – это далеко не только про BRCA: мутация любого из генов описанных выше белков ведёт к нарушению процессов репарации, повышению мутагенности клетки и развитию злокачественной опухолевой клетки.
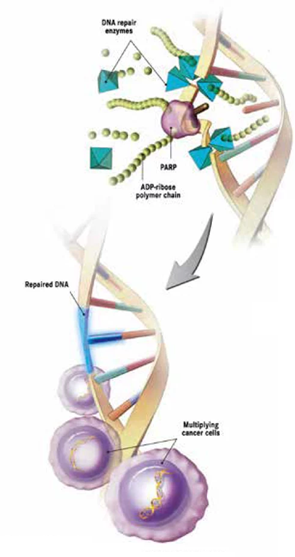
Дефекты гомологичной рекомбинации и рак молочной железы
В этом году опубликованы результаты исследования, в котором оценивалась роль мутации различных генов в развитии рака молочной железы на популяции в более чем 100 тысяч пациентов – половина с раком молочной железы, а вторая половина – группа контроля без рака. У тех и других проводилось секвенирование на предмет наличия мутаций, выражающейся в выпадении функции различных белков. Результаты были следующими:
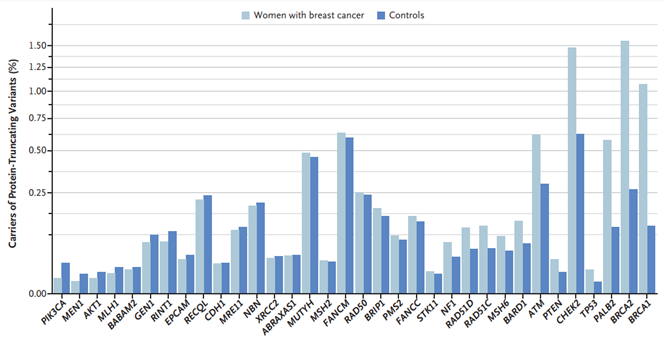
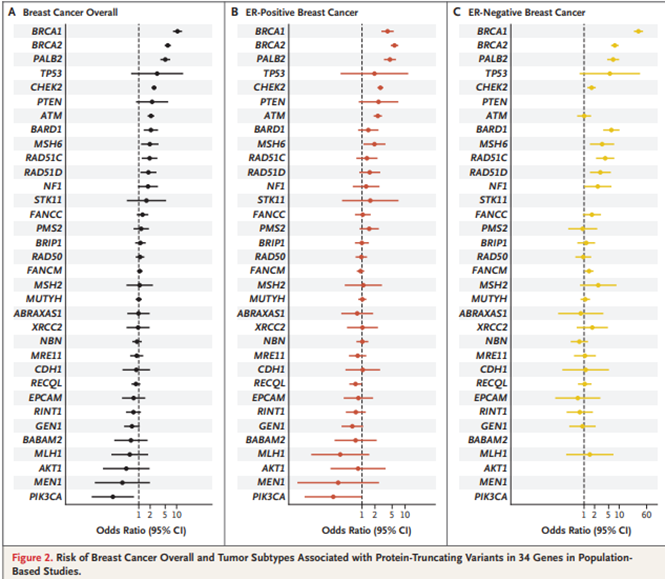
Важно понимать, что речь идёт лишь о шансе возникновения рака молочной железы в течение жизни при наличии вышеописанных альтераций и результаты исследования не дают информацию о предполагаемом возрасте возникновения рака молочной железы. Однако, данный шанс способен реализоваться в течении 80 лет с большей вероятностью при наличии одной или нескольких мутаций, чем в популяции без данных мутаций
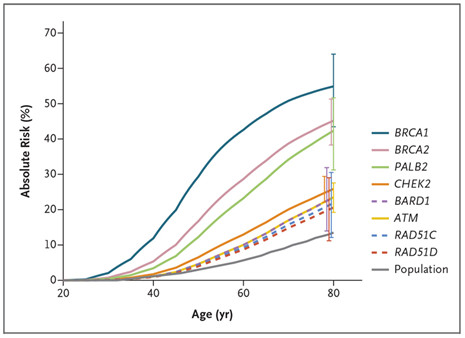
Дефекты гомологичной рекомбинации и рак яичников
Речь идёт о high – grade серозной карциноме яичников – наиболее частом (70% + случаев) варианте эпителиальных опухолей яичника.
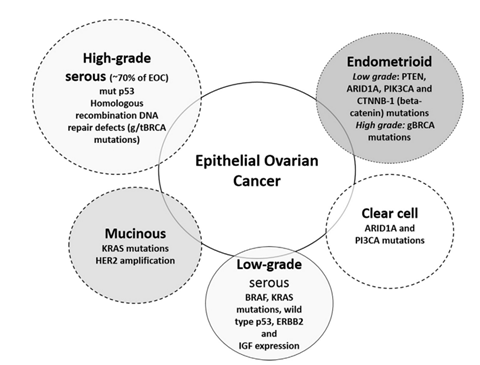
В патогенезе данного заболевания, по литературным данным, важную роль могут играть дефекты гомологичной рекомбинации. Об этом было известно ещё в 2011 году, теперь об этом знаете и вы.
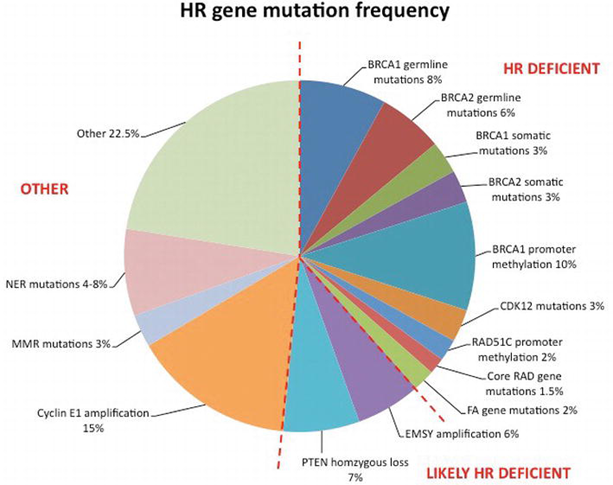
Что примечательно: почти половина случаев high grade серозной карциномы яичника обусловлены дефектом гомологичной рекомбинации, но лишь 14% связаны с BRCA – мутацией.
К сожалению, нам пока не доступно рутинное определение мутаций в других генах, ответственных за реализацию гомологичной рекомбинации ДНК. Это было бы очень кстати, учитывая данные о целесообразности применения PARP – ингибиторов и алкилирующих агентов при наличии данных молекулярно – генетических изменений. Но о терапевтической роли HRD мы подробно поговорим в следующем лонгриде. Не отключайтесь