El nanomundo en tus manos
6. Nanoquímica: el puzle de las moléculas
Página 15 de 22
— 6 —
NANOQUÍMICA: EL PUZLE DE LAS MOLÉCULAS
—¡Joven! ¡Joven! —exclamó apesadumbrado el monje— ¿por qué deseas con tanto ahínco encontrar compañía? ¿Por qué les atraerá tanto la vida mundana a los electrones? Sin embargo, si insistes en tener compañía, te ayudaré a satisfacer tu deseo. Si miras en la dirección a la que estoy apuntando, verás a un átomo de cloro que se está acercando a nosotros e, inclusive, a esta distancia, puedes ver un espacio sin ocupar en el que serás muy bien recibido. El lugar vacío se halla en el grupo exterior de los electrones, la llamada envoltura o nivel electrónico M. Cuando los dos átomos estén muy cerca el uno del otro, no tienes más que saltar, como lo suelen hacer los electrones de valencia. ¡Y que mi paz sea contigo, hijo mío!
Al decir estas palabras, la impresionante figura del sacerdote electrón se desvaneció repentinamente en el aire. Sintiéndose mucho más reconfortado, el señor Tompkins reunió sus fuerzas para dar un salto mortal en la órbita del átomo de cloro que pasaba. Para su sorpresa, pudo dar el salto grácilmente y se encontró en el acogedor ambiente de los miembros de la envolvente M del cloro.
—¿Por qué no se va ese átomo que acabas de dejar? —le preguntó su compañero frunciendo el ceño—. ¿Esperará que regreses? —Y, en efecto, el átomo de sodio, que había perdido su electrón de valencia, se apretaba contra el de cloro como si esperara que el señor Tompkins cambiara de parecer y saltara de nuevo a su órbita solitaria.
—Vaya, ¿qué te parece? —le preguntó enfadado el señor Tompkins, haciéndole una mueca al átomo que poco antes le había recibido con tanta frialdad—. Ése ni come, ni deja comer.
—¡Bah!, ésos siempre hacen lo mismo —intervino un miembro más experimentado de la envolvente M—. Durante el tiempo que permanezcas aquí nuestro átomo no será ya neutral, sino que tendrá una carga electrónica adicional. Por eso el átomo de sodio sigue ahí, detenido por la fuerza de la atracción eléctrica. Le oí decir cierta vez al padre Paulini que esas comunidades atómicas, a las que les sobra o les falta un electrón, son llamadas iones positivos y negativos.
GEORGE GAMOW, La investigación del átomo, 1939
6.1. Química y nanotecnología
En los capítulos anteriores, y fundamentalmente en el dedicado a nanomateriales, ha quedado patente que para lograr avances importantes en nanociencia y nanotecnología es necesario ser capaz de obtener y manipular de manera controlada entidades de tamaño nanométrico. Y para que nos ayude a lograr este objetivo, nada mejor que recurrir a una ciencia que todos conocemos bien, la química.
Hoy en día es habitual escuchar en diferentes foros que todo lo que nos rodea en nuestra vida cotidiana es química. Esta afirmación, que habremos oído en numerosas ocasiones, es una consecuencia de la definición de química que podemos encontrar en cualquier libro de texto: «ciencia que estudia la estructura, propiedades y transformaciones de la materia a partir de su composición atómica». Y puesto que en nuestro día a día todo lo que tocamos, vemos, olemos o saboreamos está relacionado con compuestos químicos (y éstos a su vez se encuentran formados por átomos), no cabe duda de que nos encontramos rodeados de «química». Tanto es así que independientemente de cuál sea nuestra formación en esta disciplina, todos somos conscientes de cómo sus múltiples aportaciones a lo largo de la historia han permitido mejorar considerablemente el bienestar general de la sociedad. Un reflejo de ello fue la declaración, por parte de la Unesco, del año 2011 como «Año Internacional de la Química», cuya celebración incluyó numerosos actos en todo el mundo que pretendían poner de manifiesto su gran relevancia en nuestras vidas.
Entre otras cosas, la química nos enseña cómo partiendo de unidades elementales (los átomos) se construye el mundo circundante. Así, las moléculas de agua con las que nos lavamos la cara cada mañana provienen de la combinación de dos átomos de hidrógeno y uno de oxígeno, o la cafeína que consigue despertarnos a diario está formada por ocho átomos de carbono, diez de hidrógeno, cuatro de nitrógeno y dos de oxígeno. Como nos demuestran los sueños del señor Tompkins, cualquiera de nosotros estamos en mayor o menor medida familiarizados con la forma en que a partir de diferentes átomos se originan las moléculas que conforman nuestro entorno. Así sabemos, por ejemplo, que en los enlaces que dan lugar a la formación de un compuesto químico están involucrados los electrones más externos de los átomos que lo forman, y que dependiendo de cuál sea su estructura electrónica, cada átomo se enlazará de una manera u otra a sus vecinos, resultando diferentes tipos de fuerzas de cohesión, gracias a las cuales se mantienen unidos.
Pues bien, en el presente capítulo se pretende ir «más allá» y ver, por ejemplo, cómo esas moléculas formadas por agrupaciones de átomos son capaces de unirse entre sí generando estructuras de mayor tamaño, objetos nanométricos que harían las delicias oníricas del señor Tompkins. En definitiva, se trata de profundizar en las aproximaciones, estrategias o herramientas pertenecientes al mundo de la química que van a permitir desarrollar estructuras de tamaño nanométrico con propiedades útiles para la nanotecnología.
Como ya comentamos en el Capítulo 2, las estrategias de síntesis que se utilizan en nanotecnología están basadas en procedimientos de ensamblado de tipo ascendente, lo que significa que utilizando unidades de construcción básicas (átomos o moléculas) se pueden crear estructuras superiores de tamaño nanométrico. Pero, ¿cómo lograr la unión de estas unidades elementales para obtener estructuras con diferente grado de complejidad?
En el laboratorio, la construcción de dispositivos moleculares implica términos como «reconocimiento molecular», «autoensamblado» o «química supramolecular». Este último concepto, en palabras del científico francés J. M. Lehn podría definirse como la química «más allá de la molécula». Así, si la química molecular se encarga del estudio de las moléculas, es decir, de las estructuras que se obtienen al combinarse los átomos entre sí, la química supramolecular va un poco más lejos, encargándose de estudiar cómo las moléculas interaccionan entre ellas dando lugar a estructuras superiores. Para explicar esto, J. M. Lehn recurre al siguiente símil: si las moléculas fuesen personas, la química molecular trataría de personas y la química supramolecular de la sociedad.
6.2. La química supramolecular
Este relativamente nuevo campo de conocimiento se encarga de estudiar la química que permite la unión de moléculas entre sí, originando entidades moleculares denominadas supramoléculas. En la construcción de una supramolécula a partir de sus constituyentes moleculares se ven involucrados diferentes tipos de fuerzas y todas tienen en común el hecho de presentar una menor fortaleza que la que le corresponde a un enlace covalente. Un ejemplo sencillo nos permite clarificar en qué consiste un enlace covalente y en qué se diferencia de otros tipos de enlace que se producen típicamente entre moléculas, como el enlace de hidrógeno. Para ello, vamos a fijarnos en uno de los compuestos químicos más familiares para nosotros: el agua. En una molécula de agua (H2O), los enlaces que mantienen unidos a los dos átomos de hidrógeno con el átomo de oxígeno son de tipo covalente y consisten en la compartición de electrones. Estos enlaces son fuertes, y por tanto no es fácil, una vez formada la molécula, conseguir romperla y separar sus átomos constituyentes. A su vez, las diferentes moléculas de agua se mantienen unidas entre sí mediante un tipo de fuerzas intermoleculares, denominadas enlaces de hidrógeno, que consisten en atracciones electrostáticas entre el hidrógeno de una molécula y el oxígeno de la molécula contigua. Aunque estas fuerzas son lo suficientemente fuertes como para conseguir que las moléculas estén unidas, permitiendo que el agua sea líquida a temperatura ambiente, son mucho más débiles que las que mantienen a los átomos de H y O unidos entre sí para formar la molécula.
Puesto que las interacciones que controlan la química supramolecular son interacciones no covalentes, las entidades supramoleculares no son, en general, tan estables como los sistemas covalentes. A pesar de que en un principio esto pudiese parecer una desventaja, en realidad es una propiedad básica de la química supramolecular a la que se le puede sacar mucho provecho pues las interacciones que resultan son típicamente dinámicas y reversibles, siendo esto de gran utilidad para numerosas aplicaciones nanotecnológicas.
Los procesos de autoorganización y autoensamblado de «unidades básicas» o «bloques de construcción» conducen a la formación de agregados supramoleculares superiores. El procedimiento que puede seguirse consiste en comenzar sintetizando las «unidades básicas» que formarán la supramolécula haciendo uso de los métodos tradicionales de síntesis química, para después ponerlas en contacto en las condiciones adecuadas de forma que se vayan uniendo entre sí de una manera concreta, gracias a un proceso de reconocimiento molecular. Como ya hemos mencionado, las interacciones no covalentes que se establecen entre las unidades básicas que forman una supramolécula pueden ser de diversos tipos (por ejemplo, enlaces de hidrógeno, fuerzas de Van der Waals, interacciones electrostáticas, fuerzas hidrófobas o enlaces de coordinación).
Un ejemplo de autoensamblado perteneciente al mundo de la biología que todos conocemos es el que se produce cuando una cadena sencilla de ácido desoxirribonucleico (ADN) reconoce a su hebra complementaria. Ambas cadenas quedan unidas entre sí mediante interacciones no covalentes (concretamente mediante enlaces de hidrógeno) entre sus bases nitrogenadas: adenina (A) con timina (T) y guanina (G) con citosina (C). Como se verá más detalladamente en el Capítulo 7, cada una de las cadenas de ácido nucleico, se ha formado a partir de la unión de unidades básicas, denominadas nucleótidos. En la naturaleza, este tipo de mecanismos lleva millones de años funcionando y ha permitido que, a partir de una serie de unidades básicas constituyentes (aminoácidos, ácidos grasos, monosacáridos, nucleótidos), se originen estructuras mucho más complejas (proteínas, lípidos, polisacáridos, ácidos nucleicos), lo que ha dado lugar al desarrollo de los seres vivos.
La síntesis en el laboratorio de compuestos que participan en la formación de supramoléculas ha suscitado un enorme interés, y se han obtenido estructuras muy diversas que han sido bautizadas con nombres tan extravagantes como «criptandos», «esferandos», «cavitandos», «cucurbituriles» o «ciclodextrinas». El componente de creatividad no se encuentra asociado únicamente a los nombres con que se designan estos compuestos, sino que es una característica primordial de su síntesis. Si se conocen las propiedades de las moléculas que van a formar una entidad supramolecular y, por tanto, qué tipo de interacciones pueden establecerse entre ellas, se abre la posibilidad de realizar un diseño controlado que conduzca a la formación de supramoléculas útiles para fines tecnológicos. Por ejemplo, para el desarrollo de compuestos farmacéuticos más eficaces. Dado que el funcionamiento de éstos se basa en su interacción con una diana biológica, la síntesis de nuevas nanoestructuras que fuesen adecuadas para llevar a cabo ese reconocimiento molecular de una manera más selectiva sería fundamental. Asimismo, la química supramolecular es la base de muchas otras aplicaciones como las relacionadas con la fabricación de sensores o con el diseño de materiales más respetuosos con el medioambiente.
Debido a todo ello, y como ya se ha comentado, el diseño de estructuras supramoleculares que puedan tener aplicaciones tecnológicas concretas es una línea de investigación seguida por diversos laboratorios en todo el mundo, lo que ha originado que su número no haga más que crecer. De entre todas ellas, a continuación se presentarán algunos ejemplos como las supramoléculas basadas en «éteres corona» (que son importantes desde un punto de vista histórico pues se encuentran entre las primeras desarrolladas), las basadas en «dendrímeros» (que presentan unas variadas e interesantes aplicaciones en diversos campos), las basadas en «metalociclos» (en los que se pone en evidencia la importancia de los enlaces de coordinación para generar este tipo de estructuras) o los «rotaxanos» (que nos permitirán introducir el concepto de motor molecular). A través de estos ejemplos quedará patente la capacidad de la química para lograr diseñar estas supramoléculas «a la carta», es decir, de manera que tengan una estructura y unas propiedades determinadas según la función a la que vayan a destinarse.
Los éteres corona y los iones alcalinos: cabeza y corona de un rey. En los orígenes de la química supramolecular se encuentran los trabajos del científico estadounidense C. J. Pedersen, quien describió la síntesis, estructura y propiedades de una serie de compuestos que denominó éteres corona. Éstos son estructuras que presentan una cavidad en el centro y son capaces de reconocer iones alcalinos, pudiendo, por tanto, unirse a ellos. Dado que los diferentes iones alcalinos poseen diferente radio iónico, cada uno de ellos va a encajar preferentemente en un éter-corona: aquél cuyo hueco central sea más parecido al tamaño del ión. La supramolécula resultante de la interacción huésped-anfitrión (host-guest) entre un ión alcalino y un éter corona puede verse representada en la Figura 6.1. El ión se mantiene en la cavidad gracias a las interacciones electrostáticas que se producen entre su carga positiva y los dipolos negativos debidos a los átomos de oxígeno del anillo.
La denominación de estos compuestos como éteres corona se debió también a C. J. Pedersen, en un intento de simplificar la nomenclatura existente que, como él mismo reconocía, era difícil incluso de recordar. La nueva denominación tenía en cuenta el número de átomos de oxígeno en el anillo, así como el propio tamaño de éste. Así por ejemplo, uno de los éteres corona más conocidos (Figura 6.1) pasó de denominarse «1, 4, 7, 10, 13, 16-hexaoxaciclooctadecano» a ser conocido como «éter 18-corona-6». Esta denominación no sólo es más sencilla de recordar pues indica que el anillo tiene 18 átomos, seis de los cuales son oxígeno, sino también más gráfica, pues la estructura de estos compuestos recuerda a la corona de un rey vista desde arriba.

FIGURA 6.1. Supramolécula formada por el éter-corona denominado 18-corona-6 y un ion alcalino (potasio, K+).
El trabajo de C. J. Perdersen representó un gran avance en el momento en que fue publicado pues abrió nuevas posibilidades. Había logrado sintetizar una serie de compuestos capaces de reconocer de manera selectiva iones que presentaban igual carga pero que se diferenciaban en el tamaño. Es decir, había logrado llevar a cabo una tarea de la que tradicionalmente se encargaba la biología y no la química: el reconocimiento molecular. Tras la obtención de los éteres-corona, se sintetizaron multitud de compuestos supramoleculares con diferentes tamaños y formas, pero con la misma filosofía: ser capaces de reconocer iones o moléculas y hacerlo cada vez de manera más selectiva (por ejemplo, sintetizando compuestos en los que la cavidad central no fuese 2D, sino 3D). Aunque los primeros trabajos que se realizaron en Química supramolecular generaron escepticismo, debido a que parecía que usurpaban las labores típicas de la biología, no pasó mucho tiempo antes de que esta disciplina empezase a ser aceptada. De hecho, C. J. Pedersen junto con J. M. Lehn (del que ya hemos hablado anteriormente) y D. J. Cram recibieron el Premio Nobel de Química en 1987 por sus trabajos en este campo, en concreto por «el desarrollo y utilización de moléculas con interacciones de alta selectividad basadas en su estructura».
Los dendrímeros: esas estructuras arborescentes capaces de transportar moléculas. Otro ejemplo de estructura huésped-anfitrión es la que puede producirse entre los dendrímeros (que como veremos a continuación son un tipo de macromoléculas estructuralmente controladas que presentan cavidades en su interior) y diferentes moléculas.
El término dendrímero, que proviene del griego «dendros» que significa árbol, designa a ciertos compuestos macromoleculares que presentan una estructura ramificada. Como ejemplo, en la Figura 6.2.A se muestra la estructura de un dendrímero denominado PAMAM (poliamidoamina), donde pueden diferenciarse claramente tres partes: un núcleo situado en el centro de la estructura, una zona intermedia formada por unidades que se repiten (monómeros) y la zona exterior que presenta una serie de grupos químicos o funcionales. Es patente la similitud del conjunto con la copa del árbol que puede verse en la Figura 6.2.B.

FIGURA 6.2. A) Estructura del dendrímero PAMAM (adaptado de la web de Dendritech http://www.dendritech.com), B) Sombra de un árbol que ilustra su estructura ramificada.
Como puede observarse, las unidades monoméricas que parten desde el núcleo poseen centros de ramificación o nodos en su extremo. Cada nodo permite la incorporación de nuevas unidades repetitivas, dando lugar a estructuras que cada vez van teniendo más «capas» o «generaciones». La repetición de este paso conduce, por tanto, al crecimiento de la estructura. El dendrímero resultante se caracteriza por el número de capas que aparecen desde el núcleo hasta su periferia y por el número y tipo de grupos funcionales que presentan en su superficie (en el caso concreto de la Figura 6.2.A son grupos amino: −NH2). Aunque durante los últimos treinta años se han sintetizado una gran variedad de dendrímeros, únicamente están comercializados unos pocos, entre otros motivos, por su precio elevado.
Si se controla de forma exhaustiva el proceso de síntesis es posible modular las propiedades que presentarán las macromoléculas resultantes. Así, variando el número de generaciones se logra controlar tanto el tamaño como el número de grupos funcionales en la superficie. En la Tabla 6.1, donde se recogen estos dos parámetros para diferentes generaciones del dendrímero PAMAM, puede observarse cómo, a medida que va aumentando la generación, aumenta el diámetro y se duplica el número de grupos funcionales en la periferia, siendo éstos 1024 para el dendrímero de generación 8.
Generación
N.º de grupos
Diámetro (nm)
0
4
1.5
1
8
2.2
2
16
2.9
3
32
3.6
4
64
4.5
5
128
5.4
6
256
6.7
7
512
8.1
8
1024
9.7
TABLA 6.1. Características (número de grupos en la superficie y diámetro) de diferentes generaciones del dendrímero PAMAM (adaptado de la web de Dendritech http://www.dendritech.com)
No hay que olvidar que a medida que aumenta el tamaño de la estructura también aumenta la probabilidad de que se produzcan defectos en el crecimiento, pues puede darse el caso de que algunos grupos no reaccionen. Por otro lado, la naturaleza de las moléculas que se elijan como núcleo, como monómero ramificado y como portadoras de los grupos funcionales externos también va a influir en las características finales del dendrímero resultante. Así, según sea la longitud y el grado de ramificación del monómero se obtendrán estructuras más o menos densas; y dependiendo de cuáles sean los grupos funcionales expuestos, por ejemplo un amino (−NH2), un carboxilo (−COOH) o un hidroxilo (−OH), se puede controlar y modificar a voluntad sus propiedades y su reactividad.
La síntesis de un determinado dendrímero puede, por tanto, realizarse a la carta, controlando nanómetro a nanómetro la arquitectura del compuesto que se desea generar, así como sus propiedades finales (en términos de tamaño, reactividad, solubilidad o flexibilidad). Como consecuencia, este tipo de estructuras da lugar a aplicaciones muy versátiles, y se ha logrado sintetizar dendrímeros electro y fotoactivos u otros que presentan una gran aplicación en procesos catalíticos o en biomedicina.
Las aplicaciones de los dendrímeros se basan en el gran potencial que presentan para interaccionar con otras moléculas, pues no sólo pueden hacerlo a través de los muchos sitios reactivos que se encuentran en su superficie, sino también utilizando las cavidades presentes en su interior. Así por ejemplo, la incorporación de fragmentos metálicos a dendrímeros ha encontrado una gran aplicación en catálisis pues en la estructura resultante, denominada metalodendrímero, las posiciones activas del catalizador son muy accesibles para las moléculas de reactivo. Además, debido a su tamaño, una vez finalizado el proceso es muy fácil separarlos por centrifugación de los productos de reacción. En este tipo de aplicaciones, cuando el anclaje del catalizador al soporte dendrítico es no covalente, la naturaleza reversible de la unión ofrece grandes ventajas, tales como poder cambiar de catalizador durante el proceso, lo que es de gran utilidad para reacciones en cascada.
Los dendrímeros también presentan una gran aplicación en el transporte y posterior liberación de fármacos, los cuales, de nuevo, pueden unirse a los grupos funcionales externos o ser encapsulados en el interior del dendrímero donde permanecerán anclados por la acción de diversas fuerzas no covalentes. Así se han sintetizado dendrímeros capaces de transportar antiinflamatorios como el ibuprofeno, analgésicos como el ácido acetilsalicílico, o medicamentos para el tratamiento del cáncer como el metotrexato o la adriamicina. En todos estos casos es fundamental controlar tanto el mecanismo como la velocidad de liberación de los fármacos en el cuerpo humano (es decir, su farmacocinética), con el fin de prolongar y distribuir mejor su efecto a lo largo del tiempo. El mecanismo de liberación debe ser lo más sencillo posible, pudiendo obedecer por ejemplo a un cambio de acidez, o a encontrarse la estructura dendrímero-molécula en presencia de algún compuesto que logre romper la interacción entre ambos. A su vez, numerosas investigaciones van encaminadas a intentar dirigir el dendrímero portador del fármaco hacia las células tumorales. Una forma de lograrlo consiste en sintetizar un dendrímero que deje expuesto hacia el exterior ácido fólico (la vitamina B9), que es una sustancia captada por las células en general, aunque en mayor medida por aquellas que son tumorales. Asimismo, pueden ser utilizados como agentes antivirales. En este caso es necesario sintetizar un dendrímero cuya superficie mimetice la superficie celular que va a unirse al virus, de manera que dendrímero y célula diana compitan por el virus, provocando una menor infección de las células.
Ejemplos de dendrímeros comerciales con utilidad como nanofármacos o agentes de diagnóstico de diversas enfermedades son los sintetizados por la empresa Starpharma o por los Centros de investigación de la Armada de EE.UU.
(US Army Research), que han desarrollado un gel (llamado VivaGel) basado en dendrímeros de polisina para prevenir la transmisión del virus de la inmunodeficiencia humana (VIH) o dendrímeros para la detección de ántrax (denominado Ticket Alert), respectivamente.
Todas estas posibles aplicaciones explican el indiscutible interés que en los últimos años han despertado los dendrímeros, los cuales además ofrecen la ventaja de ser, en general, fácilmente biodegradables. En el caso de aplicaciones biomédicas como las comentadas, es necesario tener en cuenta que el dendrímero sintetizado debe cumplir una serie de requisitos como poder atravesar barreras biológicas, ser estable durante el tiempo suficiente para ejercer el efecto clínico deseado y, por supuesto, no ser «citotóxico». En general, la citotoxicidad (es decir, la capacidad para desestabilizar la membrana celular induciendo la ruptura o lisis celular) depende del tipo de grupos funcionales que se encuentren en su superficie, de la naturaleza química del esqueleto dendrimérico y de la generación (siendo los de mayor generación más tóxicos). Todo ello, debe ser, por tanto, tenido en cuenta y controlado cuidadosamente.
Metalociclos: jugando a crear figuras geométricas. La utilización de los denominados enlaces de coordinación para crear agregados supramoleculares ha supuesto un gran avance, abriendo la posibilidad de diseño de nuevas estructuras. Este tipo de enlace también presenta una menor fortaleza que el covalente, cumpliendo con la propiedad que caracteriza a las fuerzas típicamente involucradas en Química supramolecular.
Un ejemplo de agregados supramoleculares donde las fuerzas involucradas son de este tipo son los denominados «metalociclos» que, como puede verse en la Figura 6.3, son estructuras cíclicas que contienen varios metales y presentan geometrías bien definidas. Se forman por unión entre iones metálicos y moléculas denominadas ligandos que presentan varias posiciones de coordinación (es decir, sitios por los que pueden dar lugar a un enlace). Puesto que las posiciones de coordinación se pueden encontrar situadas a distintos ángulos de enlace, es posible originar una gran variedad de nuevas moléculas con formas regulares y tamaños nanométricos (de 1 nm a 1 μm).
En la Figura 6.3 se muestra la formación de un agregado cuadrado por coordinación entre dos tipos de «subunidades» que presentan una disposición angular y lineal, respectivamente. En concreto puede verse cómo un compuesto que contiene paladio, con dos posiciones de enlace que forman entre sí un ángulo de 90°, y un segundo compuesto, con dos posiciones de enlace situadas entre sí a 180°, dan lugar a la formación de un cuadrado molecular.
Dependiendo de las unidades básicas de partida que se utilicen, es posible sintetizar un gran número de metalociclos diferentes. Así, por ejemplo, cuando se produce la interacción de un mayor número de subunidades, teniendo algunas de ellas al menos tres centros reactivos no planares, es posible desarrollar poliedros tridimensionales, por ejemplo, un nanocubo.
Siguiendo la idea expuesta, otra interesante posibilidad es sintetizar polímeros de coordinación, es decir, entidades que ya no sean discretas como en los casos anteriores sino de longitud tan larga como se desee. El ejemplo más sencillo sería la creación de cadenas poliméricas monodimensionales por unión de unidades lineales.

FIGURA 6.3. Formación de un metalociclo cuadrado. En el esquema superior, las posiciones de enlace presentes en las subunidades lineal y angular están representadas por bolas negras y grises, respectivamente.
Algunas de las aplicaciones de los metalociclos descritos están relacionadas con la existencia en su estructura de cavidades definidas en forma y tamaño, las cuales, como ocurría en el caso de los dendrímeros, permiten albergar diferentes moléculas en su interior. Además muchas de estas estructuras pueden actuar como catalizadores de diversos procesos.
Rotaxanos: los movimientos de vaivén controlados a voluntad. Por último, en la Figura 6.4 se muestra otro ejemplo de entidad supramolecular, que ya había sido mencionada en el Capítulo 5 pues, debido a sus particulares características, es una posible candidata para la fabricación de interruptores moleculares. Esta entidad, denominada rotaxano, se encuentra constituida por una molécula lineal que es «abrazada» por un compuesto cíclico. Para que el compuesto cíclico no se salga de la molécula lineal, esta última debe poseer grupos voluminosos en sus extremos.
Existen muchos rotaxanos distintos dependiendo de cuál sea la molécula lineal y cuál la cíclica. En la figura se puede ver un ejemplo concreto en el cual ambas moléculas permanecen unidas por interacciones electrostáticas: la molécula cíclica tiene carga positiva y se sitúa sobre la zona de la molécula lineal más rica en electrones. Sin embargo, si por aplicación de un estímulo externo adecuado se lograse que esa zona de la molécula lineal se cargase positivamente, la estructura cíclica se desplazaría sobre la molécula lineal hasta situarse en una zona distinta. De esta manera, dependiendo de si se aplica o no el estímulo, la molécula cíclica puede encontrarse sobre una u otra zona de la molécula lineal, originándose un movimiento de vaivén controlable a voluntad. De esta forma, cada posición puede corresponder a un valor (0, 1) de un bit, tal como se sugirió en el capítulo anterior.
A veces, por tanto, es posible transformar la estructura de una especie supramolecular por acción de un estímulo externo (por ejemplo, electricidad, luz, cambio de pH), y como consecuencia generar un movimiento traslacional o rotacional. Este tipo de dispositivos, denominados motores moleculares, pueden, al igual que sus equivalentes macroscópicos, dar lugar a diferentes tipos de movimientos mecánicos y, por tanto, es posible utilizarlos para una amplia gama de novedosas e interesantes aplicaciones nanotecnológicas.

FIGURA 6.4. Ejemplo de la estructura de un rotaxano y de su respuesta ante un estímulo externo.
Como se adelantaba en el Capítulo 2, esta idea ya fue vislumbrada en 1986 por E. Drexler, quien en su libro Engines of Creation contempló la posibilidad de que en un futuro no muy lejano fuese posible construir motores moleculares basados en un engranaje de moléculas, donde unas hacen moverse a otras generando un movimiento mecánico. En el caso de E. Drexler, sin embargo, la propuesta para llegar a obtener estos engranajes de moléculas era absolutamente diferente a la mostrada en el presente capítulo, pues estaba basada en la utilización de los denominados «ensambladores». Estos ensambladores actuarían como dispositivos de montaje capaces de tomar y colocar las unidades básicas de construcción en unas posiciones concretas, de forma muy similar a los brazos robotizados que se usan para fabricar automóviles, pero a una escala muy inferior. Estos dispositivos serían, en principio, capaces de generar cualquier estructura que fuese compatible con las leyes de la física y la química e incluso de autorreplicarse a sí mismos. Como ya hemos comentado anteriormente, aunque ambas aproximaciones dieron lugar a un amplio debate entre importantes científicos que defendían o rebatían estas ideas, actualmente la mayoría de los puntos de vista se identifican con el enfoque proveniente del mundo de la química.
En la Figura 6.5 se muestra un ejemplo de las sorprendentes estructuras que pueden generarse jugando con moléculas en un laboratorio, en concreto un coche de tamaño molecular sintetizado por J. Tour y otros investigadores de la Universidad de Rice (EE.UU.). En esta máquina molecular, a la molécula que constituye el chasis se encuentran unidos cuatro fullerenos que hacen las veces de ruedas, dando lugar a una estructura similar a un coche, pero con unas dimensiones de 3.3 nm × 2.1 nm. Al visualizar con microscopía de efecto túnel (STM) la molécula depositada sobre una superficie de oro, destacan claramente los cuatro fullerenos (que están recuadrados en la Figura 6.5 B,C,D,E), pudiéndose advertir en las imágenes secuenciales cómo un aumento de temperatura provoca un desplazamiento de los mismos sobre la superficie. Se puede observar en la figura cómo las moléculas de fullereno pueden rotar como si fuesen ruedas reales. Para lograr un desplazamiento efectivo las cuatro ruedas deben girar de la misma manera. En caso contrario, el nanocoche no se desplazaría o, como mucho, daría vueltas, enloquecido, sobre sí mismo.
Una vez más, estos motores moleculares encuentran análogos en la naturaleza. Así, por ejemplo, muchas proteínas del interior celular funcionan como auténticos motores utilizando la energía derivada del metabolismo para realizar diversas funciones como desplazarse, transportar otras moléculas o ejercer fuerzas sobre el entorno. En la Figura 6.6. se encuentra representada una proteína, la kinesina, capaz de transportar moléculas, orgánulos celulares o vesículas de un lugar a otro del medio intracelular al desplazarse sobre fibras del citoesqueleto (en concreto, los microtúbulos que constituyen el armazón estructural de las células eucariotas). Este desplazamiento es posible gracias a que se producen cambios en su estructura (provocados por la hidrólisis del trisfosfato de adenosina, ATP, que sería algo así como la gasolina que hace funcionar el motor) de manera que se generan dos estados distintos con alta o baja afinidad por el microtúbulo, que se traducen en pasos discretos. De esta forma, mientras nosotros leemos este párrafo, en nuestro organismo la kinesina se encuentra «caminando» sobre las fibras del citoesqueleto de nuestras células dando pasos de unos 10 nm y transportando una «carga» que es muy superior a su propio peso.

FIGURA 6.5. «Nanocoche» de dimensiones 3.3 nm × 2.1 nm. Serie de imágenes consecutivas de STM en las que se aprecia cómo el nanocoche se desplaza sobre una superficie al elevar la temperatura. Adaptada con permiso de Nano Letters, n.º 5, pp. 2330-2334. Copyright 2005, Sociedad Americana de Química.
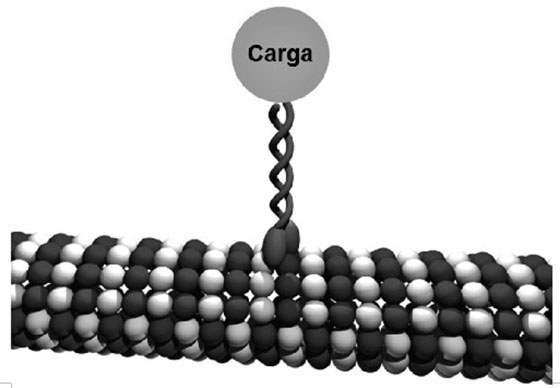
FIGURA 6.6. La proteína kinesina desplazándose a lo largo de una fibra del citoesqueleto con su carga a cuestas. La kinesina avanza «paso a paso» moviendo alternativamente los dos filamentos que actúan como si fuesen dos piernas. Adaptado de Wikipedia.
Otras proteínas también pueden considerarse, en cierto sentido, como bionanomotores moleculares. Éste es el caso de las ADN polimerasas, que desempeñan un papel fundamental en todas las células, siendo capaces de replicar moléculas de ADN a una enorme velocidad (por ejemplo, 50 000 nucleótidos por minuto en el caso de la bacteria Escherichia coli). Estas polimerasas avanzan por una de las hebras del ADN, reconocen cada nucleótido e incorporan el nucleótido complementario en la cadena naciente, de manera que se preserve la información con la mayor fidelidad posible. De hecho, para que las ADN polimerasas puedan realizar su trabajo es preciso que por delante de ellas se muevan otros nanomotores, las enzimas denominadas helicasas del ADN, que van rompiendo los puentes de hidrógeno entre bases nitrogenadas complementarias, como si fuesen unas nanotijeras, lo que permite la separación de las dos cadenas del ADN.
6.3. La formación de monocapas autoensambladas
Como ya hemos mencionado, los procesos de «autoensamblado» o «autorganización» conducen a la formación espontánea de estructuras organizadas gracias a las interacciones locales que se producen entre diversos componentes que se encontraban presentes en un medio inicial desordenado.
Cuando el proceso de autoensamblado entre moléculas se produce sobre una superficie, se originan capas cuyo espesor corresponde a una sola molécula dispuesta sobre dicho soporte por lo que se denominan monocapas autoensambladas (en inglés, «self assembled monolayers» o SAMs). Para visualizar este proceso podemos imaginarnos las piezas de un puzle diseminadas encima de una mesa y cómo éstas van reconociéndose y encajándose unas con otras hasta lograr formar un paisaje, la escena de un cuadro o nuestro personaje preferido de dibujos animados. Para que este ejemplo se aproxime lo más posible al proceso de autoensamblado y autorganización de entidades moleculares, debemos continuar echándole imaginación pues las piezas de partida deben ser capaces de reconocerse entre sí y de colocarse de la manera adecuada por sí solas, es decir, espontáneamente. Además, al igual que ocurre en el caso de las piezas del puzle, las interacciones locales que se producen en los procesos de autoensamblado o autorganización cumplen, en general, con la propiedad de ser moderadamente débiles y reversibles.
Hoy en día este procedimiento de formación de monocapas autoensambladas se ha convertido en uno de los más empleados para modificar superficies, existiendo la posibilidad de fabricar una gran diversidad de ellas mediante la utilización de diferentes moléculas sobre distintos sustratos inorgánicos. Desde las primeras monocapas autoensambladas, que fueron desarrolladas en los años cuarenta sobre superficies de platino, el campo ha experimentado un gran auge sobre todo desde que se prepararon las primeras SAMs de alcanotioles sobre oro. Como puede verse en la Figura 6.7.A, un alcanotiol es una cadena hidrocarbonada terminada en un grupo (−SH), en la que pueden distinguirse tres partes: la cabeza o grupo de anclaje, el esqueleto o grupo espaciador y el grupo terminal o funcional. Como su propio nombre indica, el grupo de anclaje proporciona la afinidad química con el soporte y es, por tanto, el responsable de que se produzca la unión entre ambos. Gracias al esqueleto orgánico se logra la estabilización de la estructura mediante débiles interacciones (no covalentes) con los esqueletos de las moléculas vecinas. Por último el grupo terminal, que queda dirigido hacia el exterior, contiene una función química que puede ser, por ejemplo, un grupo metilo (−CH3), un amino (−NH2), un carboxilo (−COOH) y es el que va a definir tanto la reactividad como las propiedades físico-químicas de la superficie modificada, y por consiguiente sus posibles aplicaciones.

FIGURA 6.7. A) Estructura del 1-octanotiol (CH3−(CH2)7−SH), donde las esferas grises son átomos de C, las negras átomos de H y la denominada grupo de anclaje un grupo −SH, B) Visualización por AFM de una monocapa autoensamblada del 1-octanotiol sobre una superficie de oro. La imagen mide 13 × 13 nm2. Gentileza del Dr. Luis Vázquez (ICMM-CSIC).
Las SAMs se pueden preparar evaporando las moléculas precursoras en vacío o a partir de una disolución de dichas moléculas, siendo este segundo método el más utilizado. El procedimiento consiste en sumergir durante un tiempo determinado el sustrato sobre el que se va a depositar la película, por ejemplo una placa de oro, en una disolución del alcanotiol elegido, por ejemplo, el 1-octanotiol. Durante el tiempo que la placa permanece en contacto con el alcanotiol ocurren varios procesos, aunque todos ellos de manera espontánea y sin necesidad de ninguna actuación externa. En primer lugar se produce una unión bastante fuerte entre el azufre (S) de la molécula y el oro (Au), lo que va a tener como consecuencia que las SAMs resultantes sean muy estables. Las moléculas, al principio, se colocan paralelas a la superficie (es como si estuviesen tumbadas). Pero a medida que va pasando el tiempo (y se van uniendo cada vez más moléculas a la superficie del Au), éstas van cambiando de posición, levantándose hasta colocarse con un ángulo de inclinación de unos 30° respecto de la vertical. Este ángulo de inclinación permite que se maximicen las interacciones entre las cadenas hidrocarbonadas. El tiempo necesario para que el proceso se complete depende de la concentración de la disolución de alcanotiol (es decir, del número de moléculas disueltas) en la que se introduce la placa de oro que se quiere modificar. Este tiempo suele ser de varias horas pues para que la densidad de moléculas que forman la SAM sea alta y el número de defectos bajo se necesita que las moléculas se reorganicen adecuadamente.
Las monocapas autoensambladas generadas pueden visualizarse utilizando un microscopio de fuerzas atómicas (AFM), como los que se han descrito en el Capítulo 3. En la Figura 6.7.B se muestra como ejemplo una imagen obtenida por AFM de una monocapa de 1-octanotiol, CH3−(CH2)7−SH formada sobre una superficie de oro. La punta del AFM, al acercarse a la superficie, «nota» la parte externa de las cadenas de alcanotioles, de manera que las protuberancias que se ven en la imagen se corresponden con los grupos terminales metilo (–CH3). La imagen que ofrece el AFM de la monocapa es similar a la que obtendríamos al observar un campo de espigas sobrevolándolo a una altura baja.
Una importante consecuencia de la formación de una monocapa autoensamblada sobre una superficie es que las propiedades finales van a poder ser diferentes y además controlables en función de cuál sea el grupo terminal del alcanotiol que la forme. En el caso de la SAM que puede verse en la Figura 6.7.B, la superficie resultante es mucho más hidrofóbica que antes de formar la monocapa, lo que puede comprobarse colocando una gota de agua sobre ella. Al hacer esto, se observa cómo la gota se confina en el espacio más pequeño posible intentando minimizar su contacto con la superficie. La hidrofobicidad («repulsión hacia el agua») generada se debe a que el grupo terminal del alcanotiol es un grupo metilo (−CH3) que se caracteriza por tener esta propiedad. Algunas de las posibles aplicaciones de las SAMs están relacionadas con el cambio de propiedades que inducen, pudiéndose utilizar, por ejemplo, para aumentar la resistencia a la corrosión o para reducir la fricción y la adherencia de una superficie.
Una vez formada la monocapa es posible usarla para llevar a cabo procesos de síntesis sobre la superficie pues al ir poniéndola en contacto con diferentes compuestos, éstos van a ir incorporándose en fases sucesivas. Esto se logra gracias a la interacción que se produce entre el grupo terminal que se encuentra presente en la monocapa y el grupo funcional del compuesto que se pretende incorporar. Para ello es preciso elegir un alcanotiol para formar la monocapa que presente un grupo funcional en su estructura adecuado a la reacción posterior que queramos que se produzca. Mediante este grupo es posible unir distintas moléculas a través de un enlace covalente o bien adsorberlas por interacciones más débiles de tipo, por ejemplo, electrostáticas o puentes de hidrógeno. Así, monocapas autoensambladas que exponen hacia el exterior grupos carboxilo (−COOH), hidroxilo (−OH) o amino (−NH2) son ampliamente utilizadas como punto de partida en estos procesos de síntesis superficial, en los que un control preciso de la reactividad permite construir diversas nanoestructuras con infinidad de aplicaciones potenciales. En particular, y como veremos en el siguiente apartado, pueden utilizarse en el desarrollo de biosensores para lograr la conexión entre dos de sus componentes principales, el «transductor» y el elemento de reconocimiento biológico.
6.4. Los biosensores y sus aplicaciones
La importancia de determinar la concentración de una sustancia dada en una muestra es indudable y, aunque no nos demos cuenta, cada uno de nosotros realiza este tipo de análisis en su vida cotidiana. ¿Quién no ha olido el contenido de un paquete de leche que lleva varios días en la nevera antes de decidir si lo utiliza o no para hacerse el desayuno? Pues bien, de una manera tan sencilla realmente estamos evaluando si en la leche han proliferado ciertas bacterias y si, por tanto, nos tomamos un café solo o con leche. Los ejemplos que ilustran la necesidad de realizar mediciones cuantitativas son innumerables. En multitud de ocasiones es preciso, por ejemplo, disponer de métodos que nos permitan determinar la concentración de sustancias contaminantes en el aire que respiramos o el contenido de diversos compuestos (glucosa, colesterol) en nuestra sangre; así como establecer rigurosos procesos de control de calidad que permitan asegurarnos de que todos los productos que utilizamos habitualmente, ya sean medicinas, productos de limpieza, alimentos, bebidas o ropa, son seguros para nosotros. Todo ello ha llevado a que, a lo largo del tiempo, se hayan desarrollado numerosos métodos de análisis que van desde los más sencillos que pueden realizarse en cualquier laboratorio (por ejemplo, una valoración) hasta los que requieren de técnicas mucho más complejas (¿quién no sabe cómo se solucionan la mayor parte de los problemas de identificación de compuestos en la serie de televisión CSI?: ¡al espectrómetro!).
En la sociedad actual cada vez se hace más necesario el uso de dispositivos de análisis que sean fiables, selectivos, sensibles, de fácil manejo, baratos y que requieran poca cantidad y el mínimo pretratamiento de muestra posible. En este sentido, en los años sesenta se empezaron a desarrollar una serie de dispositivos, que posteriormente se denominaron biosensores.
Los biosensores son dispositivos que permiten determinar la presencia o concentración de sustancias de interés (denominados analitos o moléculas diana) en una determinada muestra y en su construcción desempeñan un importante papel los procesos de síntesis superficial descritos en el apartado anterior. Estos dispositivos compactos de análisis incorporan dos partes fundamentales: un elemento de reconocimiento biológico (sonda) encargado de interaccionar selectivamente con la diana que se quiere determinar y un elemento denominado «transductor». El sistema de «transducción» se encarga de convertir las variaciones de las propiedades físico-químicas producidas como consecuencia de la interacción entre el analito y la sonda en una señal medible (Figura 6.8). A partir de la señal generada es posible obtener la concentración del analito en la muestra. La combinación de estas dos partes del biosensor, una biológica y otra inerte, es lo que confiere al dispositivo sus dos características principales: 1) especificidad o selectividad, ya que el elemento biológico es capaz de reconocer un analito aunque se encuentre en presencia de muchas otras sustancias; y 2) sensibilidad, pues es posible determinar concentraciones muy pequeñas del analito en la muestra.
Como elementos de reconocimiento biológico pueden utilizarse proteínas (como anticuerpos o enzimas), fragmentos de ácidos nucleicos naturales o moléculas análogas artificiales, agregados moleculares formados por los elementos anteriores, virus, células completas o incluso fragmentos de tejidos. A su vez la «transducción» de la señal se puede realizar utilizando un amplio repertorio de sistemas ópticos, eléctricos, electroquímicos, mecánicos o de otro tipo, que pueden requerir, o no, el marcaje previo (por ejemplo, mediante compuestos fluorescentes) del analito.