Витамин Д3 И Лишний Вес

👉🏻👉🏻👉🏻 ВСЯ ИНФОРМАЦИЯ ДОСТУПНА ЗДЕСЬ ЖМИТЕ 👈🏻👈🏻👈🏻
Свидетельство о государственной регистрации: RU.77.99.88.003.Е.001288.03.17 от 17.03.2017
Адрес: 119034 Москва, Сеченовский переулок 6, строение 3
БАД. НЕ ЯВЛЯЕТСЯ ЛЕКАРСТВЕННЫМ СРЕДСТВОМ ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ — ОБЯЗАТЕЛЬНО ПРОКОНСУЛЬТИРУЙТЕСЬ СО СПЕЦИАЛИСТОМ
ООО «Орион Фарма» © 2019 | All Rights Reserved
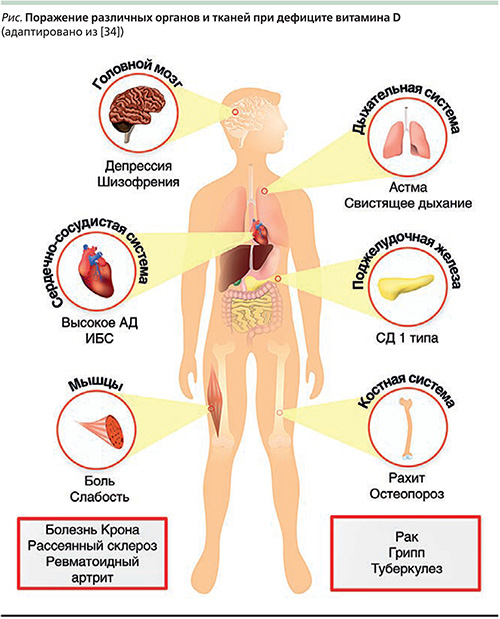
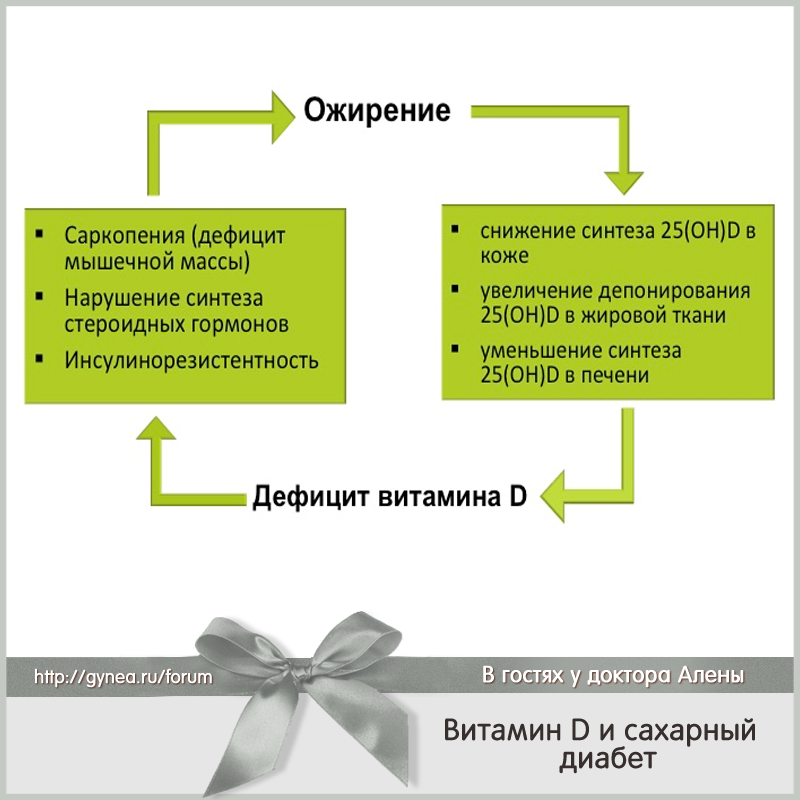
В последние годы внимание исследователей привлекает факт частого сочетания дефицита витамина Д и метаболических нарушений.
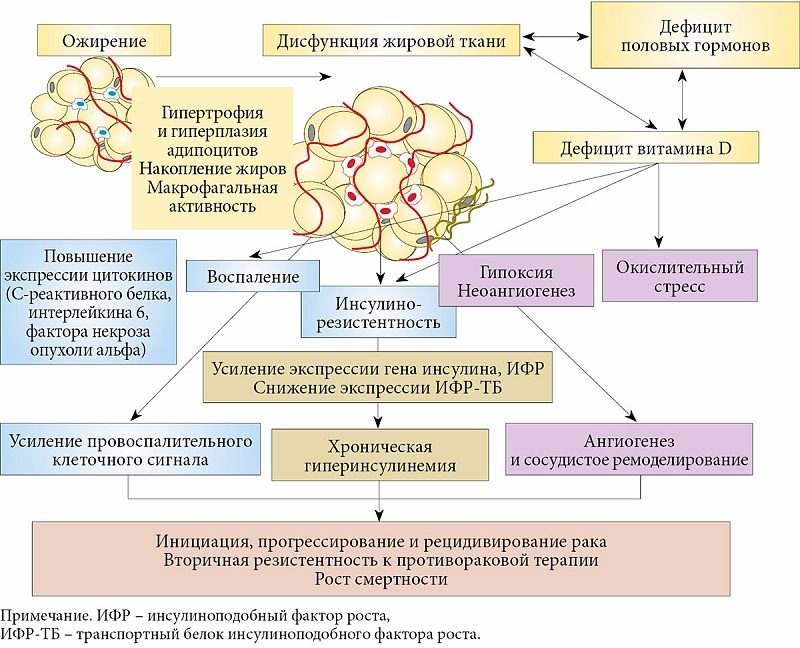
У людей с ожирением нередко диагностируются низкие уровни витамина в сыворотке крови. Недостаточность витамина D увеличивает риск повышенной массы тела и абдоминального ожирения в 2 раза. Выделяют ряд механизмов, способствующих разлаженности обмена веществ:
В научной литературе описано несколько механизмов снижения концентрации витамина D у людей с повышенной массой тела:
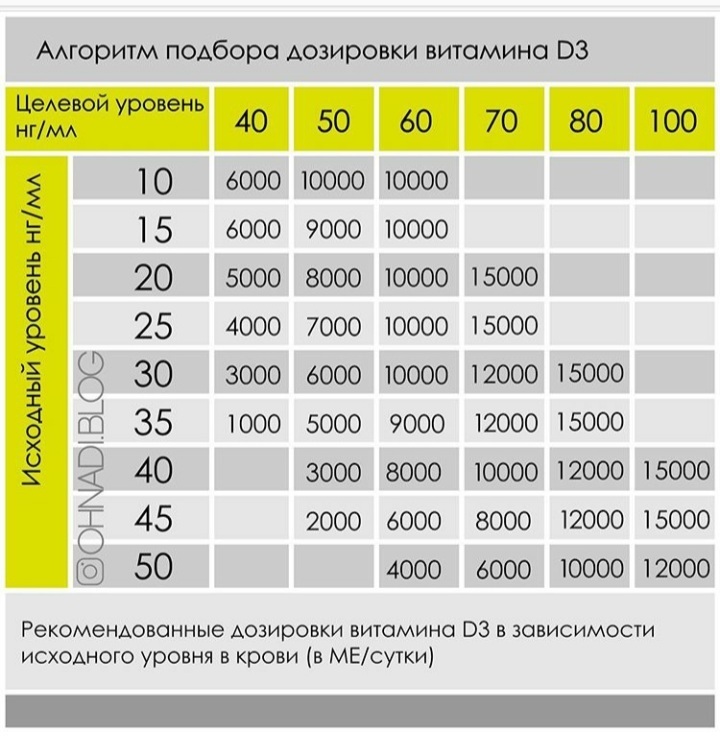
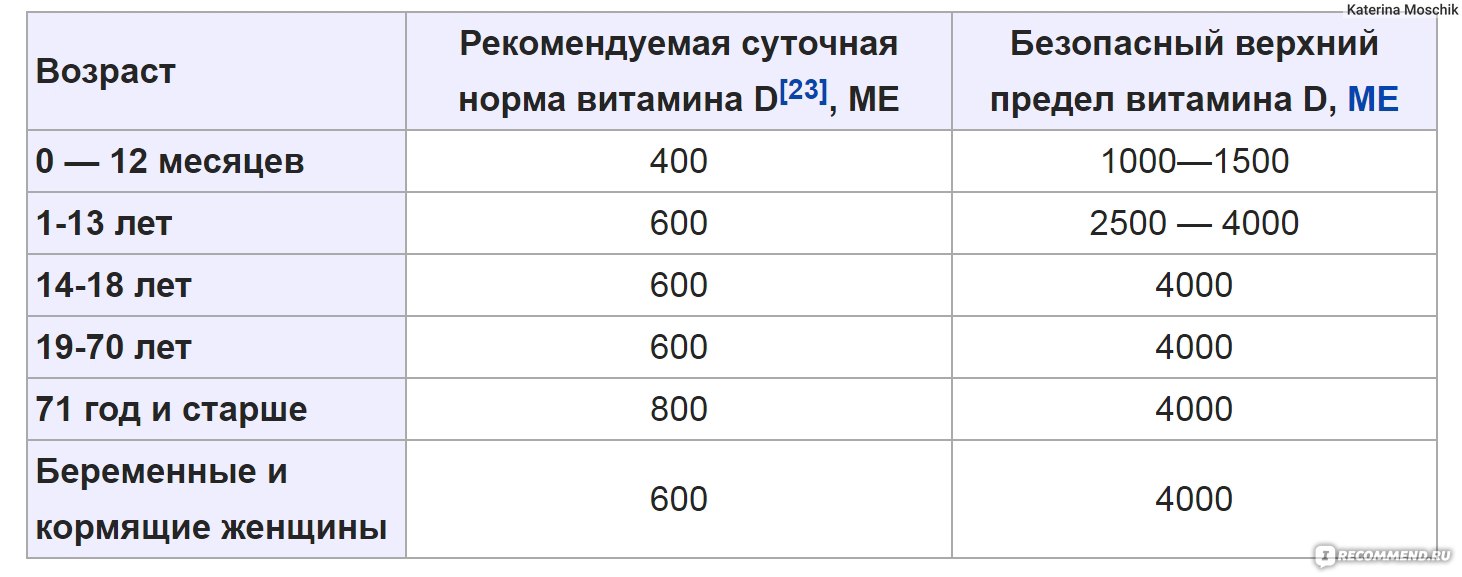
Влияние витамина D на обмен веществ многогранно. Люди, стремящиеся вести здоровый образ жизни, должны помнить об этом, особенно в периоды соблюдения низкокалорийных диет и тренировок. Желательно определять уровень витамина D в сыворотке крови и в случае выявления его дефицита проводить коррекцию концентрации витамина D с использованием доз, превышающих обычные профилактические.
Миссия «Ориона» – созидать благополучие. С этой целью «Орион» разрабатывает эффективные лекарственные средства и диагностические тесты, позволяющие улучшить качество жизни пациентов во многих странах мира.
Роль дефицита витамина D в развитии ожирения и диабета 2 типа
Наша задача — Ваше хорошее самочувствие и укрепление здоровья.
Громова О.А. — доктор медицинских наук, профессор кафедры фармакологии и клинической фармакологии Ивановской государственной медицинской академии; консультант Российского центра Института микроэлементов ЮНЕСКО при Российском национальном исследовательском медицинском университете им. Н.И.Пирогова
Дефицит витамина D и патофизиология диабета.
Фундаментальные исследования и молекулярные механизмы воздействия витамина D на физиологию человека.
Эпидемиологические исследования связи дефицита витамина D и диабета.
Результаты мета-анализов эпидемиологических исследований.
О соответствии между результатами доказательной и фундаментальной медицины.
Витамин D, диабет и коморбидные патологии.
Клинические исследования препаратов витамина D для профилактики и лечения диабета.
О дозировке витамина D для профилактики и терапии ожирения, глюкозотолерантности, диабета.
Ожирение и сахарный диабет связывают с избытком углеводов и жиров в диете, гиподинамией, и развитием, вследствие этих факторов риска, инсулинрезистентности. В последнее время, накоплен значительный материал о взаимосвязи дефицита различных определённых микронутриентов с риском развития диабета – прежде всего, хрома, магния, цинка, витамина А и витамина D. Особое внимание следует уделить дефициту витамина D. Дефицит витамина D связан с ожирением [1], высоким ИМТ [2], инсулинрезистентностью [3], неблагоприятным влиянием на секрецию инсулина [4], а также с глюкозотолерантностью [5]. Экспериментальные и клинические исследования подтверждают, что адекватная обеспеченность витамином D может снизить заболеваемость СД1 и СД2 и улучшить метаболический контроль при наличии диабета [6], в т.ч. гестационного диабета и избыточной прибавки веса во время беременности [7-9].
Дефицит витамина D широко распространен даже в относительно обеспеченных европейских странах [10] вследствие «вестернизации» питания. Например, недавнее исследование когорты из 1006 подростков 12-17 лет показало низкую обеспеченность витамином в 9 странах ЕС. В соответствии с международными критериями статус витамина D оценивался как оптимальный (уровни 25-гидроксивитамина D более 75 нмоль/л), недостаточный (50-75 нмоль/л), дефицитный (27-50 нмоль/л) и как тяжёлый дефицит (менее 27 нмоль/л). Среднее значение уровней 25-гидроксивитамина D по когорте составило 57 нмоль/л, причём 80% обследованных характеризовались субоптимальными уровнями (39% – недостаточный, 27% – дефицит, 15% – тяжёлый дефицит) [11]. Следует отметить, что в этом и в других исследованиях в группах с
Следует подчеркнуть, что объём научных публикаций, указывающий на неопровержимую взаимосвязь между дефицитом витамина D и сахарным диабетом, возрастает. К 2015 году, опубликовано более 4800 научно-исследовательских статей (причем более 4000 – после 2005 года), указывающих на многочисленные аспекты взаимосвязи между потреблением витамина D (по опроснику диеты, дневнику питания), уровнями витамина в плазме, активностью молекулярных каскадов и риском глюкозотолератности и диабета. В настоящей работе приведены результаты систематического анализа имеющихся экспериментальных, эпидемиологических и клинических данных о взаимосвязи дефицита витамина D и риска развития ожирения и диабета. Формулируются наиболее вероятные молекулярные механизмы, посредством которых биологически активные метаболиты витамина D вносят вклад в профилактику и терапию ожирения и диабета.
Д ефицит витамина D и патофизиология диабета
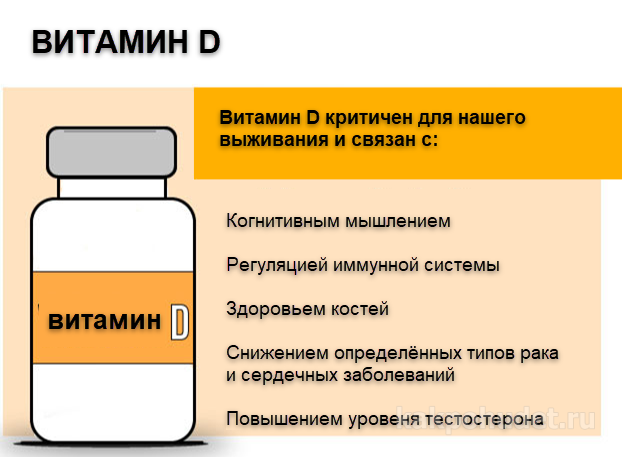
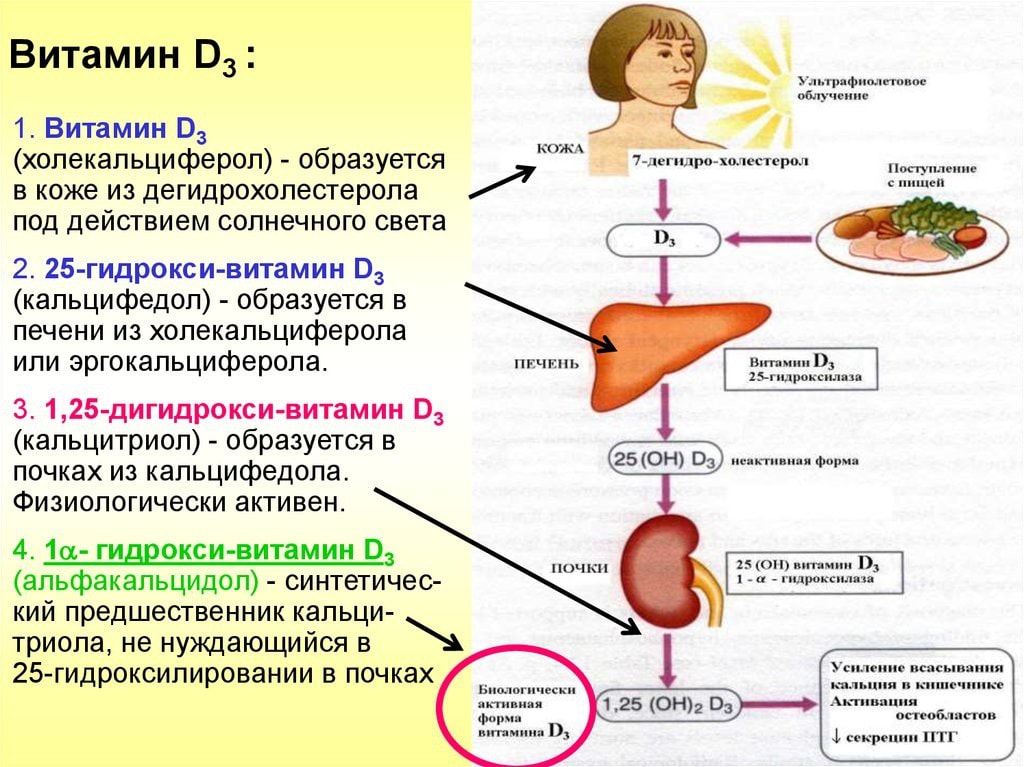
Витамин D – витамин-гормон, характеризующийся широким спектром физиологических эффектов. Витамин D и его активные метаболиты необходимы не только для обмена кальция, но и вовлечены в процессы роста и развития клеток. Витамин D способствует всасыванию кальция, который необходим для секреции инсулина [12], оказывает иммуномодуляторное воздействие на панкреатические бета-клетки [13]. Кроме того, СД1 и СД2 связаны с воспалением, при этом патофизиология сахарного диабета 1-го типа включает аутоиммунный компонент. Тем не менее, точные механизмы, посредством которых витамин D и кальций оказывают защитное метаболическое действие, не вполне ясны и требуют дальнейшего изучения [14].
Исследования указали не только на повышение риска развития СД2 при дефиците витамина D, но и на влияние дефицита витамина D на различные метаболические факторы риска развития диабета, такие как уровни глюкозы натощак, чувствительность к инсулину, уровни гликированного гемоглобина, показатели метаболического синдрома и т.д. как у здоровых, так и у пациентов страдающих диабетом. Например, в исследовании группы 126 пациентов с глюкозотолерантностью, регрессионный анализ показал достоверные корреляции между уровнями 25(OH)D в плазме крови и чувствительностью к инсулину (р = 0.0007) и концентрацией глюкозы натощак (р=0.027) [15].
В исследовании 292 женщин 50-79 лет, установлены корреляции между сниженными уровнями 25(OH)D сыворотки с повышением показателей избыточного веса: ИМТ (р = 0.0002); окружности талии (р<0.0001); отношением талии и бёдер (р <0.0001) ; повышением уровней триглицеридов (р<0.0001). Риск метаболического синдрома при высоком (52 нмоль/л) по сравнению с самым низким (<35 нмоль/л) уровнями 25(OH)D в сыворотке снижался в 3 раза (О.Р. 0.28; 95% ДИ: 0.14…0.56) [16].
Пониженные уровни 25(OH)D в сыворотке крови коррелируют с одновременным присутствием кардио-метаболических факторов риска. По данным упоминаемого ранее крупномасштабного исследования NHANES (2001-2006) когорты 5867 подростков (12-19 лет), риск метаболического синдрома был на 70% выше среди пациентов с концентрациями 25(OH)D в сыворотке, соответствующими самой нижней трети (О.Р. 1.71; 95% ДИ: 1,11, 2,65, р<0.01). Недостаточность 25-гидроксивитамина D также коррелировала с увеличенной окружностью талии (P<0.0001), повышенным систолическим артериальным давлением (Р=0.01) и снижением холестерина ЛПВП (р<0.0001) [17].
Уровни витамина D плазме крови влияют на уровни гликированного гемоглобина (HbA1c) – долговременного показателя глюкозотолерантности. В исследовании 668 пожилых (возраст 70-74 лет) уровни 25-гидроксивитамина D менее 50 нмоль/л в два раза повышали риск вновь диагностированного диабета 2-го типа. Статистическая значимость эффекта сохранялась после поправок на ИМТ, пол, воздействие полихлорированных бифенилов, триглицериды сыворотки, ЛПВП и курение. При более высоких концентрациях 25-гидроксивитамина D наблюдалось снижение уровня гликированного гемоглобина [18].
Взаимосвязь между уровнями 25-гидроксивитамина D в сыворотке и уровнями HbA1c была изучена в 9773 участников в рамках исследования NHANES 2003-2006 годов («National Health and Nutrition Examination Survey»). Мультипараметрическая линейная регрессия показала, что уровни 25(OH)D в сыворотке были обратно пропорциональны уровням гликированного гемоглобина HbA1c пациентов в в возрасте 35-74 лет (р=0.0045) [19].
Исследование группы из 280 пациентов с СД2 (59% мужчин, возраст 68 ± 10) показало, что дефицит витамина D способствует истощению эндотелиальных клеток-предшественников (-0.12%, P = 0.022), снижению поток-опосредованной вазодилатации по данным УЗИ (-1.43%, P = 0.001) и повышению уровня HbA1c (Р = 0.032) [20].
В группе 147 беременных с гестационным возрастом 35±2 недели, недостаточные уровни 25(OH)D (менее 50 нмоль/л) соответствовали повышенным уровням HbA1c (r=-0.32, р<0.001; Lau, 2011). В группе из 307 беременных уровни 25(OH)D были обратно пропорциональны уровням паратгормона (r=-0.24), уровням глюкозы в плазме крови натощак (r=-0.20), инсулина натощак (r=-0.20) и резистентности к инсулину [7].
Протеомный подход к анализу биомеркеров крови установил, что у детей с ожирением и дефицитом витамина D снижены уровни адипонектина . Группа детей с ожирением была разделена на две подгруппы – с выраженным дефицитом витамина (25OHD<15 нг/мл, n=18) или с нормой (25OHD>30 нг/мл, n=24). Анализ протеома плазмы крови указал на 53 белка, которые достоверно отличались между подгруппами; среди этих белков был адипонектин, низкие уровни которого связаны с ожирением и с диабетом. Курсовой прием витамина (3000 МЕ/сут, 12 мес.) увеличивал уровни адипонектина (р<0.02) [21].
Фундаментальные исследования и молекулярные механизмы воздействия витамина D на физиологию человека
Биологические эффекты витамина D осуществляются через взаимодействие со специфическим одноименным рецептором витамина (VDR). Активированная витамином молекула рецептора VDR взаимодействует с активаторами и репрессорами этого рецептора, оказывая комплексное воздействие на процессы транскрипции генома. Белки генов, транскрипция которых модулируется рецептором VDR, вовлечены в процессы всасывания кальция и фосфора в кишечнике, транспортировку кальция в депо костей, иммуномодуляцию и другие процессы [22].
Существует несколько сотен генов, экспрессию которых регулирует рецептор витамина D и которые кодируют белки, опосредующие сложные молекулярные эффекты витамина D (кальбиндин, субстрат рецептора инсулина, IGF-связывающие белки, регуляторный белок PPAR-δ, белок-хемоатрактант моноцитов и др.).
Например, Са-связывающий белок кальбиндин , посредник транспорта кальция, одновременно играет важную роль и в защите клеток различных тканей от патологического апоптоза (программируемой клеточной смерти). В частности, кальбиндин способствует защите бета-клеток поджелудочной железы, что подтверждается экспериментальными исследованиями на линях мышей с делециями гена кальбиндина [23].
Среди управляемых витамином D белков регуляции углеводного и жирового метаболизма следует отметить, прежде всего, субстрат рецептора инсулина ( IRS 1). Рецептор инсулина – трансмембранный рецептор с тирозинкиназной активностью. При связывании инсулина, рецептор претерпевает изменение конформации и начинает фосфорилировать определенные аминокислотные остатки тирозина в белках инсулинового сигнального каскада (прежде всего, белки IRS, insulin receptor substrate). Сигнальный путь рецептора инсулина довольно сложен и включает десятки белков, опосредующих передачу от активированного рецептора к биохимическим каскадам физиологического метаболизма углеводов и жиров.
Инсулиноподобный фактор роста (IGF) является одним из важнейших факторов, поддерживающих баланс между жировой и мышечной тканями. При дефиците IGF или снижении его активности жировая ткань начинает преобладать над мышечной. В результате, ускоряются процессы атеросклероза и кальцификации сосудов. Витамин D стимулирует синтез IGF-связывающих белков (IGFBP) . IGF-связывающие белки продлевают период полураспада IGF, тем самым усиливая антиатеросклеротические эффекты этого фактора роста (Рис. 1). Исследования показали, что витамин D усиливает транскрипцию генов IGFBP1, IGFBP3 и IGFBP5. Сывороточные уровни IGF-1 и IGFBP-3 были измерены в 96 пациентах с периферической болезнью артерий и у 89 добровольцев. У пациентов с периферической болезнью артерий были найдены более низкие уровни белка IGFBP-3 (P <0.01), так что уровни IGFBP-3 действительно отражают активность атеросклеротического процесса [24].
Рис 1. Пространственная структура комплекса инсулиноподобного фактора роста (IGF) с IGF–связывающим белком (IGFBP). Витамин D-зависимый белок IGFBP (слева), связываясь с IGF (справа) продлевает период полураспада IGF и усиливает антиатеросклеротический эффект IGF.
Не менее интересно отметить, что витамин D активирует синтез белка PPAR-δ (активированный рецептор пролифераторов пероксисом, тип δ), способствующего переработке избыточного холестерина [25]. Белок PPAR-δ (Рис. 2) активирует процессы бета-окисления жирных кислот, т.е. активация синтеза PPAR-δ витамином D3 приводит к снижению интенсивности атеросклеротических процессов.
Исследование 2000 пациентов с ИБС и здоровых контролей [26] показало, что полиморфизмы гена PPARD определяют уровни липидов в плазме и тяжесть атеросклероза сосудов сердца и, следовательно, влияют на формирование абдоминального ожирения. Таким образом, витамин D3 способствует активации нескольких важнейших факторов углеводного и липидного метаболизма.
Рис. 2. Пространственная структура белка PPAR-δ, способствующего экскреции избыточного холестерина.
Отметим особую роль воспаления в патогенезе ожирения и диабета. Витамин D – иммуномодулятор с широким спектром действия. Дефицит витамина D приводит к увеличению аутоиммунной агрессии вследствие нарушения регуляции Т-лимфоцитов [27]. Одним из механизмов этиопатогенетического воздействия витамина D на метаболический синдром и диабет является, несомненно, нормализация процессов воспаления.
В культуре клеток поджелудочной железы 1,25-дигидроксивитамин D тормозит экспрессию провоспалительных хемокинов и цитокинов в панкреатических островках. Торможение экспрессии хемокинов в бета-клетках было связано со снижением заболеваемости диабетом [28]. Сравнение моноцитов у пациентов с СД2 с моноцитами здоровых и пациентов с СД1 показало, что моноциты пациентов с диабетом 2-го типа имели значительно более высокие уровни экспрессии провоспалительных интерлейкинов ФНО-альфа, ИЛ-6, ИЛ-1, ИЛ-8, фермента ЦОГ-2, белков-маркеров воспаления (ICAM-1, B7-1) по сравнению с контрольной группой и группой пациентов с диабетом 1-го типа. 1,25-дигидроксивитамин D способствовал снижению экспрессии вышеназванных провоспалительных интерлейкинов [29].
Активированный рецептор VDR регулирует уровни белка-хемоаттрактанта моноцитов (MCP-1). Макрофаги скапливаются в клубочках почек у пациентов с диабетической нефропатией в ответ на секрецию MCP-1. Метаболит витамина D 1,25-(OH) 2 -D блокирует гипергликемию тормозя активацию провоспалительных NF-κB каскадов активации лимфоцитов. В культуре клеток высокий уровень глюкозы индуцирует транскрипцию гена MCP-1 через увеличение транскрипционных факторов p65/p50 сайтами связывания NF-κB в промотере гена MCP-1. ( Примечание. Промотер – участок гена, отвечающий за активацию гена и инициацию процессов транскрипции ). Метаболит 1,25 (OH) 2-D стабилизирует белок IκBα, что приводит к торможению транслокации сигнального белка p65 из цитозоля в ядро клетки, блокировке транскрипции MCP-1 и, следовательно, торможению процессов воспаления [30].
Таким образом, фундаментальные исследования указали на многочисленные параллельные механизмы, посредством которых дефицит витамина D оказывает воздействие на патофизиологию метаболического синдрома и диабета (нарушения регуляции метаболизма углеводов и жиров, процессов воспаления и др). Клинико-эпидемиологические исследования косвенно подтверждают эти выводы, сделанные в рамках фундаментальных исследований.
Эпидемиологические исследования связи дефицита витамина D и диабета
Проводимые в течение последних десятилетий эпидемиологические исследования предоставили неоспоримые свидетельства ассоциации между недостаточным потреблением витамина D и риском развития диабета и его осложнений.
Следует отметить, что в эпидемиологических исследованиях вообще оценка нутрициальных факторов достаточно часто производится на основе опросников диеты. Опросники не всегда калибруются по уровням соответствующих метаболитов (например, активных форм витамина D, магния, цинк и др.) в плазме крови пациентов. Соответственно, использование только некалиброванных опросников снижает достоверность исследования.
В случае же эпидемиологических работ по взаимосвязи витамина D с риском диабета, большинство исследований включило непосредственные измерения концентраций уровней витамина D, 25-гидроксивитамина D (25(OH)D), 1,25-дигидроксивитамин D (1,25 (OH)2 D) в плазме крови. Использование непосредственных измерений уровней метаболитов в плазме крови значительно повышает научную достоверность этих исследований. Заметим, что во всех цитируемых ниже крупномасштабных исследованиях оценивался риск развития СД2.
Важным результатом этих исследований также является подтверждение низкого уровня витамина D в плазме как независимого фактора риска сахарного диабета 2-го типа. Например, в крупномасштабном исследовании «National Health and Nutrition Examination Survey» (NHANES) было показано, что недостаточное потребление витамина D связано с повышенным риском такого серьёзного осложнения СД2 как периферическая нейропатия (О.Р. 2,12, 95% ДИ 1.17-3.85). Достоверность ассоциации сохранялась после поправок на демографические факторы, ожирение и сопутствующие заболевания, в т.ч. диабет [31].
В рамках крупномасштабного «Исследования Здоровья Медсестер» («Nurses’ Health Study», США), было проведено сравнение группы из 608 женщин с впервые выявленным СД2 и контрольной группы из 559 женщин без диабета. После корректировки на другие факторы риска, более высокие уровни 25(OH)D в плазме крови были ассоциированы с более низким риском СД2. При сравнении подгруппы с самыми высокими уровнями 25(OH)D (более 33 нг/мл) с подгруппой с самыми низкими уровнями 25(OH)D (менее 14 нг/мл), риск СД2 снижался почти в 2 раза (О.Р. 0.52, 95% ДИ 0.33-0.83) [32].
В выборке 1972 участников Фрамингемской когорты было установлено 133 впервые выявленных случаев СД2 в течение 7 лет наблюдений. По сравнению с лицами в самой низкой обеспеченностью (нижняя треть концентраций 25(OH)D) в начале исследования, риск развития СД2 среди участников в самой высокой трети концентраций 25(OH)D был на 40% выше после поправок на возраст, пол, окружность талии, семейную историю СД2, артериальную гипертонию, низкий уровень липопротеина высокой плотности (ЛПВП), повышение уровня триглицеридов и повышенный уровень глюкозы натощак (О.Р. 0.60. 95% ДИ 0.37..0.97, P = 0.03) [33].
В популяционной когорте 2465 европейцев уровни 25(OH)D в сыворотке были низкими (<50 нмоль/л) у 29% и очень низкими (<37 нмоль/л) у 11% обследованных. После внесения поправок на пол, возраст, географический регион проживания, уровень образования, курение, индекс массы тела (ИМТ), физическую активность, общую калорийность питания, риск сахарного диабета был значимо связан с более низкими уровнями 25(OH)D в плазме крови. Участники с уровнями 25(OH)D более 80 нмоль/л в два раза реже страдали сахарным диабетом (О.Р. 0.5, 95% ДИ 0.3..0.9) по сравнению с участниками, имевшими низкие уровни 25(OH)D (менее 37 нмоль/л) [34].
В кросс-секционном исследовании когорты из 5787 корейцев (старше 20 лет, 2453 мужчин) диагноз СД2 ставился при уровнях глюкозы в плазме натощак более 7 ммоль/л; многие пациенты получали пероральные гипогликемические препараты или инсулин. По сравнению с лицами с достаточными уровнями 25(OH)D в сыворотке (более 75 нмоль/л) риск СД2 у обследован
Влияние витамина D на лишний вес
Витамин Д и лишний вес : недостаток витамина Д влияет на ожирение
Роль дефицита витамина D в развитии ожирения и диабета 2 типа | Minisun
Нормализует давление, повышает либидо и даже помогает похудеть: все...
Витамин Д – помощник в похудении?
Джилиан Майклс Сбрось Лишний Вес Отзывы
Зависимость Лишнего Веса
Рассчитать Лишний Вес Калькулятор Онлайн
Витамин Д3 И Лишний Вес





















.jpg)