«Вакцина от рака? Разве это возможно?»
Илья Ясный, @LanceBio«Вижу сообщения о том, что появились РНК-вакцины от рака. Но ведь вакцины – против инфекций? Как же они могут использоваться против рака? Разве прививки делают, когда человек уже заболел? И разве уже есть прививка от рака?» Давайте наведем ясность.
Лекарств от рака существуют сотни, и некоторые из них способны вылечить болезнь, но проблема рака в целом пока далека от разрешения. Один из возможных подходов к лечению рака – так называемые противораковые вакцины. Разберемся, что это такое, и подробнее расскажем о самом современном способе вакцинации – неоантигенных вакцинах, их успехах и проблемах.
«Разве вакцины – не от инфекционных заболеваний?»
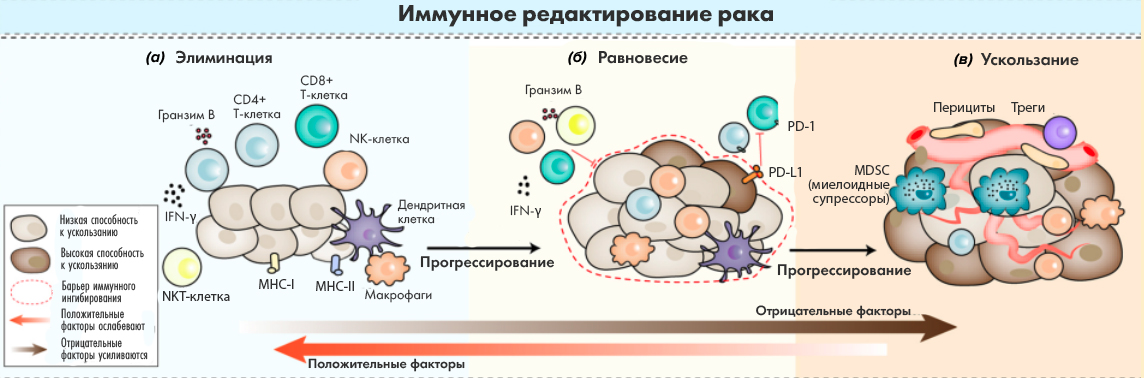
В заголовке – популярный вопрос: в массовом сознании вакцинация – это профилактическое введение веществ, вызывающих специфический иммунный ответ против патогена. Впоследствии при встрече с патогеном наличие иммунитета против него позволяет быстро сформировать защитную реакцию организма и в большинстве случаев предотвратить смерть или тяжелое течение болезней. По аналогии, вакцинация против рака предполагает создание иммунной защиты против раковых клеток. Сложность здесь в том, что изначально это свои клетки, однако в процессе онкологической трансформации они накапливают отличия от здоровых. По современным данным, иммунная система «замечает» эти различия и до поры до времени уничтожает ненормальные клетки – это происходит у здоровых людей в течение всей жизни. Однако иногда раковых клеток становится слишком много, они эволюционируют, постепенно уходя от контроля иммунной системы (рис. 1), и возникает раковая опухоль. Мы пока еще не умеем создавать профилактические вакцины от рака вообще, потому что заранее совершенно неизвестно, какие поломки произойдут в клетках и станут определяющими. Поэтому сейчас все противораковые вакцины в разработке – терапевтические, то есть их применение изучают у пациентов с уже диагностированным заболеванием.
Профилактические вакцины, предотвращающие рак
Впрочем, вакцины, которые предотвращают рак, существуют. Это, например, вакцина против папилломавируса или против вируса гепатита В. Недавно было опубликовано исследование из Шотландии, которое показало, что вакцинация девочек 12-13 лет против папилломавируса полностью защищает от рака шейки матки на протяжении последующих 11 лет! Хронический гепатит В в некоторых случаях приводит к развитию рака печени, так что вакцинация против гепатита В – важный способ профилактики этого рака. К сожалению, у большинства остальных раков нет такой четкой причины в виде патогенных вирусов, поэтому профилактической вакцинации против них пока нет.
История вакцинации от рака
Все способы борьбы с раком направлены на поиск отличий раковой клетки от нормальной, но воздействуют на эти отличия по-разному. Радио- и химиотерапия бьет по всем быстро делящимся клеткам. Такой способ эффективен, но затрагивает много нормальных клеток организма, в первую очередь эпителий кишечника, волосяные луковицы, слизистые оболочки. Более избирательна таргетная терапия, направленная на подавление мутантных белков в раковых клетках или на белки, от которых раковые клетки зависят сильнее, чем нормальные. Иммунотерапия, в частности, онковакцины, тоже приводит к воздействию на мутантные белки, только не напрямую, а «руками» иммунной системы. Как мы уже упоминали выше, иммунная система способна атаковать раковые клетки, надо только ей помочь. Это можно делать разными способами: подавляя опухолевые барьеры, которые мешают клеткам иммунной системы атаковать раковые (так работает антитело пембролизумаб – первое лекарство по продажам в мире – и его аналоги), вводя уже активные клетки иммунной системы (так работают CAR-T и другие клеточные технологии) или вводя что-то, что приведет к появлению активных Т-клеток внутри организма (так и работают онковакцины). Конечной целью в любом случае является такая активация иммунной системы, которая приведет к устойчивому снижению размера опухоли (в идеале – к исчезновению) и при этом не слишком навредит организму. Основную роль здесь играют цитотоксические Т-лимфоциты (Т-киллеры), которые специфичны против белков на поверхности опухолевой клетки, активируются при встрече с ними и убивают клетку. При этом остальные компоненты иммунной системы (Т-хелперы, В-клетки, NK-клетки и многочисленные факторы врожденного иммунитета) должны помогать этому процессу.
Еще в середине 19 века было замечено, что у пациентов, переболевших тяжелыми бактериальными инфекциями, наблюдаются случаи регрессии рака. В конце 19 века хирург из Нью-Йорка Уильям Коли заметил, что большая часть таких случаев – это пациенты с саркомами, перенесшие стрептококковую инфекцию. Он сначала пытался вводить пациентам в опухоль живые бактерии, но пациенты чуть не умерли, и тогда он стал применять убитые бактериальные культуры. Препарат оказался эффективен, особенно против сарком, и вызывал регрессию опухолей, иногда долговременную. Этот метод применялся до 1963 года, но потом в силу потенциальных осложнений и неудобства был заменен химио- и радиотерапией. В 1970-х годах для лечения рака мочевого пузыря стали применять БЦЖ (бацилла Кальмета – Герена, представляющая собой ослабленный штамм бычьего туберкулеза), которая используется для вакцинации против туберкулеза. Казалось бы – какая связь? И как вообще такое могло прийти в голову? Оказывается, ученые заметили, что между заболеваемостью туберкулезом и раком есть обратная корреляция. Сначала были проведены исследования на мышах и оказалось, что предварительное введение им БЦЖ защищает от рака. Механизм противоопухолевой активности БЦЖ до конца не изучен до сих пор, вероятно, дело в неспецифической активации локального иммунитета и еще каких-то факторах. Последующие клинические исследования показали эффективность БЦЖ в лечении рака мочевого пузыря, и этот метод используется до сих пор.
По мере развития онкологии и иммунологии производились попытки использовать для вакцинации опухолевые клетки или их фрагменты, например, пробовали вводить пациентам его же опухолевые клетки, обработанные радиацией, чтобы они не могли делиться. По идее, такой препарат должен вызвать сильный иммунный ответ, но на практике его было недостаточно, чтобы привести к устойчивой регрессии опухоли.

Постепенно фокус разработки смещался в сторону всё более избирательного подхода – воздействия на один или несколько неоантигенов.
Неоантигены – ключ к специфичности
Неоантигены (от слова «новый антиген») – это мутантные последовательности в белках опухолевых клеток, которые отличают их от нормальных клеток и при этом потенциально иммуногенны (на это указывает термин «антиген», обозначающий пептидные участки, с которыми связываются антитела и другие белки иммунной системы).
В большинстве клеток нашего организма внутриклеточные белки разбираются на части – пептиды, которые затем связываются со специальными белками и выставляются на поверхности клетки (это образно называется презентацией). Затем клетки иммунной системы периодически «осматривают» наши клетки, и если обнаруживают на ее поверхности что-то неправильное – например, фрагмент вирусного или мутированного белка, то клетка уничтожается. Такие неправильные пептиды и называются неоантигенами.
К началу 21 века технологии секвенирования (определения последовательности ДНК и РНК) позволили ускорить и удешевить поиск мутаций в опухолях пациентов. Другая важная составляющая при разработке неоантигенных вакцин – прогресс вычислительных методов. После того, как обнаружены отличия между опухолью и нормальной тканью, необходимо рассчитать, какие из пептидов могут быть хорошими неоантигенами.
И, наконец, нужно обучить иммунную систему правильно реагировать на неоантигены. Тут есть несколько способов: можно синтезировать неоантигенные пептиды и ввести их в организм, после чего они будут захвачены клетками иммунной системы и обучат Т-клетки нападать на опухоль. Можно также ввести мРНК или другие нуклеиновые кислоты, которые кодируют неоантигенные пептиды. Если эти генетические последовательности попадут в клетки иммунной системы, там синтезируются неоантигенные пептиды, и Т-клетки также обучатся атаковать опухоль. Затем активные Т-киллеры при помощи других компонентов иммунной системы обеспечивают уничтожение опухоли, а потом формируется иммунологическая память, которая препятствует рецидивированию опухоли (рис. 3).
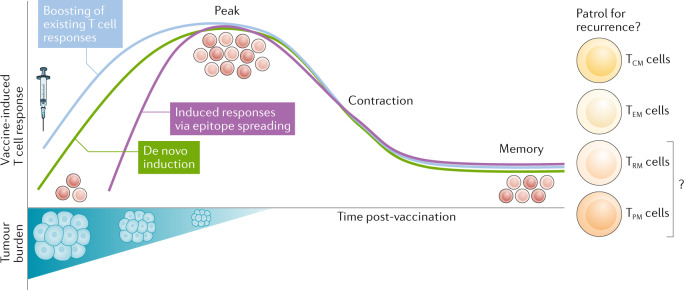
Всё это красиво звучит в теории, но на практике есть очень много вопросов, которые пока до конца не разрешены. Помимо самого выбора неоантигенов, это и способ их доставки в опухоль, и интервал между повторными введениями, и способ введения, и применение адъювантов – веществ, повышающих иммунный ответ. В итоге до недавнего времени неоантигенные показывали только способность вызывать появление активных Т-клеток, но до устойчивой редукции опухоли у большого количества пациентов дело не доходило.
Современное состояние
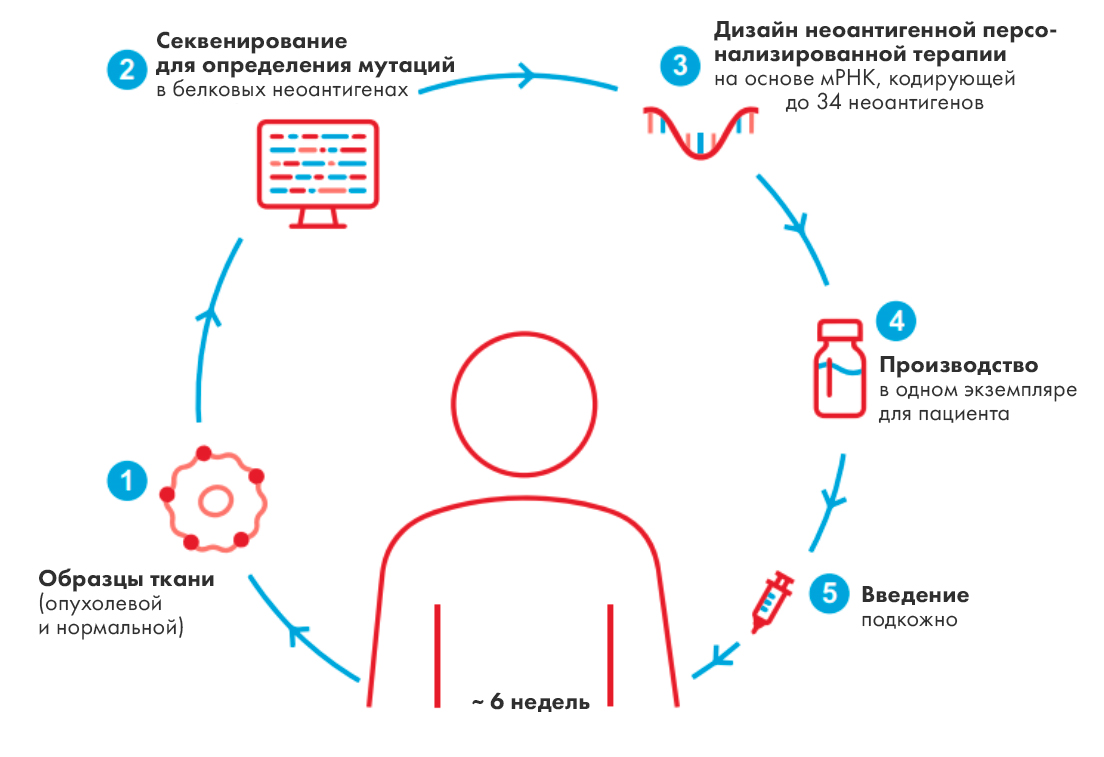
Огромным толчком для области неоантигенных вакцин на основе РНК стали вакцины против COVID-19, разработанные компаниями Moderna и BioNTech/Pfizer. На волне этого успеха Moderna продолжает десятки разработок, и одна из самых многообещающих — РНК-препарат для лечения меланомы – первая неоантигенная вакцина, которая продемонстрировала эффективность в большом сравнительном исследовании. Как и в случае ковидной вакцины, препарат представляет собой РНК, упакованную в липидные наночастицы. В отличие от вакцины, в которой РНК кодирует спайк-белок коронавируса, в состав противоракового препарата входят РНК, кодирующие индивидуальные неоантигены пациента. То есть для того, чтобы получить такой препарат, надо сначала взять у пациента биопсию, отсеквенировать опухолевые клетки, чтобы определить их неоантигенный состав, выбрать до 34 лучших неоантигенов и синтезировать их мРНК (рис. 4). Препарат изучался в клиническом исследовании у пациентов с резектабельной меланомой после полного удаления опухоли и вводился вместо со стандартной терапией — антителом пембролизумаб против рецептора PD-1 (оно снимает «тормоза» с иммунной системы пациента). В контрольной группе пациенты получали только пембролизумаб. По данным трехлетнего наблюдения в экспериментальной группе риск рецидива или смерти снизился на 49% по сравнению с контрольной, а риск развития метастазирования или смерти — на 62%! Сейчас идет набор в исследование фазы 3 по меланоме и раку легкого.
Это прекрасный результат, но, к сожалению, пока непонятно, можно ли его будет обобщить на другие виды рака. Меланома и рак легкого вообще хорошо отвечают на иммунотерапию, в отличие от, например, рака поджелудочной или молочной железы. Тем не менее, сейчас ведется более 100 клинических исследований неоантигенных вакцин, и еще один многообещающий результат был получен как раз в раке поджелудочной железы. Это вакцина компании BioNTech, разработчика другой ковидной вакцины – вместе с Pfizer. Здесь результаты получены пока на небольшом количестве пациентов после резекции опухоли в сочетании с пембролизумабом и химиотерапией, но они очень неплохие для такого тяжелого показания: 8 из 16 пациентов ответили на лечение, и 6 из этих 8 уже три года живут без признаков болезни. Конечно, нужно более длительное наблюдение за большим количеством пациентов, и будем надеяться, что этот тренд сохранится.
Проблемы и перспективы
Неоантигенные вакцины с трудом пробивают себе путь в терапии онкологических заболеваний: иммунная система и ее отношения с опухолью слишком сложны и пока не до конца изучены. Опухоль вырабатывает способы защищаться от воздействия иммунной системы, она даже способна «переучивать» иммунные клетки, которые приходят, чтобы ее атаковать, и ставить их себе на службу, используя их для защиты от последующих атак иммунной системы.
Коррупция Т-клеток
Звучит как взаимоотношения в человеческом обществе, не правда ли? Как будто коррумпированная среда заставляет полицейских работать на криминал. Опухоль эксплуатирует механизм, который нужен для защиты собственных тканей от атаки иммунной системы. Любые Т-клетки всегда специфичны против какого-то одно антигена, но они могут или атаковать клетки с таким антигеном (Т-киллеры), либо защищать их от атаки (регуляторные Т-клетки). Если в процессе созревания Т-клетки она реагирует на собственные антигены, то она либо уничтожается, либо превращается в регуляторную Т-клетку, которая способная защищать свои ткани от иммунной атаки. В опухоли создается такая среда, что Т-киллеры, направленные против антигенов опухоли, становятся регуляторными клетками, сохраняя специфичность. Теперь они способны вместо атаки на опухоль защищать ее от приходящих в опухоль Т-киллеров.
Кроме того, опухоль очень гетерогенна: две соседние клетки могут иметь разный генотип и состав РНК, а ведь далеко не всегда можно сделать полную резекцию опухоли, чтобы досконально определить ее неоантигенный состав. При игольчатой биопсии велик шанс пропустить важные неоантигены и получить недостаточно эффективный препарат. Впрочем, сейчас пытаются определять неоантигенный состав опухоли неинвазивно, по циркулирующей ДНК или по составу опухолевых экзосом. Изготовление персонализированной вакцины занимает время, за это время опухоль может эволюционировать. Также опухоль эволюционирует под давлением иммунотерапии: если какие-то клетки выжили, они дают начало новым клонам, устойчивым к терапии.
Но неоантигенный подход настолько привлекательный и многообещающий, что исследователи надеются: будущее противораковой терапии всё равно за персонализированным неоантигенным подходом.