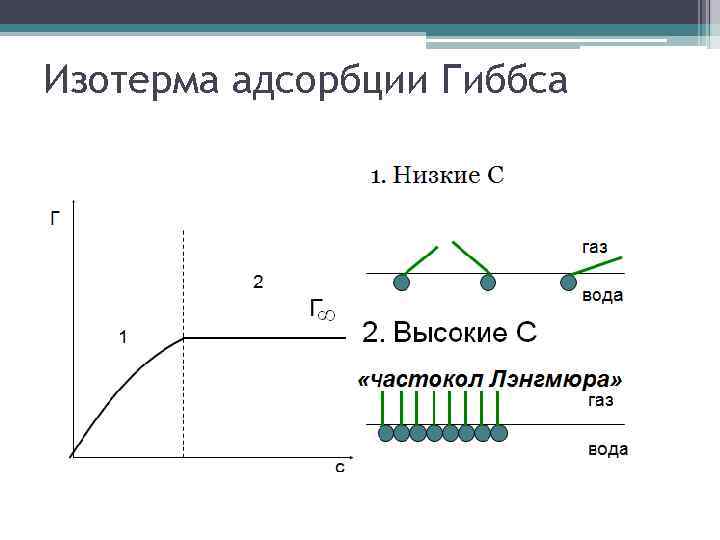
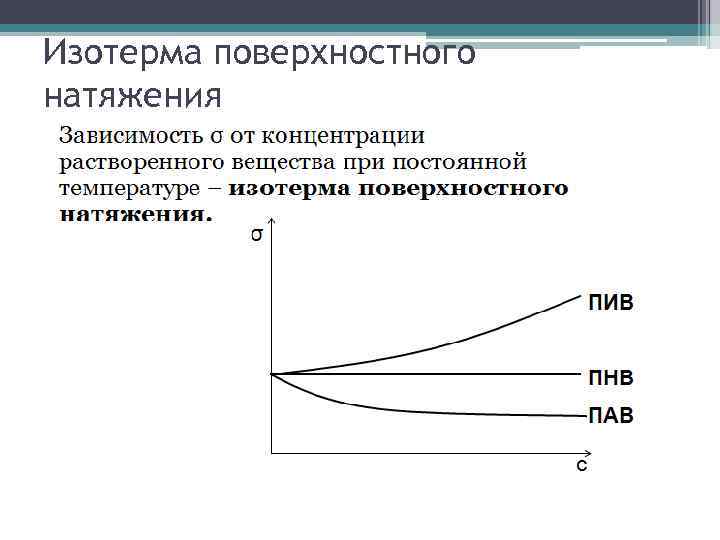
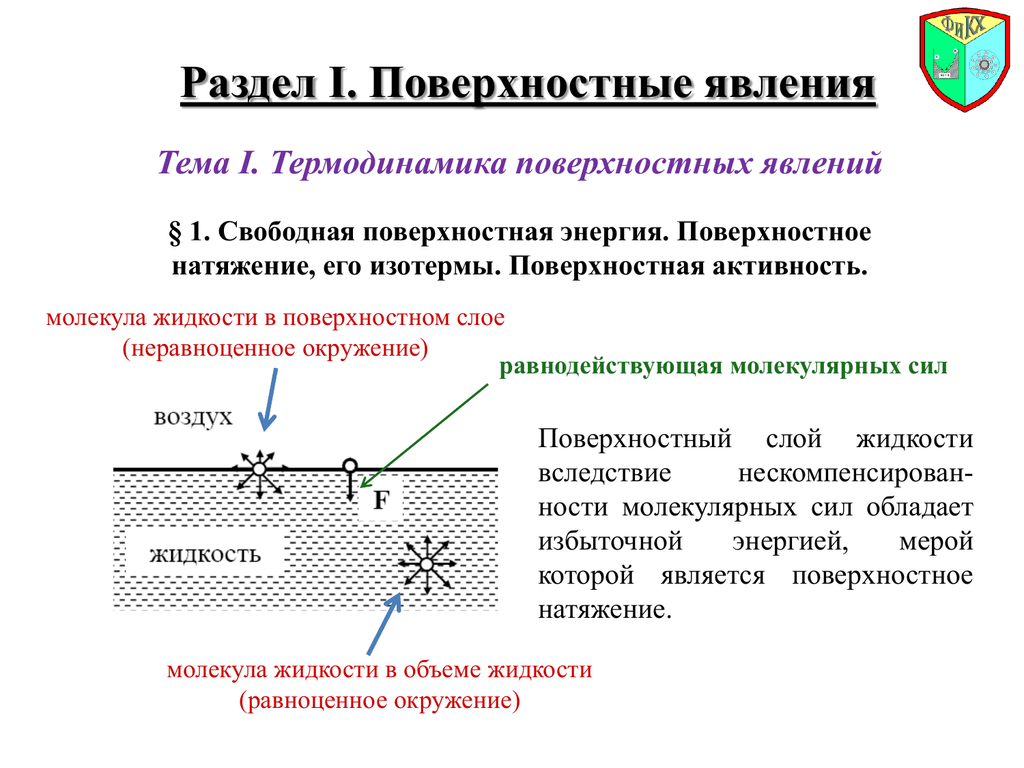
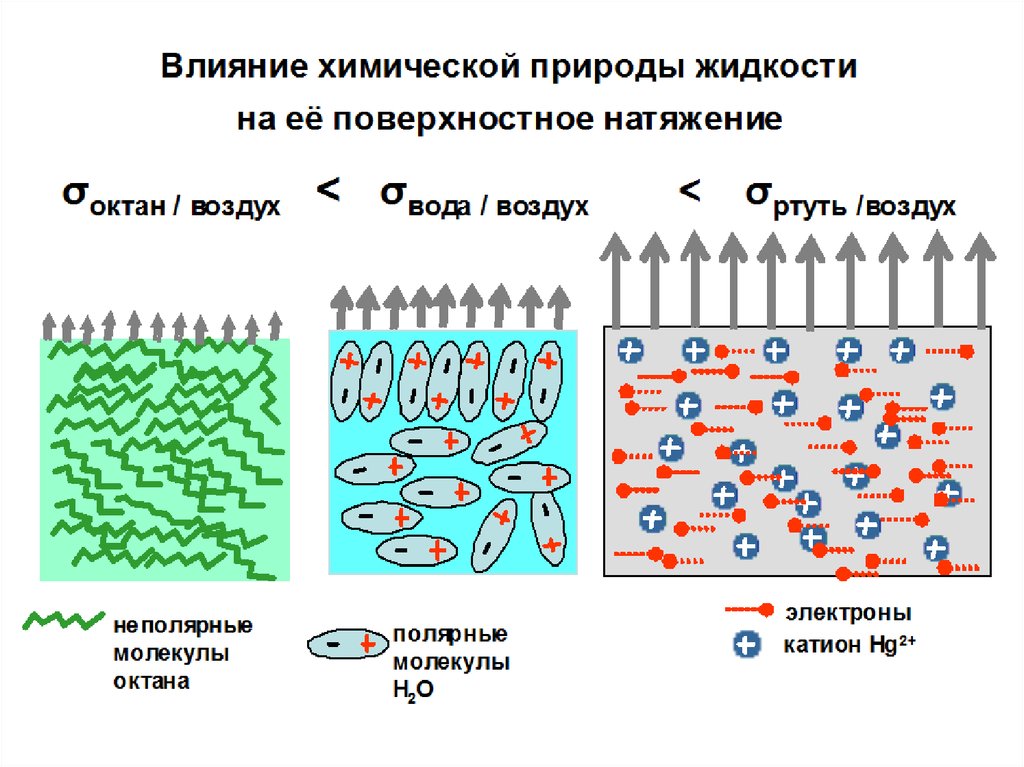
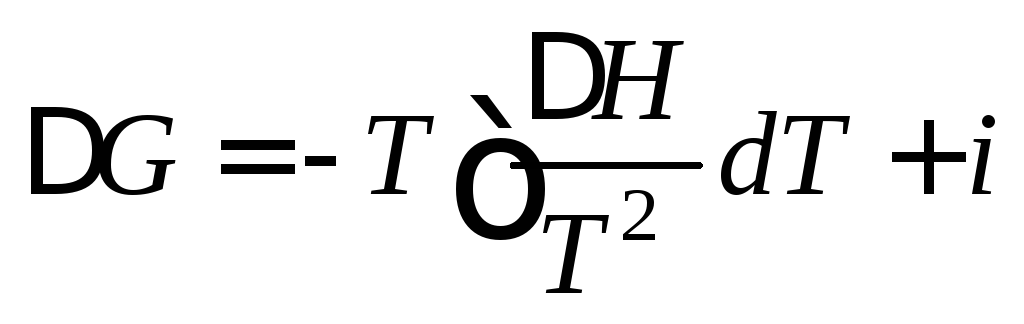Уравнение Гиббса Член Свободной Энергииъ

⚡ 👉🏻👉🏻👉🏻 ИНФОРМАЦИЯ ДОСТУПНА ЗДЕСЬ ЖМИТЕ 👈🏻👈🏻👈🏻
РекламаКниги по вечным двигателям и свободной энергии
https://chemistry.ru/textbook/chapter4/section/paragraph6
Записав уравнение (4.2) в виде ΔH = ΔG + T ΔS, получим, что энтальпия реакции включает свободную энергию Гиббса и «несвободную» энергию ΔS ċ T. Энергия …
https://physics.spbstu.ru/userfiles/files/molec3-07.pdf
3.7. Связь распределения Гиббса со свободной энергией. Уравнение состояния. 3.7.1.Свободная энергия и распределение Гиббса. Одной из задач статистической …
https://wikichi.ru/wiki/Gibbs_free_energy
В термодинамике свободная энергия Гиббса представляет собой термодинамический потенциал , который можно использовать для расчета максимальной обратимой работы …
https://ru.wikipedia.org/wiki/Энергия_Гиббса
Ориентировочное время чтения: 3 мин
Связь с химическим потенциалом
Используя свойства экстенсивности термодинамических потенциалов, математическим следствием которых является соотношение Гиббса-Дюгема, можно показать, что химический потенциал для системы с одним типом частиц есть отношение энергии Гиббса к числу молей вещества n в системе:
Если …
Связь с химическим потенциалом
Используя свойства экстенсивности термодинамических потенциалов, математическим следствием которых является соотношение Гиббса-Дюгема, можно показать, что химический потенциал для системы с одним типом частиц есть отношение энергии Гиббса к числу молей вещества n в системе:
Если система состоит из частиц нескольких сортов с числом молей частиц каждого сорта, то соотношения Гиббса-Дюгема приводят к выражению
Химический потенциал применяется при анализе систем с переменным числом частиц, а также при изучении фазовых переходов. Так, исходя из соотношений Гиббса — Дюгема и из условий равенства химических потенциалов находящихся в равновесии друг с другом фаз, можно получить уравнение Клапейрона — Клаузиуса, определяющее линию сосуществования двух фаз в координатах через термодинамические параметры (удельные объёмы) фаз и теплоту перехода между фазами.
Энергия Гиббса и направление протекания реакции
В химических процессах одновременно действуют два противоположных фактора — энтропийный () и энтальпийный (). Суммарный эффект этих противоположных факторов в процессах, протекающих при постоянном давлении и температуре, определяет изменение энергии Гиббса ():
Из этого выражения следует, что , то есть некоторое количество теплоты расходуется на увеличение энтропии (), эта часть энергии потеряна для совершения полезной работы (рассеивается в окружающую среду в виде тепла), её часто называют связанной энергией. Другая часть теплоты () может быть использована для совершения работы, поэтому энергию Гиббса часто называют также свободной энергией.
Характер изменения энергии Гиббса позволяет судить о принципиальной возможности осуществления процесса. При процесс может протекать — самопроизвольный процесс, при процесс протекать не может — несамопроизвольный процесс (иными словами, если энергия Гиббса в исходном состоянии системы больше, чем в конечном, то процесс принципиально может протекать, если наоборот — то не может). Если же , то система находится в состоянии химического равновесия.
Обратите внимание, что речь идёт исключительно о принципиальной возможности протекания реакции. В реальных же условиях реакция может не начинаться и при соблюдении неравенства (по кинетическим причинам).
Существует полезное соотношение, связывающее изменение свободной энергии Гиббса в ходе химической реакции с её константой равновесия :
где — равновесная константа по давлению (только в барах).
Вообще говоря, любая реакция может быть рассмотрена как обратимая (даже если на практике она таковой не является). При этом константа равновесия определяется как
где — константа скорости прямой реакции, — константа скорости обратной реакции.
Связь с термодинамической устойчивостью системы
Поскольку энергию Гиббса можно превратить в работу, то ее также называют свободной энергией. Второй член правой части уравнения (энтропийный фактор) …
https://chemistry.ru/course/content/chapter4/section/paragraph6/theory.html
Изменение энергии Гиббса: а – обратимый процесс; б – необратимый процесс. Записав уравнение (4.2) в виде Δ H = Δ G + T Δ S, получим, что энтальпия реакции включает свободную энергию Гиббса и «несвободную» …
ru.solverbook.com/spravochnik/uravneniya-po-fizike/uravnenie-gibbsa
Уравнение Гиббса применяется для изобарно-изотермических процессов, а именно такими и являются химические реакции и фазовые переходы. Уравнение имеет вид: — изменение энтальпии системы, Т – её абсолютная температура, S – энтропия. – свободная энергия Гиббса, …
https://cyberleninka.ru/article/n/ob-ispolzovanii-uravneniya-gibbsa-dyugema-v...
Об использовании уравнения Гиббса-Дюгема в расчетах свободной энергии смешения полимерных …
zadachi-po-khimii.ru/obshaya-himiya/energiya-gibbsa-energiya-gelmgolca-napravlenie...
ΔG= Gкон – Gисх. При постоянных температуре и давлении изменение энергии Гиббса связано с энтальпией и энтропией следующим выражением: ΔG = ΔH– TΔS. …
https://studopedia.ru/19_372327_energiya-gibbsa-i-napravlenie-protekaniya-reaktsii.html
21.01.2018 · Свободная энергия Гиббса измеряется в тех же единицах, что и обычная энергия; размерность молярной свободной энергии: кДж/моль. Обращает на себя внимание тот факт, что свободные энергии …
РекламаУникальный метод access bars(32 точки на голове), дает ваш выбор возможностей · 20347 · пн-сб 12:00-19:00
РекламаБыстрый займ онлайн без отказов до 500 000 рублей! Без проверки кредитной истории!
Финансовые услуги оказывает: ООО "ХКФ Банк"
Не удается определить ваше расположение.
Не удается получить доступ к вашему текущему расположению. Для получения лучших результатов предоставьте Bing доступ к данным о расположении или введите расположение.
Не удается получить доступ к расположению вашего устройства. Для получения лучших результатов введите расположение.
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 28 сентября 2020; проверки требуют 5 правок.
Свобо́дная эне́ргия Ги́ббса (или просто эне́ргия Ги́ббса, или потенциа́л Ги́ббса, или изобарно-изотермический потенциал, или термодинами́ческий потенциа́л в узком смысле) — это величина, изменение которой в ходе химической реакции равно изменению внутренней энергии системы. Энергия Гиббса показывает, какая часть от полной внутренней энергии системы может быть использована для химических превращений или получена в их результате в заданных условиях и позволяет установить принципиальную возможность протекания химической реакции в заданных условиях. Математически это термодинамический потенциал следующего вида:
Энергию Гиббса можно понимать как полную потенциальную химическую энергию системы (кристалла, жидкости и т. д.)
Понятие энергии Гиббса широко используется в термодинамике и химии.
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (), и энтропийным , обусловленным увеличением беспорядка в системе вследствие роста её энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (, кДж)
Классическим определением энергии Гиббса является выражение
Дифференциал энергии Гиббса для системы с постоянным числом частиц, выраженный в собственных переменных — через давление и температуру :
Для системы с переменным числом частиц этот дифференциал записывается так:
Здесь — химический потенциал, который можно определить как энергию, которую необходимо затратить, чтобы добавить в систему ещё одну частицу.
Покажем, что минимум потенциала Гиббса соответствует устойчивому равновесию термодинамической системы с фиксированными температурой, давлением и числом частиц.
Таким образом в системе при постоянных температуре и давлении энергия Гиббса достигает минимального значения.
Используя свойства экстенсивности термодинамических потенциалов, математическим следствием которых является соотношение Гиббса-Дюгема, можно показать, что химический потенциал для системы с одним типом частиц есть отношение энергии Гиббса к числу молей вещества n в системе:
Если система состоит из частиц нескольких сортов с числом молей частиц каждого сорта, то соотношения Гиббса-Дюгема приводят к выражению
Химический потенциал применяется при анализе систем с переменным числом частиц, а также при изучении фазовых переходов. Так, исходя из соотношений Гиббса — Дюгема и из условий равенства химических потенциалов находящихся в равновесии друг с другом фаз, можно получить уравнение Клапейрона — Клаузиуса, определяющее линию сосуществования двух фаз в координатах через термодинамические параметры (удельные объёмы) фаз и теплоту перехода между фазами.[1]
В химических процессах одновременно действуют два противоположных фактора — энтропийный ( ) и энтальпийный ( ). Суммарный эффект этих противоположных факторов в процессах, протекающих при постоянном давлении и температуре, определяет изменение энергии Гиббса ( ):
Из этого выражения следует, что , то есть некоторое количество теплоты расходуется на увеличение энтропии ( ), эта часть энергии потеряна для совершения полезной работы (рассеивается в окружающую среду в виде тепла), её часто называют связанной энергией. Другая часть теплоты ( ) может быть использована для совершения работы, поэтому энергию Гиббса часто называют также свободной энергией.
Характер изменения энергии Гиббса позволяет судить о принципиальной возможности осуществления процесса. При процесс может протекать — самопроизвольный процесс, при процесс протекать не может — несамопроизвольный процесс (иными словами, если энергия Гиббса в исходном состоянии системы больше, чем в конечном, то процесс принципиально может протекать, если наоборот — то не может). Если же , то система находится в состоянии химического равновесия.
Обратите внимание, что речь идёт исключительно о принципиальной возможности протекания реакции. В реальных же условиях реакция может не начинаться и при соблюдении неравенства (по кинетическим причинам).
Существует полезное соотношение, связывающее изменение свободной энергии Гиббса в ходе химической реакции с её константой равновесия :
где — равновесная константа по давлению (только в барах).
Вообще говоря, любая реакция может быть рассмотрена как обратимая (даже если на практике она таковой не является). При этом константа равновесия определяется как
где — константа скорости прямой реакции, — константа скорости обратной реакции.
Энергия Гиббса названа в честь одного из основателей термодинамики, Джозайи Уилларда Гиббса.
↑ Стромберг А. Г., Семченко Д. П. Физическая химия: учебник для хим. спец. вузов. — 6-е изд. — M: Высшая школа, 2006. — 527 с.
Содержание доступно по лицензии CC BY-SA 3.0 (если не указано иное).
Как Парни Лишаются Девственности Видео
Порно Зрелых Девочек
Сётсры Близняшки Трахаются
Развратные Порно Девочки Фото
Дарья Мельникова Фото Ню
Открытая Химия. Энергия Гиббса
3.7. Связь распределения Гиббса со свободной энергией ...
Свободная энергия Гиббса - Gibbs free energy - Википедия
Энергия Гиббса — Википедия
Энергия Гиббса (изобарно-изотермический потенциал)
4.6. Энергия Гиббса - chemistry.ru
Уравнение Гиббса в физике
Об использовании уравнения Гиббса-Дюгема в расчетах ...
Энергия Гиббса. Энергия Гельмгольца. Направление проц…
Энергия Гиббса и направление протекания реакции — Студопед…
Уравнение Гиббса Член Свободной Энергииъ