Сацитузумаб говитекан в последующих линиях увеличивает выживаемость при метастатическом трижды негативном раке молочной железы. Результаты исследования ASCENT.
HSO talksМатериал подготовила Ксения Деханова.
Что это такое?
Сацитузумаб говитекан является комбинированным препаратом, состоящим из антитела к белку TROP-2 (human trophoblast cell-surface antigen 2), экспрессируемому на большинстве клеток трижды негативного рака молочной железы и цитостатика SN-38 (ингибитор топоизомеразы I).
Что случилось?
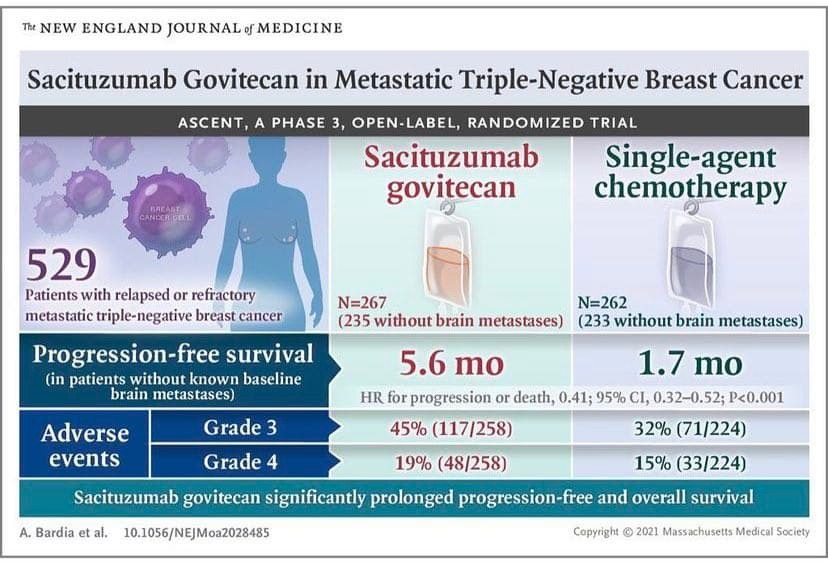
22 апреля 2021 года в журнале NEJM были опубликованы результаты исследования ASCENT. В нем приняли участие 468 пациентов с метастатическим трижды негативным раком молочной железы без метастазов в головном мозге. Все пациенты на более ранних этапах лечения получали терапию таксанами. Половина пациентов (235) в рамках исследования проходили лечение сацитузумабом говитеканом, другая половина (233) – монохимиотерапией на усмотрение лечащего врача.
Что получили?
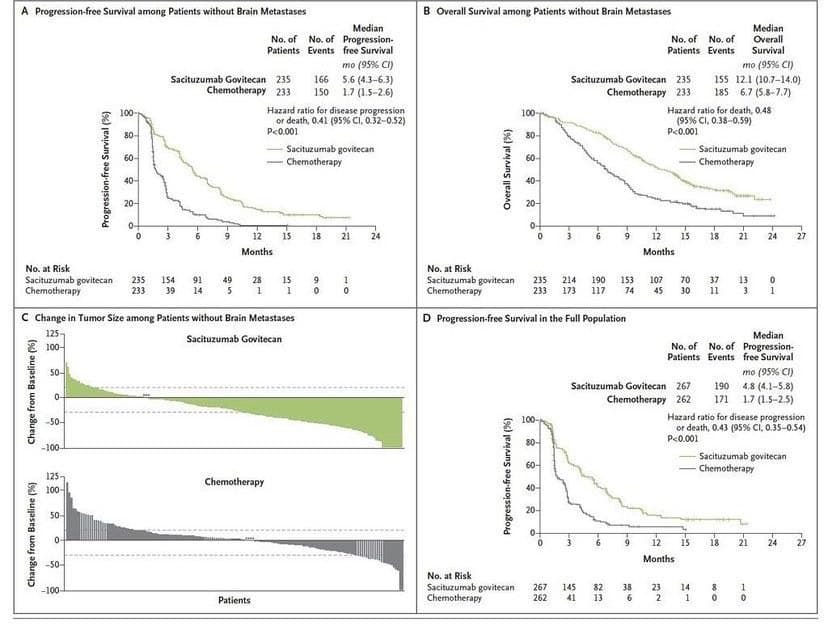
По результатам исследования ASCENT медиана беспрогрессивной выживаемости составила 5.6 месяцев в группе сацитузумаба говитекана и 1.7 месяцев в группе монохимиотерапии (отношение рисков (HR) 0.41; 95% доверительный интервал (ДИ) 0.32 to 0.52; P<0.001). Медиана общей выживаемости в группе сацитузумаба говитекана достигла 12.1 месяца, а то время как в контрольной группе – 6.7 месяцев (HR 0.48; 95% ДИ 0.38 to 0.59; P<0.001). Частота объективных ответов в экспериментальной группе (сацитузумаба говитекана) - 35%, в то время как в контрольной группе – только 5%.
Среди побочных эффектов grade 3 и выше нейтропения наблюдалась у 51% пациентов в экспериментальной группе и у 33% пациентов в контрольной группе, лейкопения в 10% и 5% , диарея в 20% и менее 1%, анемия в 8% и 5%, фебрильная нейтропения в 6% и 2% соответственно. В каждой группе по 3 пациента погибли в связи с развитием побочных эффектов.
Что в итоге?
Основываясь на результатах исследования ASCENT, 7 апреля 2021 года FDA одобрило использование сацитузумаба говитекана в лечении пациентов с метастатическим или местнораспространенным трижды негативным раком молочной железы, которые уже получили 2 и более схемы системного лечения, в том числе хотя бы 1 схему для лечения метастатичсеского трижды негативного рака.
Сацитузумаб говитекан продолжает исследоваться в качестве неоадъювантной терапии раннего трижды негативного раннего рака молочной железы (NeoSTAR), адъювантной терапии (GBG102-SASCIA), в комбинации с иммунотерапией для лечения метастатического трижды негативного рака молочной железы (Morpheus-TNBC and Saci-IO TNBC), в комбинации с PARP ингибитором (NCT04039230) при распространенном трижды негативном раке молочной железы, а также при лечении люминального HER-2 негативного метастатического рака молочной железы (TROPiCS-02).
Что все это значит?
Результаты исследования ASCENT позволяют ожидать использования сацитузумаба говитекана в клинической практике в короткие сроки. Несмотря на успешность исследований, посвященных иммунотерапии в первой линии лечения метастатического трижды негативного рака молочной железы, основным стандартом лечения в настоящее время остаются различные режимы монохимиотерапии, имеющие достаточно скромную эффективность. В таких условиях эффективность сацитузумаба говитекана в исследовании ASCENT действительно является исключительной по сравнению с другими режимами монохимиотерапии, используемыми в последующих линиях, что дает шанс пациентам, которые длительное время проходят лечение трижды негативного рака молочной железы и уже получили стандартное лечение.