Редактирование генома (Live)
Долгорукова Антонина, https://t.me/long_hands📖Наши молекулы ДНК состоят из последовательности нуклеотидов (буквы A, T, G, C на картинке). Уникальная последовательность нуклеотидов является геном.
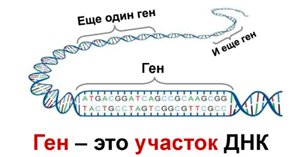
⚕️Есть ряд заболеваний, причиной которых являются различные ошибки в структуре ДНК (генетические мутации). Эти мутации чаще всего передаются от биологических родителей, но иногда могут возникать спонтанно.
CRISPR (Clustered Interspaced Short Palindromic Repeat technique) - метод устранения таких мутаций. Он включает использование двух основных молекул: нуклеазы (редактор генов) и направляющей РНК (помогает нуклеазе найти нужное место для редактирования). Может применяться в редактировании как целых генов, так и отдельных оснований (пары A-T и C-G на картинке выше).
Методы редактирования
1️⃣ Редактирование генов ✂️
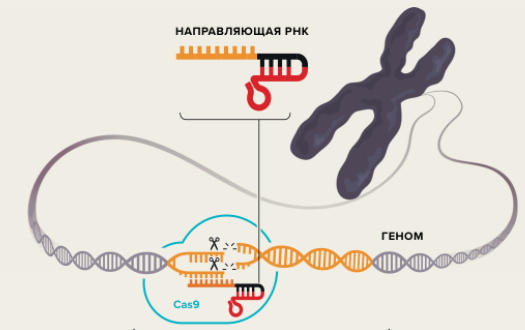
При этом используют нуклеазы Cas9 и Cas12 (a и b). Метод CRISPR/Cas9 получил название «биологические ножницы». Направляющая молекула РНК имеет последовательность, которая совпадает с искомым местом. Так комплекс РНК с Cas9 «находит» нужный участок, и Cas9 «разрезает» молекулу ДНК. Далее возможны разные процессы:
1) Концы получившегося разрыва «сшиваются» (ген инактивируется)
2) Ген перезаписывается по здоровой копии из парной хромосомы за счет естественного процесса репарации (починки) ДНК («заплатка»).
3) Третий вариант - добавить в состав препарата участок «правильного» гена для ремонта разрыва - генетический копипаст.
Отличное видео процесса есть на сайте CRISPR Therapeutics (на английском).
Нуклеазы Cas12a и Cas12b имеют некоторые преимущества (эффективность и точность) и дают больше возможностей для редактирования. Например, Cas12a позволяют нацеливаться на уникальные последовательности ДНК в геноме и делает разрезы ДНК в шахматном порядке. Еще подробнее и интереснее можно почитать, например, здесь.
❌ Существенный недостаток - создается двунитевой разрыв ДНК, а это может активировать самоуничтожение клетки (апоптоз), а если и нет, процесс восстановления разрыва сложен и чреват ошибками, и они необратимы. Это означает, что при каждом редактировании возможен ряд различных изменений последовательности ДНК с неясными последствиями.
2️⃣ Редактирование оснований (base editing) ✏️
Вместо того, чтобы вырезать/чинить «сломанный» ген (слово в предложении), в данном случае точечно удаляется (или замещается) конкретная пара нуклеотидов (буква в слове, или на первой картинке пары A-T и C-G). Такие модификации ДНК более точны и предсказуемы. При этом используются специальные ферменты – дезаминазы. История открытия здесь.
❌ Этот метод пока можно использовать только для определенных типов точечных мутаций (Ц→Т, Г→А, А→Г, Т→Ц), он бессилен против других (например, Ц→А или Г→Т).
3️⃣ Праймированное редактирование (prime editing)
Вместо направляющей РНК используется особая удлиненная РНК для праймированного редактирования (prime editing extended guide RNA, pegRNA, пргРНК). Эта пргРНК выполняет сразу две функции: определяет область, где пройдет редактирование, и несет в себе информацию, которую нужно «вписать» в ген.
Метод открыли ученые Гарварда в 2019 и, конечно, безопасность его использования у людей еще под вопросом.
📍Редактирование генома – пока на зачаточной стадии и не будет панацеей. Дело в том, что только для очень малой доли наследственных заболеваний мы точно знаем, какие именно мутации редактировать. Кроме того, такая терапия требует предварительное подавление возможных нежелательных иммунных реакций (см. ниже).
Заболевания, для которых в настоящее время изучается использование технологий редактирования генома (список не полный):
- Серповидно-клеточная анемия
- Врожденный транстиретиновый амилоидоз (ATTR амилоидоз)
- Мышечная дистрофия Дюшенна
- Гетерозиготная семейная гиперхолестеринемия
- Тяжелые метаболические заболевания
- Заболевания глаз (болезнь Штаргардта, Врожденный амавроз Лебера 10 типа).
Ex vivo и in vivo редактирование
Есть два подхода к редактированию генома: ex vivo (вне организма) и in vivo (внутри организма). При внешнем редактировании (ex vivo), клетки с «отремонтированным» геномом (это могут быть собственные клетки пациента - аутогенные клеточные препараты или универсальные клетки донора - аллогенные клетки) пересаживают в организм больного, где они должны заменить больные клетки и выполнять необходимые функции. Методика «in vivo» подразумевает введение пациенту вещества, которое проникает в клетки и редактирует гены внутри организма.
❌ Важный недостаток трансплантации как своих собственных измененных, так и донорских клеток заключается в необходимости подготовительной цитостатической (химио- и лучевой) терапии - миелоаблативного кондиционирования. Это необходимо для подавления нежелательных реакций иммунной системы. При этом, в течение 1-3 недель может развивиться глубокая панцитопения (уменьшение количества клеток крови) и миелоаблация, что сопровождается тяжелыми осложнениями (риск развития рака, бесплодия, инфекций). Кроме того процесс приготовления терапии персонализирован, долог и очень дорог.
Это указывает на то, что подобная терапия пока может быть доступна только для ограниченной популяции пациентов с таргетным заболеванием.
Биотехи, которые занимаются разработками в области редактирование генома
Биотехи которые можно купить неквалифицированному инвестору у российского брокера: CRISPR Therapeutics, Beam Therapeutics, Editas Medicine, Intellia Therapeutics и Graphite Bio.
📍 CRISPR Therapeutics, Editas Medicine, Intellia Therapeutics и Graphite Bio используют технологии редактирования генов CRISPR, но в несколько разных направлениях. Методики тоже отличаются.
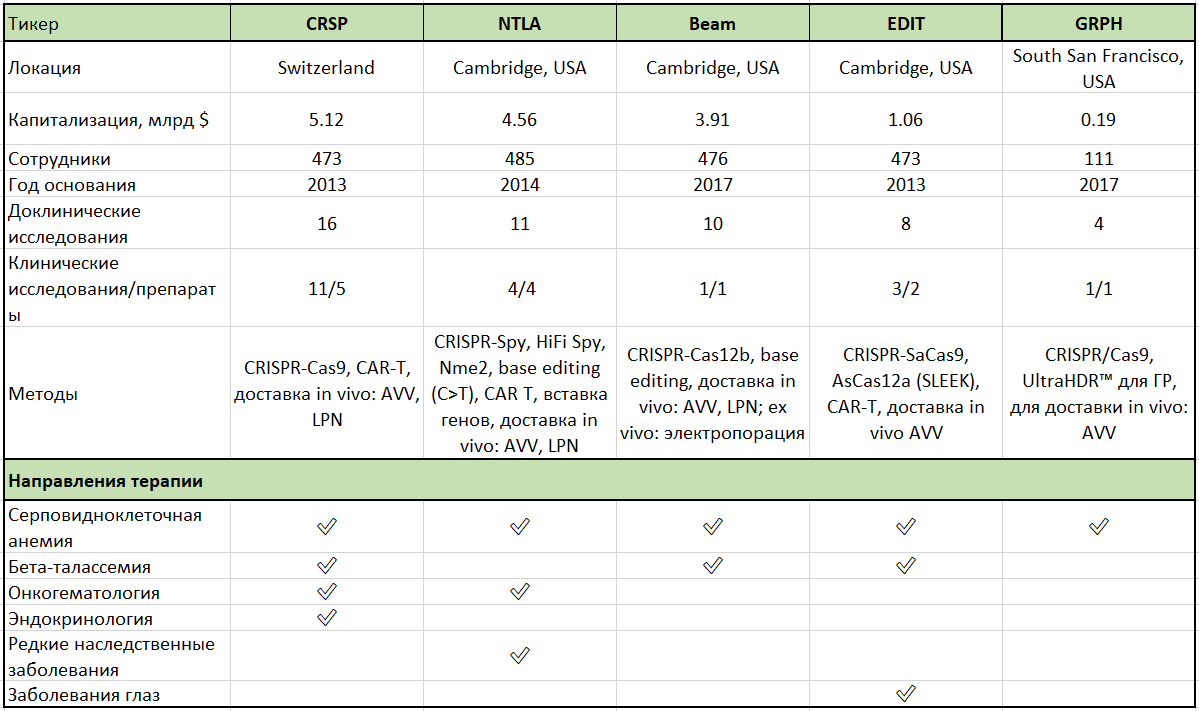
📍 Новейшие технологии используют Beam Therapeutics и Graphite Bio, но все исследования пока еще на очень ранних стадиях.
📍 Дальше других продвинулись в исследованиях на людях - CRISPR Therapeutics и Intellia Therapeutics.
Editas Medicine
Cambridge, United States
Количество сотрудников: 473
Ведущие разработки: генная терапия для лечения наследственных заболеваний глаз и гемоглобинопатий.
Последний апдейт: корпоративная презентация, август 2022.
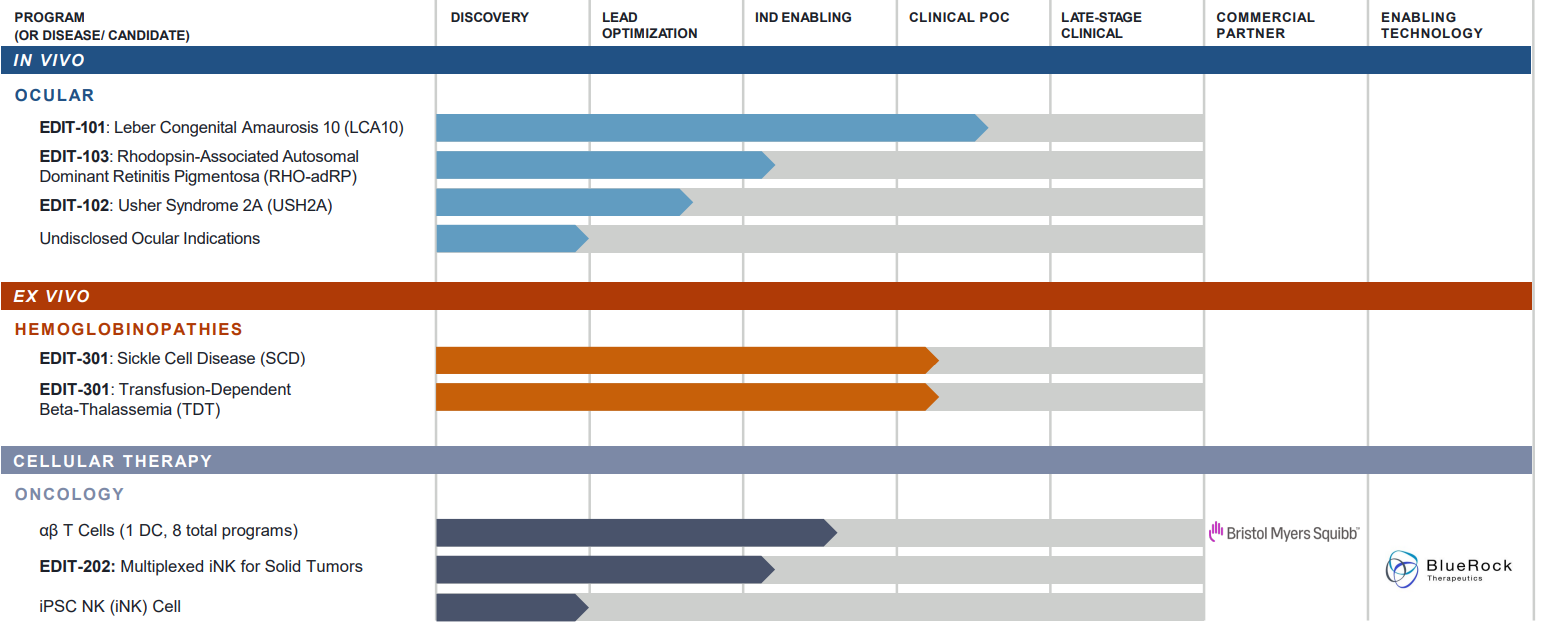
Работают с нуклеазами Cas9 и Cas12a (Cpf1). Для доставки in vivo используют аденоассоциированный вирус (AVV). В онкологических программах используют редактирование SLEEK (SeLection by Essential-gene Exon Knock-in) с запатентованной нуклеазой AsCas12a - технология, которая позволяет "выключать" несколько целевых генов индуцированных плюрипотентных стволовых клеток, Т-клеток и естественных клеток-киллеров (NK) (подробнее о ней здесь и здесь).
In vivo редактирование: в настоящее время ведется 3 программы (1 на клинической стадии) для лечения заболеваний глаз, также разрабатывается новая генная терапия для лечения Синдром Ушера (с использованием AsCas12a), другого заболевания глаз и неврологического заболевания. Ведущая разработка:
💊 EDIT-101 (CRISPR/SaCas9) для устранения точечных мутаций гена CEP290, ведущих к развитию заболевания глаз Амавроза Лебера (КИ 1/2 BRILLIANCE).
- У некоторых пациентов был выявлен предсуществующий иммунный ответ к AVV5 и SaCas9 (связывающие или нейтрализующие антитела к AVV5). При этом введение EDIT-101 не вызывало новых клеточно-опосредованных или гуморальных иммунных реакций на компоненты терапии.
Ex vivo редактирование: около 12 программ в области иммуноонкологии и гематологии, 2 из которых на клинической стадии (EDIT-301). 8 программ ведутся в сотрудничестве с Bristol-Myers Squibb (аутологичные клеточные препараты, Alpha-Beta T Cells, CAR-T - онкология) и 1 с BlueRock Therapeutics (аллогенные клетки, iPSC NK - онкология). В июне компания объявила также о соглашении с Immatics N.V. о совместной разработке аллогенных клеточных линий (платформа ACTallo®, gamma-delta T cells) с целью создания клеток с улучшенным распознаванием и разрушением опухолевых клеток. Ведущая разработка:
💊 EDIT-301 (CRISPR/AsCas12a) - редактирует мутантные гены β-цепи гемоглобина в аутогенных CD34+ гемопоэтических клетках так, что вместо них получаются γ-цепи, что приводит к синтезу фетального гемоглобина HbF (подробнее здесь) и может оказаться полезным для пациентов с серповидно-клеточной анемией (КИ 1/2 фазы RUBY) и бета-талассемией (КИ 1/2 фазы EdiThal).
📢 Во 2 половине 2022: промежуточные результаты КИ 1/2 BRILLIANCE (6 мес наблюдения) и КИ 1/2 фазы RUBY, лечение первого пациента с бета-талассемией; оглашение нового кандидата для лечения другого заболевания глаз. Также в скором времени планируется переход к КИ EDIT-103 для терапии пигментного ретинита (RHO-adRP) и EDIT-202 для терапии солидных опухолей.
CRISPR Therapeutics
Switzerland
Количество сотрудников: 473
Ведущие разработки: генная терапия для лечения гемоглобинопатий. Также у компании есть много кандидатов новых CAR T, модифицированных с использованием CRISPR/Cas9. Последний апдейт: корпоративная презентация, август 2022.
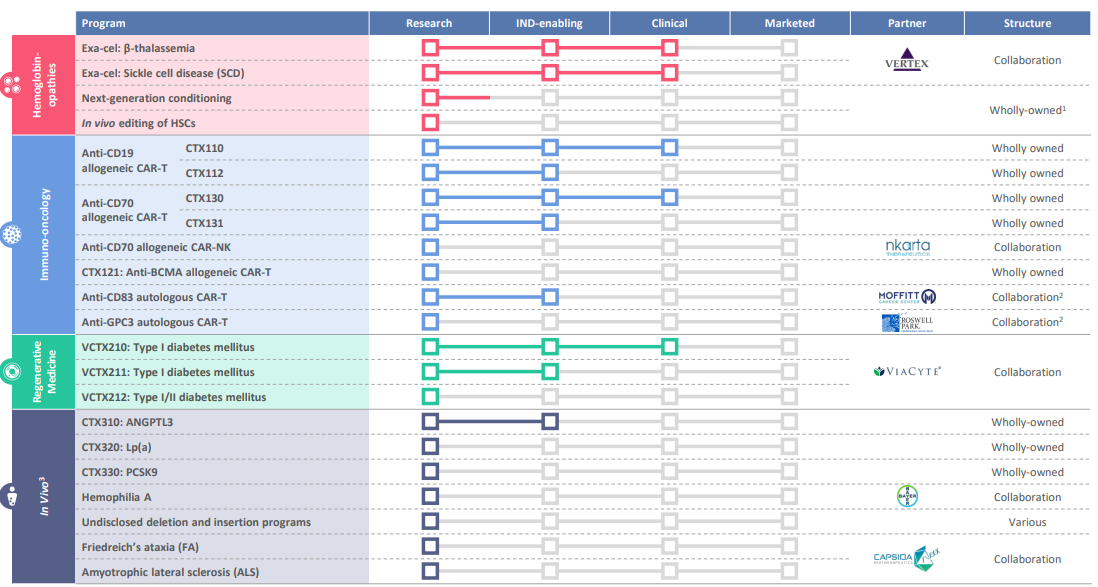
Работают с нуклеазами Cas9 (все разработки - с использованием технологии CRISPR/Cas9). Для доставки in vivo используют аденоассоциированный вирус (AVV) и липидные наночастицы.
In vivo редактирование: в настоящее время ведется 8 программ для лечения различных заболеваний (включая мышечную дистрофию Дюшенна, сердечно-сосудистые заболевания, муковисцидоз, боковой амиотрофический склероз и др.) - все на доклинической стадии. Ведущая разработка:
💊 CTX310 (мишень - ген ANGPTL3) для лечения сердечно-сосудистого заболевания.
Ex vivo редактирование: 13 программ в области иммуноонкологии, гематологии и эндокринологии, 7 из которых на клинической стадии (5 кандидатов). Ведущая разработка (c Vertex Pharmaceuticals):
💊 Exa-cel (CTX001 exagamglogene autotemcel) - редактирует мутантные гены β-цепи гемоглобина так, что вместо них получаются γ-цепи, что приводит к синтезу фетального гемоглобина HbF (подробнее здесь) и может оказаться полезным для пациентов с серповидно-клеточной анемией и бета-талассемией. Проходит КИ 3 фазы (+ одно наблюдательное).
- У 95% (42/44) пациентов с трансфузионно-зависимой бета-талассемией не возникла необходимость в переливании крови (в течение 0.8 - 36.2 мес. после терапии).
- У 100% пациентов с серповидно-клеточной анемией не зарегистрировано вазоокклюзивных кризов (в течение 2.0 - 32.3 мес. после терапии).
- у двух пациентов с бета-талассемией были СНЯ, связанные с Exa-cel, включая гемофагоцитарный лимфогистиоцитоз, острый респираторный дистресс-синдром и головная боль, а также синдром идиопатической пневмонии и тромбоцитопения (связанные как с экзацелом, так и с цитостатиком бусульфаном). Среди 31 пациента с серповидно-клеточной анемией не было СНЯ, связанных с Exa-cel.
📖 Вазоокклюзивный (болевой) криз - самое частое проявление серповидноклеточной анемии. В основном поражаются кости и мышцы (подробнее - здесь).
Другие клинические программы направлены на терапию:
➡️ Сахарного диабета I типа (VCTX210, редактирует аллогенные клетки эндодермы поджелудочной железы - КИ 1 фазы);
➡️ B-клеточных лимфом (CTX110, CAR-T против CD19, КИ 1 фазы CARBON), множественной миеломы (CTX120 (почему-то отсутствует в пайплайне), CAR-T против BCMA, КИ 1 фазы), почечно-клеточного рака и лимфом (CTX130, CAR-T против CD70, 2 КИ 1 фазы).
📢 Во 2 половине 2022: подача заявки на маркетинг в EMA для Exa-cel (также ведутся переговоры с FDA), CTA (заявка на проведение КИ в Европе) для VCTX211 и IND (заявка на проведение КИ в США) для CTX112. В следующие 12-18 месяцев планируется переход к КИ программ in vivo редактирования.
Intellia Therapeutics
Cambridge, United States
Количество сотрудников: 485
Ведущие разработки: генная терапия in vivo для лечения редких наследственных заболеваний.
Последний апдейт: корпоративная презентация, август 2022.
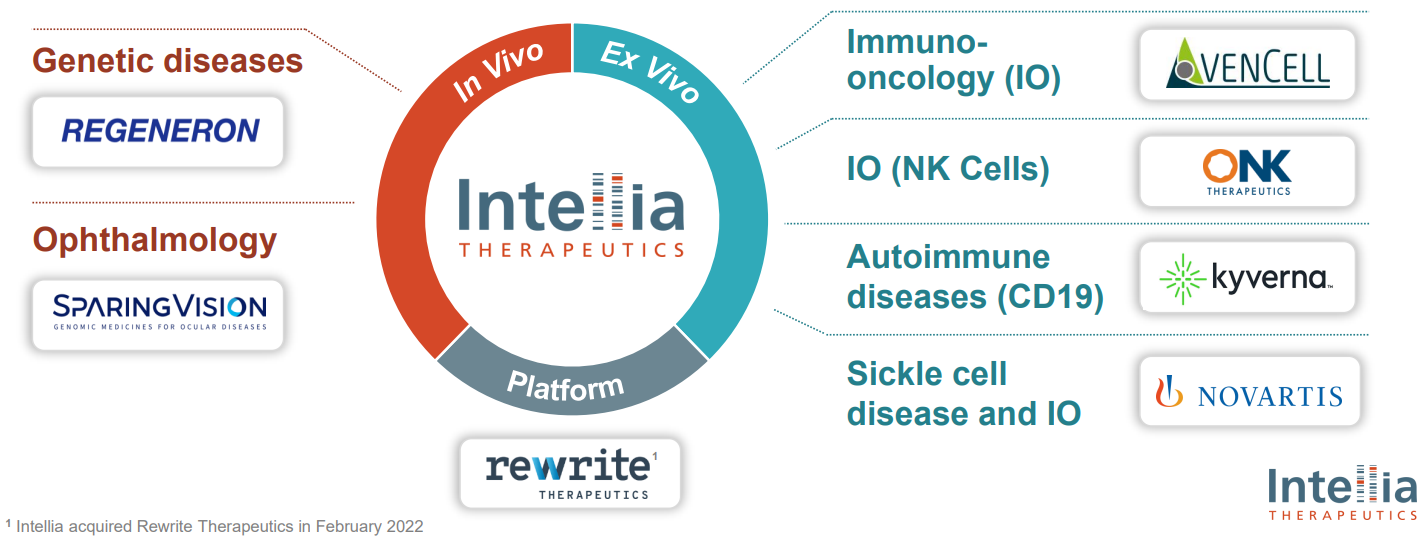
В Intellia изучают применение нуклеаз Spy, HiFi Spy, Nme2, редактирование оснований (C>T), вставку генов в ДНК. Для доставки используются AAV, запатентованные невирусные липидные наночастицы. Также исследуется возможность сохранения эффекта вставки в геном при редактирования клеток печени после частичного удаления печени вследствие регенерации ткани.
In vivo редактирование: 8 программ в области редких наследственных заболеваний накопления, гематологии, 2 из которых (2 кандидата) на клинической стадии. Генная терапия направлена как на "выключение", так и на вставку определенных генов и разрабатывается в сотрудничестве с Regeneron Pharmaceuticals (REGN). Для доставки используются липидные наночастицы.
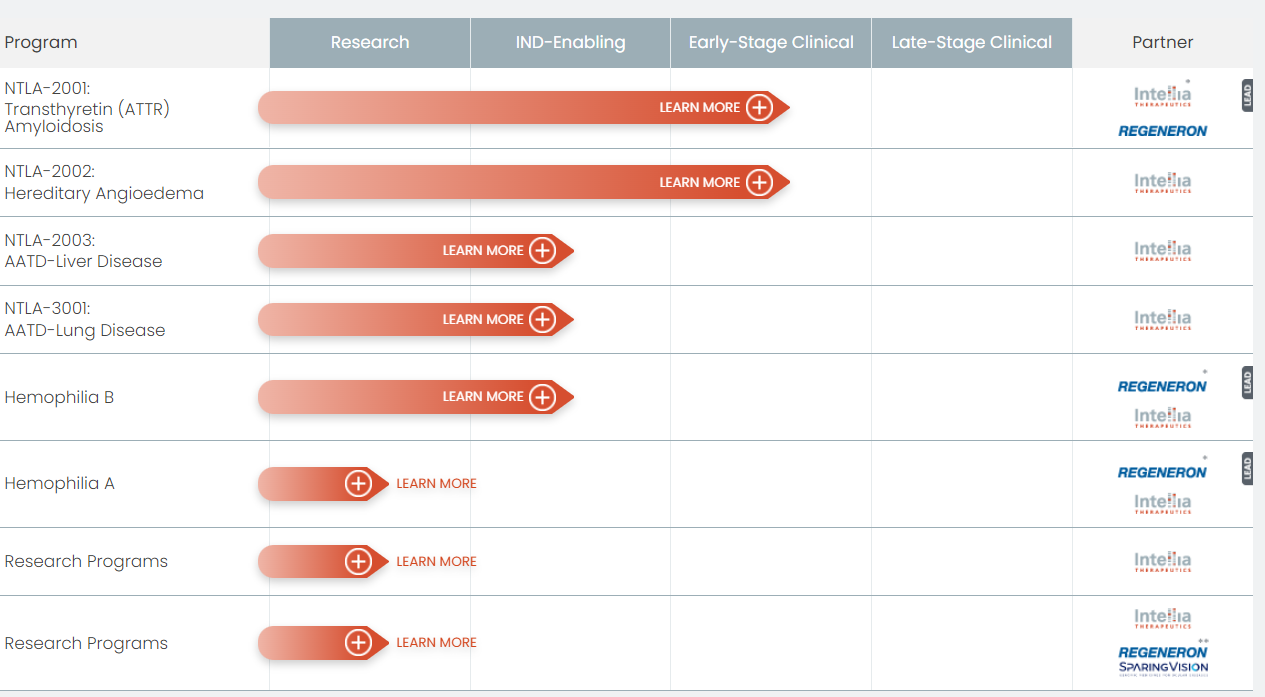
Ведущие разработки:
💊 NTLA-2001 нацелена на "выключение" гена TTR, мутации которого приводят к синтезу и накоплению неправильно свернутого белка TTR у пациентов с ATTR амилоидозом. Проходит КИ 1 фазы (2 когорты: с полинейропатией ATTRv-PN и кардиомиопатией ATTR-CM). Первые результаты опубликованы в New England Journal of Medicine, через 6 мес лечения в пресс-релизе 24 июня 2022.
Промежуточные результаты (когорта с полинейропатией):
- При введении наивысшей доза наблюдалось 93% снижение TTR сыворотки крови (6 мес. после лечения, 6 пациентов, 9 мес у 3 пациентов).
- Наиболее частыми нежелательными явлениями были головная боль, инфузионные реакции, боль в спине, сыпь и тошнота.
💊 NTLA-2002 - генная терапия для инактивации гена KLKB1, что может снизить активность калликреина, а значит и уменьшить высвобождение брадикинина, таким образом, предотвращая активацию эндотелиальных клеток и отек у пациентов с наследственным ангионевротическим отёком 1 и 2 типа. Проходит КИ 1/2 фазы.
Ex vivo редактирование: Разработка иммунотерапии (CAR T) с использованием липидных наночастиц, редактирования оснований (Base Editor), удалений (TCR) /вставок (CAR или TCR) в ДНК в 7 различных программах, которые ведутся в сотрудничестве с Novartis (NVS) и другими.
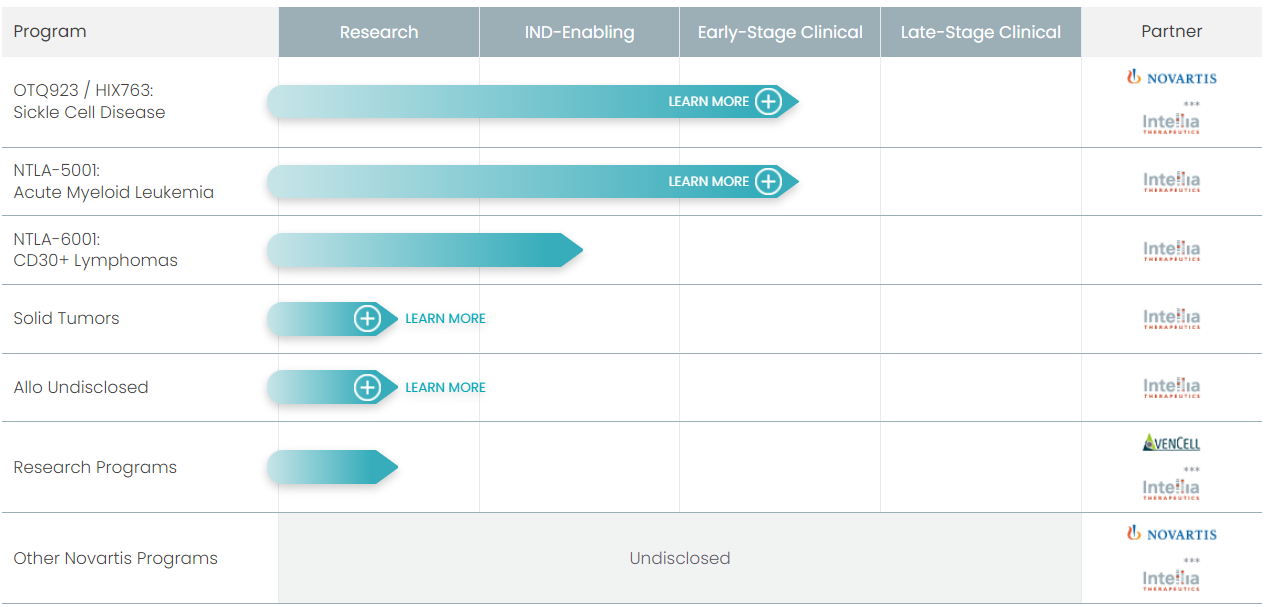
Ведущие разработки:
💊 OTQ923/HIX763 генная терапия серповидно-клеточной анемии, направленная на выключение гена BCL11A, что приводит к увеличению производства фетального гемоглобина (подробнее здесь). Проходит КИ 1/2 фазы.
💊 NTLA-5001 (аутогенные модифицированные клетки против WT1-TCR). Проходит КИ 1/2 фазы. Однако программа исследований была остановлена. Ведется разработка аллогенной версии - на доклинической стадии.
📢 Во 2 половине 2022: первые промежуточные данные пациентов с ATTR-амилоидозом и кардиомиопатией, получивших NTLA-2001; завершение набора пациентов в обе группы КИ 1 фазы NTLA-2001; промежуточные результаты применения NTLA-2002 в КИ 1/2 фазы (на симпозиуме 2022 Bradykinin Symposium, 15-16 сентября).
Graphite Bio
South San Francisco, United States
Количество сотрудников: 111
Ведущие разработки: генная терапия in vivo для лечения гемоглобинопатий.
Последний апдейт: отчет Q2 11 августа 2022.

Используют платформу UltraHDR™, которая позволяет добиваться гомологичной репарации после вырезания участки ДНК. Добавили к системе CRISPR/Cas9 копию участка ДНК, где целевой ген записан правильно, то есть поврежденный ген вырезается и замещается нормальным. Для доставки используется AAV6.
Ведущая разработка:
💊 Nula-cel (nulabeglogene autogedtemcel, GPH101) - для лечения серповидноклеточной анемии КИ 1/2 (CEDAR). 11 августа первый пациент получил терапию.
📢 В середине 2023: первые промежуточные данные КИ 1/2 (CEDAR).
Beam Therapeutics
Cambridge, United States
Количество сотрудников: 476
Ведущие разработки: генная терапия ex vivo для лечения гемоглобинопатий.
Последний апдейт: отчет Q2 9 августа 2022.
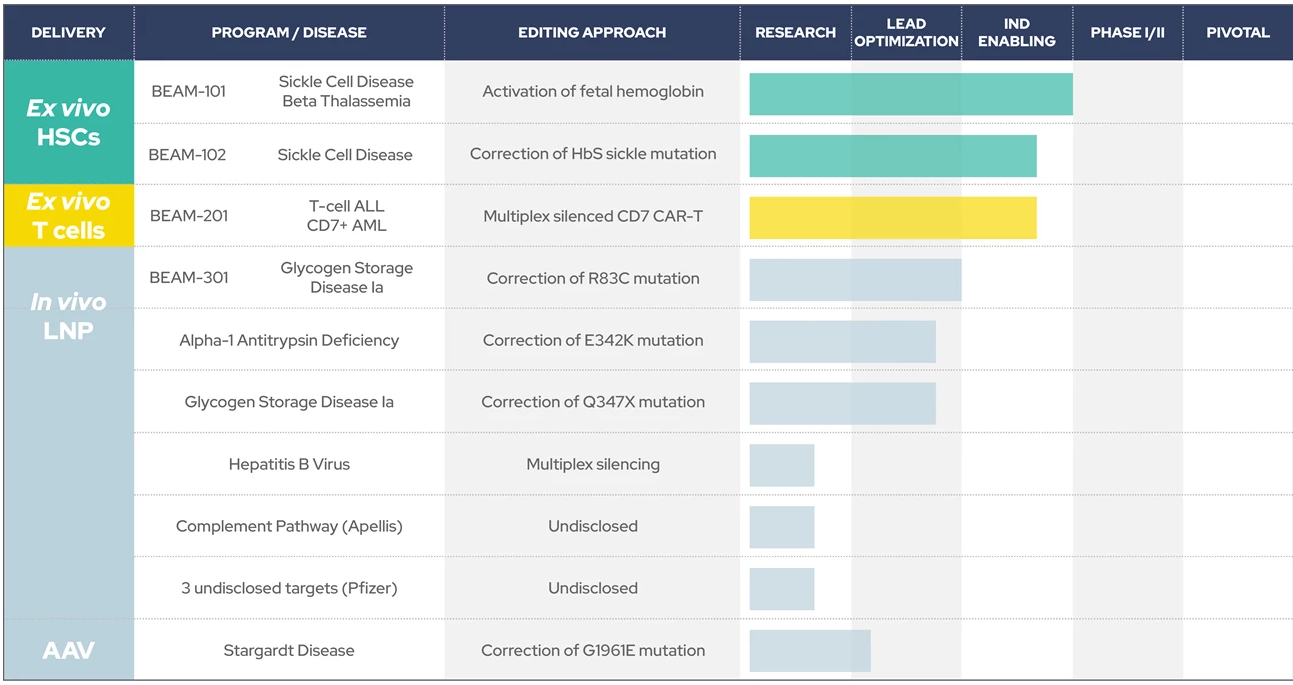
Используют технологию редактирования оснований (с помощью CRISPR и дезаминаз), Cas12b. Для доставки in vivo используют липидные наночастицы (LNP) и аденовирусный вектор (AVV), ex vivo редактирование - с примерением электропорации. Также компания занимается разработкой режимов кондиционирования для пациентов, перенесших трансплантацию гемопоэтических стволовых клеток (ESCAPE).
In vivo редактирование: подготовка более 5 программ, пока известно только об одном кандидате.
💊 BEAM-301 (замещает аденин в гене G6PC, мутации которого приводят к нарушению метаболизма глюкозы и развитию болезни Гирке - гликогеновая болезнь Iа типа) - исследования на доклинической стадии.
Ex vivo редактирование: 4 программы, одна на клинической стадии, для второй начало КИ - на удержании FDA, для третьей - планируется подача IND, для 4-ой - объявление кандидата в 2023. Ведущая разработка:
💊 BEAM-101 (точечное редактирование, которое приводит к увеличению синтеза фетального гемоглобина - HBF, вполне способного заменить функцию обычного HBA) изучается в качестве лечения серповидноклеточной анемии и бета-талассемии в КИ 1/2 фазы.
📢 Со дня на день: официальное клиническое письмо о задержке КИ BEAM-201. Во 2 половине 2022: начало набора пациентов в КИ 1/2 фазы BEAM-101; Подача IND для BEAM-301; начало исследований, которые лягут в основу IND для BEAM-301.
Также 18-22 сентября на конференции 2022 International HBV Meeting, Beam Therapeutics представит доклинические результаты мультиплексного редактирования оснований для лечения гепатита В (подавление репликации вируса гепатита В и снижение экспрессии HBsAg in vitro и in vivo.).
____________________________
НЯ - нежелательные явления
СНЯ - серьезные нежелательные явления
Написанное здесь не является инвестиционной рекомендацией. Это живой обзор, он будет периодически обновляться.
Последнее обновление: 4 сентября 2022.