«Троянский конь» НАТО стоит за реагированием Европы на COVID-19 – Часть 1: Вакцинация Европы с помощью военной экспериментальной контрмеры биозащиты. #2
ПУТЬ К СВОБОДЕВакцины: следуйте за деньгами
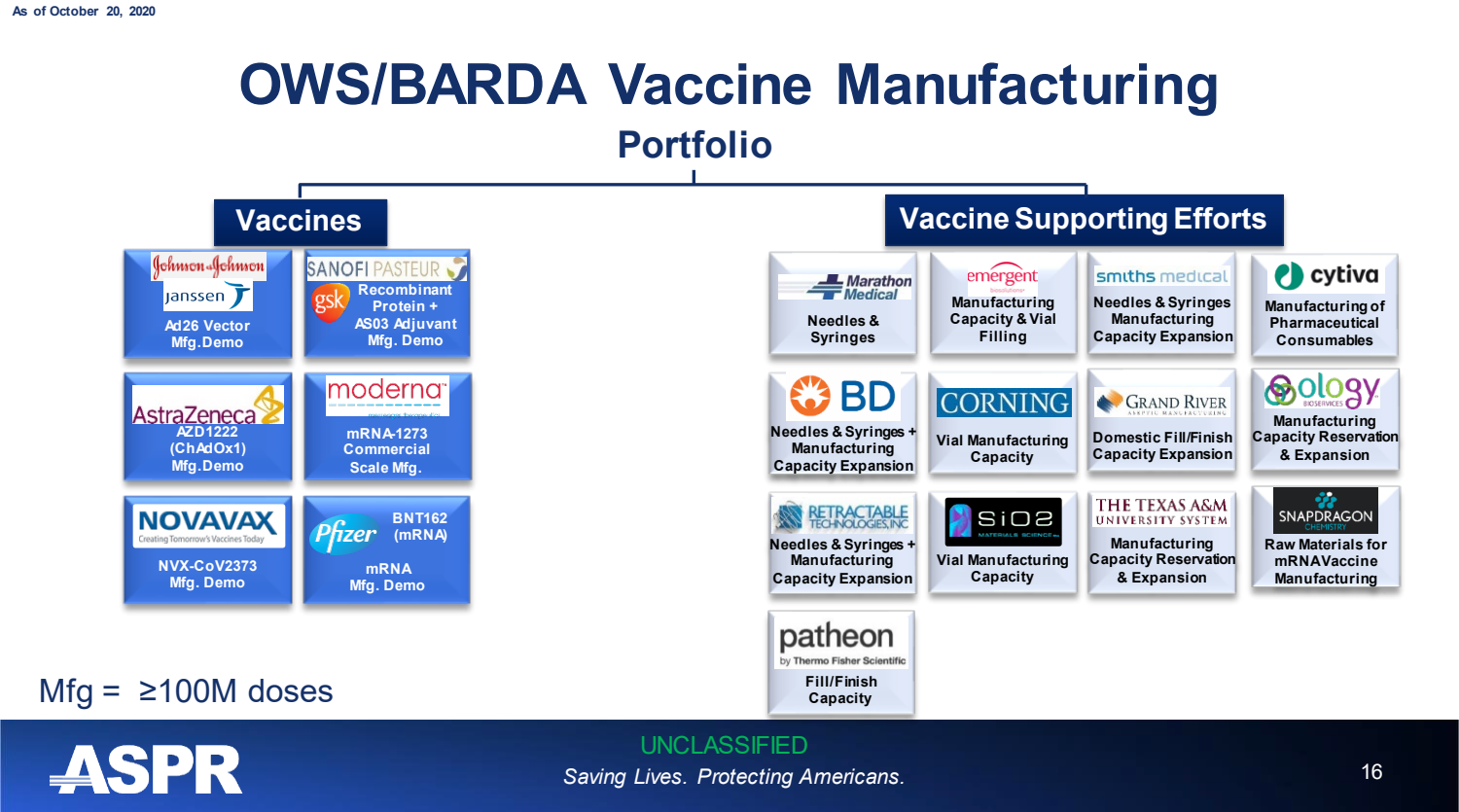
В конечном итоге BioPort изменила свое название на Emergent BioSolutions и гораздо позже заключила контракт на производство новых вакцин против COVID-19, что было подтверждено Консультативным комитетом по вакцинам и сопутствующим биологическим продуктам 22 октября 2020 г., презентация на заседании ASPR .
Если вас интересуют подробности, посетите серию расследований Уитни Уэбб и Рауля Диего «Инженерное заражение», которая, безусловно, утолит вашу жажду и, вероятно, убедит вас в том, что действительно все дороги ведут обратно к инициативе «Темная зима» .[▶️перевод здесь]
Также приглашаю вас прочитать статью Спартака «Биозащитная мафия» , а также посмотреть его последнее видео здесь . [▶️перевод здесь]
Не всем нравится часами выявлять законы, правила и протоколы, применимые к правительствам, регулирующим органам и крупной фармацевтике, но если мы хотим добраться до сути этой беспрецедентной атаки на население мира, мы должны, по крайней мере, понять ее основу рукотворной «программы истребления», прикрытой маской «глобальной пандемии».
Корни этих программ биологической защиты можно проследить до 1969 года, когда США приняли закон 50 глава 32 Кодекса США, чтобы установить программы химического и биологического оружия, тщательно разработанные, чтобы обмануть общественность, притворяясь, что такие программы носят защитный, профилактический и оборонительный характер. К сожалению, когда дело доходит до экспериментальной «вакцины» от Covid-19, это далеко не так.
Юридический путь, заимствованный этими программами биозащиты и их архитекторами, сложен, и понимание того, как они возникли, и необходимой правовой базы для их воплощения в жизнь — само по себе является мозговым штурмом. Но, к счастью, мы были одарены работой профессионального помощника юриста Кэтрин Уотт , которая умело сумела объяснить это для всех нас. Вы можете найти ее работу в подстеке новостей Бейливика. Вот также ссылка на ее презентацию «Kill Box». (На канале есть, можно найти по тегу #Кэтрин_Уотт).
24 января 2023 года Кэтрин Уотт была участницей пресс-конференции, на которой обсуждалось продолжающееся развертывание биологического оружия в чрезвычайных ситуациях, позиционируемого как вакцины против Covid, и вот выдержка из ее презентации (источник)
Все, что Кэтрин только что упомянула в этом видео, сводится к одному генеральному плану, работе олигархического государственно-частного партнерства (ВЭФ в Давосе), стремящегося навязать свое видение населению мира под эгидой их собственного нового мирового порядка. Далеко от заботы о вашей безопасности или вашего благополучия, эти правительственные программы «биологической защиты» изобилуют засекреченными и несекретными программами наблюдения, тестирования, принуждения, содержания под стражей и карантина — все они выступают за отмену ваших универсальных прав человека, таких как как информированное согласие, автономия тела и ваша свобода передвижения.
Довольно страшно видеть, сколько людей в этом преступном государственном партнерстве были и до сих пор более чем счастливы (если не сказать взволнованы) порабощением остальных из нас. Тем не менее, мы все еще здесь, живы и здоровы, и готовы продвигаться вперед, чтобы открыть истинную природу зверя и установить, как много было сделано, чтобы привести многих в состояние кататонической податливости.
Я предлагаю теперь уделить время обзору процесса, который был начат в Европейском союзе, чтобы замаскировать очевидное намерение, стоящее за этой пандемией , и посмотреть, что на самом деле потребовалось для того, чтобы это оружие с синтетической биологией ( SBEW ) достигло рук граждан ЕС. Далее в этой статье мы коснемся темы синтетической биологии и того, как она способствует разработке биологического оружия.
Процедура, используемая ЕС для утверждения вакцин против COVID-19, также известная как «медицинские контрмеры»:
Медицинский продукт для использования человеком может быть разрешен в ЕС в соответствии с Директивой 2001/83/EC19 и Регламентом 726/200420 либо Комиссией ЕС после положительного заключения EMA в рамках централизованной процедуры, либо компетентными национальными органами в соответствии с национальными процедурами. Для лекарственных препаратов для человека, содержащих вновь созданное действующее вещество, требуется централизованный метод. Большинство непатентованных лекарств оцениваются и утверждаются на национальном уровне, но большинство оригинальных инновационных лекарств, включая вакцины, подлежат централизованной системе авторизации.
Единая заявка на получение разрешения на продажу с подробным описанием безопасности, эффективности и качества вакцины должна быть подана в Европейское агентство по лекарственным средствам (EMA) в рамках централизованного процесса – каждым разработчиком вакцины, который хочет коммерциализировать вакцину в ЕС. В процессе оценки EMA участвуют три специализированных комитета:
- Комитет по оценке рисков фармаконадзора оценивает безопасность вакцины.
- Рабочая группа по биологическим препаратам проверяет ее качество.
- Комитет EMA по лекарственным препаратам для человека ( CHMP ), в который входят представители всех государств-членов, выдает окончательную рекомендацию Комиссии ЕС, если данные показывают, что польза от вакцинации больше, чем любая другая. риски от вакцины.
Процесс:
В течение 210 дней после получения действительной заявки CHMP выносит свое заключение. Следуя положительной рекомендации CHMP, Комиссия проверяет действительность каждого компонента, подтверждающего регистрационное удостоверение. Они охватывают следующее: научное обоснование, сведения о продукте, информацию для экспертов в области здравоохранения, маркировку и рекомендации по использованию вакцин. Через процедуру комитологии Комиссия связывается со странами-членами ЕС, которые отвечают за внутренний маркетинг и использование вакцины, прежде чем разрешить ее.
Условное регистрационное удостоверение (CMA) вступает в силу после его выдачи во всех государствах-членах. EMA и государство-член следят за безопасностью вакцины после того, как она будет разрешена к использованию, и принимают меры, если новая информация свидетельствует о том, что она уже не так безопасна и эффективна, как раньше.
Был ли процесс разработки и утверждения вакцин против Covid-19 ускорен из-за безотлагательности ситуации и необходимости найти решение, чтобы остановить распространение Covid-19, или процесс был фактически ускорен, из-за использования эффекта паники и искусственного отвлечения внимания нашими средствами массовой информации и органами здравоохранения, чтобы ускорить развертывание этих американских средств биологической "защиты" на территории Европы?
Обычный процесс разработки вакцин был сокращен, различные этапы их разработки объединены, что сделало возможным только ускорение производственного процесса. EMA приступило к оценке вакцины до того, как были завершены регулярные лабораторные проверки, а клинические испытания начались до завершения исследований in vitro и in vivo. Некоторые производители начали производить свои вакцины до получения разрешения на продажу в ЕС. В результате прививки стали доступными для использования и распространялись по всему ЕС до завершения обычного процесса их разработки.
Что касается процесса утверждения, ряд соглашений позволил Комиссии ЕС принять решение быстрее, что привело к одобрению первой вакцины, такой как Контрмера Comirnaty, созданная BioNTech и Pfizer, всего через девять месяцев после объявления пандемии.
Во-первых, Комиссия и государства-члены решили активировать процедуру условного разрешения на продажу (CMA), чтобы ускорить утверждение вакцин против Covid-19 в соответствии со статьей 14 (7) Регламента 726/2004 и условиями Регламента 507/2006. . Это соответствует положениям статьи 21 Регламента 1234/2008 и позволяют Комиссии принять изменение условий регистрационного удостоверения на вакцину против гриппа человека в случаях, когда некоторые неклинические или клинические данные отсутствуют в исключительном порядке и на временной основе во время пандемии. В рамках CMA регистрационное удостоверение выдается на основе менее обширных клинических данных, чем обычно необходимо, когда преимущества быстрой доступности лекарства перевешивают риски, связанные с необходимостью дополнительных доказательств, что, естественно, подвергает риску всех, кто прибегает к процедуре.
Чтобы ускорить оформление во время чрезвычайных ситуаций в области общественного здравоохранения, CMA используется в качестве механизма ускоренной авторизации.
1 декабря 2020 года и Pfizer , и BioNTech подали в EMA заявку на получение условного регистрационного удостоверения (CMA) вакцины против COVID-19, тем временем Европейская комиссия предлагала правила, которые могли бы дать ЕС право объявить «чрезвычайную ситуацию в общественном здравоохранении», которая была необходима, чтобы оправдать ускорение получения разрешений CMA
CMA может быть получен в соответствии со статьей 4 Регламента 507/2006 , если Комитет EMA по лекарственным средствам для человека установит, что все следующие условия были выполнены, несмотря на отсутствие полных клинических данных, касающихся безопасности и эффективности лекарственного средства:
(а) Медицинские изделия имеют благоприятное соотношение риска и пользы
(b) вероятность того, что заявитель сможет предоставить подробные клинические данные, является благоприятной;
c) препарат позволит удовлетворить неудовлетворенные медицинские потребности; и
(d) Быстрая доступность соответствующего фармацевтического продукта на рынке выгодна для общественного здравоохранения и перевешивает риск, связанный с потребностью в дополнительной информации.
В разделе «принимая во внимание» (4) говорится:
Если выдается условное регистрационное удостоверение (CMA), оно должно быть ограничено ситуациями, когда только клиническая часть досье заявки менее полна, чем обычно. Неполные доклинические или фармацевтические данные должны приниматься только в случае использования продукта в чрезвычайных ситуациях, в ответ на угрозу общественному здоровью.
Это объясняет, почему в ноябре 2020 года Европейская комиссия отчаянно пыталась установить правила, позволяющие ЕС объявлять чрезвычайную ситуацию в области общественного здравоохранения в случае будущих вспышек независимо от Всемирной организации здравоохранения (ВОЗ). Для этой Урсулы Ван дер Ляйен, президента Европейской комиссии, уже было несколько козырей в рукаве, как у доброго волшебника. Исчезновение ее SMS-разговоров с генеральным директором Pfizer Альбертом Бурлой было всего лишь разминкой, «Клятва» перед «Поворотом» и, наконец, «Престиж» — с объявлением в сентябре 2020 года о запуске совершенно нового агентства ЕС под названием «Управление по обеспечению готовности к чрезвычайным ситуациям в области здравоохранения» ( HERA ), ключевой столп их проекта, Европейского союза здравоохранения, который будет отражать — Управление перспективных биомедицинских исследований и разработок США ( BARDA). Это де-факто слияние трансатлантического биозащитного пространства. Действительно, New York Times подала в суд на ЕС из-за отсутствия текстовых сообщений Урсулы фон дер Ляйен - Pfizer, но что нас действительно интересует, так это полное содержание Соглашения о предварительных закупках (APA) между компаниями, производящими вакцины, и Европейской комиссией, а также тридцать страниц из этих контрактов, которые до сих пор остаются отредактированными.
Ясно, что это сокрытие на самом высоком уровне – как минимум трехсторонний сговор между транснациональным фармацевтическим и биомедицинским промышленным комплексом, правительствами США и ЕС. В худшем случае мы наблюдаем рождение глобального фашистского картеля частно-государственного партнерства.
Но есть еще…
17 февраля 2021 года Европейская комиссия запустила свой новый план «готовности к биологической защите», призванный повысить готовность Европы к надвигающейся угрозе новых штаммов коронавируса, который включает в себя шаги по ускорению разработки будущих «вариантных» вакцин — концепция, активно продвигаемая Биллом Гейтсом и другими ключевыми игроками.
План, известный как «Инкубатор HERA», был обнародован Комиссией, объясняя, как HERA будет работать с исследователями, биотехнологическими компаниями, производителями и государственными органами в ЕС и во всем мире для обнаружения и предотвращения распространения новых вариантов», читать это в статье ЕВРАКТИВ.
Затем Европейская комиссия запускает инкубатор HERA в среду, 17 февраля 2021 года.

Публичные онлайн-консультации с Управлением по обеспечению готовности и реагированию на чрезвычайные ситуации в области здравоохранения (HERA) проводились с 31 марта 2020 года, всего за два месяца до того, как Генеральный директор ВОЗ д-р Тедрос Гебрейесус объявил «новый» SARS COV2 «чрезвычайной ситуацией в области общественного здравоохранения», в «международном концерне» (PHEIC).
Будут ли наблюдательные организации ЕС расследовать эти общественные консультации по HERA и устанавливать, когда этот план был фактически составлен? Это было до или после заявления доктора Тедроса?
Ноябрь 2020 года был также месяцем, когда Гвидо Раси , глава EMA, внезапно ушел в отставку, передав управление EMA гражданину Ирландии Эмеру Куку по странной процедурной формальности. Совпадение?
В США министр здравоохранения HHS Алекс Азар (профессиональный инсайдер и руководитель Big Pharma) должен был объявить «чрезвычайную ситуацию в области общественного здравоохранения», чтобы инициировать «разрешение на экстренное использование» FDA и BARDA, эффективный карт-бланш на реализацию любых продуктов и политик. Однако в Европе заявление ВОЗ было достаточно, чтобы позволить Европейскому агентству по лекарственным средствам (EMA) регулировать «контрмеры» биологической защиты Министерства обороны США и их быстрое развертывание (без надзора) на территории Европы в соответствии с правилами и рекомендациями, применимыми в условиях «чрезвычайной ситуации в области общественного здравоохранения», что имело в последствие воздействие на всех граждан ЕС явно недоказанного, небезопасного, неэффективного и плохо изготовленного продукта, который мошенническим образом продается правительствам как «безопасные и эффективные» фармацевтические и медицинские продукты, ложно маркированные как «вакцины», поскольку они не обеспечивают иммунитет от любого патогена, и просто «уменьшают легкие симптомы болезни», поэтому они не могут быть помечены как вакцины, а скорее как фармацевтические методы лечения. 21 декабря 2020 года Европейская комиссия предоставила CMA «вакцине» от COVID-19, разработанной BioNTech и Pfizer, что сделало ее первой вакциной против COVID-19, разрешенной в ЕС. Это разрешение последовало за положительной научной рекомендацией, основанной на оценке безопасности , эффективности и качества так называемой вакцины Европейским агентством по лекарственным средствам (EMA), и впоследствии было одобрено государствами-членами ЕС. Никаких вопросов не было задано. В конце концов, это должно было быть «чрезвычайной ситуацией в области общественного здравоохранения».
Но в тумане биологической войны эта операция под руководством Министерства обороны заботится не о ярлыках, потому что все попадает под неприступный щит военного «медицинского противодействия». И в этом заключается проблема. Принято считать, что новая вакцина-кандидат должна быть оценена на предмет «безопасности, иммуногенности и защитной эффективности» у людей, прежде чем она будет лицензирована для использования и высвобождена среди населения, но здесь мы увидели, что Европейская комиссия (не EMA) предоставила Условное регистрационное удостоверение (CMA) для вакцины Comirnaty mRNA против COVID 19, разработанной BioNTech/Pfizer (вместе с Министерством обороны США) без тщательного тестирования на иммуногенность, что необходимо для установления способности молекулы или вещества, содержащегося в прививке, вызывать так называемый «иммунный ответ» (или токсическая реакция, в зависимости от того, как вы смотрите на науку), но также и силу и величину иммунного ответа, который может повлиять на профиль безопасности этих так называемых «вакцин», а также их способность останавливать передачу (особенно когда исходные данные выявляли отсутствие целостности этих экспериментальных инъекций мРНК).