Обзор базовых аспектов гормонотерапии
Григорий Чиж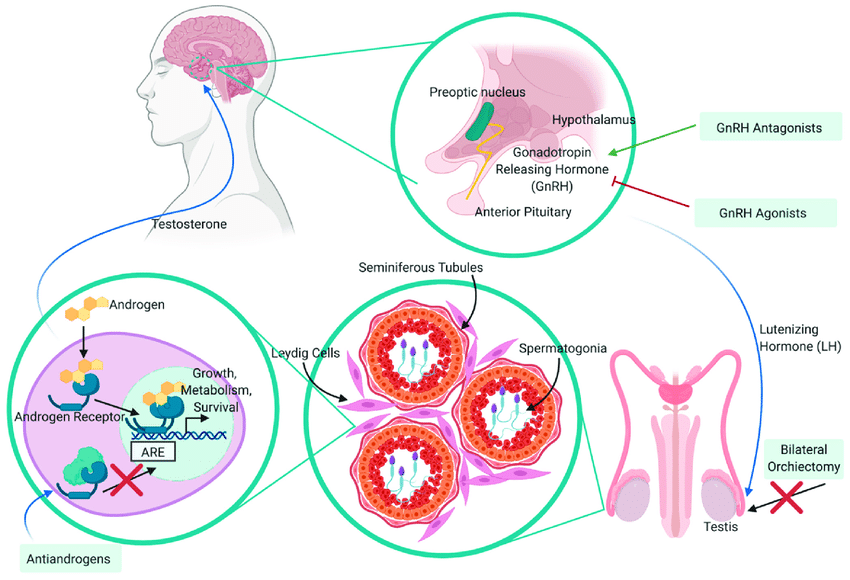
Как работает гормонотерапия при раке предстательной железы. Ранее мы рассмотрели, как андрогены способствуют прогрессированию рака предстательной железы и констатировали, что андрогеновый сигналинг - пока единственная мишень в сложном патогенезе РПЖ, на которую мы можем эффективно воздействовать Это сделало андроген - депривационную терапию фундаментом лечения распространенного РПЖ. Давайте же поговорим о том, что такое андроген - депривационная терапия и с чем ее сочетают.
Чтобы лишить опухоль андрогенов как источника выживания, используются несколько групп препаратов:
- агонисты и антагонисты гонадотропных рилизинг - гормонов. Они же - альтернатива орхэктомии
- ингибиторы синтеза андрогенов (абиратерон)
- блокаторы андрогеновых рецепторов (энзалутамид. апалутамид, даролутамид)
Как мы пришли к терапии агонистами ГнРГ. Роль андрогенов в патогенезе РПЖ стала очевидной достаточно давно. Поскольку основным источником андрогенов (тестостерона) выступают яички, мысль о билатеральной орхиэктомии, пришедшая в голову еще лет сто назад, была весьма логичной. При всей суровости подобной операции, она позволяла добиться облегчения картины метастатического заболевания - а оно часто сопряжено с поражением скелета и связанным с ним болевым синдромом. Ничего приятного в этом нет.
Однако, к середине прошлого века стало понятно, что есть менее инвазивные способы андрогенной депривации. Насколько мне известно, первоначально медикаментозная андрогенная депривация осуществлялась стильбоэстролом: он весьма успешно подавлял выработку в гипоталамусе ГнРГ (гонадотропного рилизинг - гормона), что лишало гонадотропные клетки гипофиза стимула к секреции лютеинизирующего гормона. А отсутствие секреции ЛГ, в конечном итоге, приводило к снижению выработки тестостерона в яичках. Вот вам и андрогенная депривация.

Но через какое - то время от начала активного использования стильбэстрола, наши коллеги стали замечать, что пациенты стали умирать от сердечно - сосудистых катастроф - тромбозов, тромбоэмболий…Понадобилось время, чтобы увязать их возникновение с терапией стильбэстролом и прийти к мысли о необходимости снижения дозы с 3 мг до 1 мг. Но уменьшенная доза не давала достаточного снижения концентрации тестостерона, что создавало весьма неприятную ситуацию: либо ты рискуешь умереть от сердечно - сосудистых катастроф, либо от рака предстательной железы - причем в ближайшее время.
В 1980 - х годах мир пришел к идее применения агонистов секреции ГнРГ. И зная физиологию гипоталамо - гипофизарно - тестикулярной оси, применение агонистов может показаться нелогичным. “Зачем стимулировать гипофиз к выработке ЛГ? Вы что, больные совсем? Такой финт ушами приведет к пиковому выбросу ЛГ, а за ним - тестостерона и все, здравствуй прогрессирование”
Постоянное воздействие на клетки гипоталамуса агонистов ГнРГ (первым из них стал лейпролид), действительно приводит к стимуляции гонадотропных клеток гипофиза к секреции ЛГ. Однако, после длительной стимуляции указанных клеток, наступает десенситизация.
Она выражается в том, что клетки гипофиза становятся настолько измученными от их постоянной стимуляции, что восклицают гипоталамусу “да пошел ты нахрен”, и перестают реагировать на его стимулы в виде гонадотропных рилизинг - гормонов. Считается, что путем миграции рецепторов к ГнРГ с мембраны внутрь клетки, как показано на картинке выше.
И, о чудо, выработка ЛГ снижается, а за ним падает и тестостерон. Причем до настолько низких значений, что достигается контроль над аденокарциномой простаты - и какое то время пациенты живут без прогрессирования заболевания, да и в целом живут дольше.
Сейчас существует множество препаратов - агонистов ГнРГ: гозерелин, трипторелин, лейпрорелин… их эффективность с точки зрения выживаемости пациентов, между нами говоря, плюс - минус одинаковая. Во всяком случае, обратного пока никто не доказал - прямых сравнений толком и не было.
Терапия агонистами ГнРГ технически осуществляется достаточно просто: раз в 28 (либо в 3 или 6 месяцев, в зависимости от дозы препарата), пациенту подкожно вводится один из указанных препаратов. В течение следующих пары недель достигается постепенное снижение уровня тестостерона до кастрационных значений. Далее введение препарата повторяется через 28, 90 или 180 дней, опять же, в зависимости от того, сколько ввели в прошлый раз. Такая техническая простота, наряду с эффективностью андроген депривационной терапии (АДТ) сделали ее фундаментов лекарственной терапии распространенного (и не очень) рака предстательной железы. Но есть пара нюансов.
Нюанс 1. “Андрогеновая вспышка “. В первые часы и дни от первого введения агониста ГнРГ действительно наблюдается пик ЛГ - чрезмерная стимуляция гипофиза приводит к такой же чрезмерной секреции ЛГ, а за ним - и резкого роста концентрации тестостерона.
Если ничего с этим не сделать, первые пару недель после введения препарата, будут для пациента мучительными - будет усиливаться выраженность абсолютно всех симптомов, которые связаны с опухолевым поражением - боль в костях, дизурия и т.д. Не говоря уже о риске потенциально жизнеугрожающих осложнений - описаны случаи компрессии спинного мозга, острой задержки мочи, лимфедемы и даже внезапной смерти.
Решение: в первые 2 - 3 недели от первого в жизни пациента введения агонистов ГнРГ необходимо дополнительно заставить его пить антиандрогены. Например, бикалутамид 50 мг/сут. Но это в случае, если пациент, кроме АДТ, не будет получать тот же энзалутамид или даролутамид - в рамках комбинированной терапии 1 линии. Если же принимается решение о комбинации АДТ и антиандрогенов, то проблем с вспышками обычно не возникает (об этом ниже).
Нюанс 2. Яички - не единственный источник тестостерона. До 5 % от общего пула андрогенов образуется в надпочечниках:
А значит, одной АДТ может быть недостаточно. И тут мы плавно переходим к другим вариантам гормонотерапии, которыми сегодня часто дополняют проводимую андроген - депривационной блокаду агонистами ГНрг.
Ингибиторы синтеза андрогенов. Если андрогенов в организме минимум, то опухоль ими не подпитывается, не растет, если повезет - еще и уменьшается. Именно в этом смысл применения абиратерона - ингибитор 17 а - гидроксилазы и С17, 20 - лиазы
Абиратерон справляется с задачей андрогенной блокады просто и радикально - нет андрогенов - нет проблем. Поговорим о том, что происходит при терапии абиратероном.
На картинке выше представлена схема синтеза гормонов коры надпочечников. Сколько бы я не пытался выучить эту ублюдскую схему, сделать это раз и навсегда у меня не получилось - я постоянно к ней возвращаюсь. Что мы видим на этой схеме?
Preg a.k.a. прегненолон - предшественник всех видов надпочечниковых стероидов. Чтобы стать тестостероном, ему нужно пройти длинный путь 17 а - гидроксилаза - зависимого превращения в 17 - ОН - прегненолон и С17,20 -лиаза - зависимого превращения в дигидроандростендион (DHEA). Далее он плавно превращается в тестостерон, как показано на схеме.
Ключевыми ферментами превращения прегненолона в тестостерон выступают 17 а-гидроксилаза (та, что присобачивает ОН - группу к прегненолону). и С17,20 - лиаза. Именно иx блокирует абиратерон.
Проблема поджидает нас в том, что 17а - гидроксилаза необходима для синтеза кортизола - глюкокортикостероидов. Их синтез будет страдать при терапии абиратероном, и здесь реализуется важная цепь патофизиологических нарушений терапии абиратероном:
- концентрация кортизола в крови падает
- гипоталамус впадает в истерику, расценивая эту ситуацию как “этому ублюдку уже мало того количества АКТГ, который выбрасывает гипофиз!!1! Ну что ж, заставлю гипофиз выбрасывать еще больше АКТГ!!
- гипоталамус, с помощью своих рилизинг - факторов побуждает гипофиз к продукции АКТГ, и его становится чрезвычайно много
- АКТГ стимулирует кору надпочечников, только к восстановлению нормального синтеза кортизола (в условиях терапии абиратероном) это не приводит.
Нюанс 3. 17а - гидроксилаза не нужна для синтеза минералокортикоидов. С учетом этого, весь прегненолон превращается в альдостерон. Тут самое время вспомнить о его физиологических эффектах:
Сам АКТГ обычно принимает мало участия в регуляции синтеза альдостерона. Однако, постоянная стимуляция коры надпочечников приводит к большей интенсивности утилизации прегненолона и попыток превратить его в кортизол. Но в условиях терапии абиратероном это оказывается невозможно. И весь прегненолон утилизируется для образования альдостерона (см. закон действующих масс). Результат - гиперальдостеронизм:
- гипокалиемия
- задержка жидкости (гипернатриемия)
- и связанные с ними отеки, рост артериального давления
С учетом частой соматической отягощенности пациентов с РПЖ (как говорил один из моих первых преподавателей в университете “с возрастом мужчина становится только богаче. В отношении болячек”), терапия абиратероном может доставить ряд проблем. Если только…
Решение. Во избежание надпочечниковой недостаточности, абиратерон строго настрого принимается вместе с низкими дозами преднизолона ~ 5 мг/сут - это позволяет поддерживать оптимальную концентрацию ГКС в организме и снижать выраженность истерики гипофиза и уровни АКТГ - его элевация ни к чему.
Усилить андроген - депривационную блокаду можно не только блокадой синтеза андрогенов. Можно пойти другим путем - и заблокировать рецепторы к андрогенам - что будет дополнительно усиливать эффект АДТ.
Ингибиторы рецепторов к андрогенам. Арсенал препаратов достаточно широкий - есть уже пару поколений антиандрогенов. В настоящее время же допустимо применение нескольких вариантов комбинированной терапии с применением AR - ингибиторов:
- энзалутамид
- апалутамид
- даролутамид (пока только в сочетании с доцетакселом)
Механизм действия до смешного прост
Но при этом, чрезвычайно важно иметь возможность воздействовать непосредственно на андрогеновые рецепторы.
В очередной раз напомню, что мы имеем дело с живой материей, стремящейся всеми силами выжить в нашем организме, и рак предстательной железы - не исключение.
Часть причин резистентности к АДТ связаны с нарушениями структуры гена AR (мутации, амплификации и прочая дрянь), которые делают изолированную терапию АДТ, либо в сочетании с тем или иным вариантом антиандрогенной терапии неэффективной:
Некоторые примеры мутаций к конкретным вариантам терапии:
В ряде случаев мы сталкиваемся с конститутивной (постоянной, тестостерон - независимой экспрессией AR - сигналинга). В этой ситуации блокаторы AR - рецепторов могут быть отличным решением, о чем свидетельствует существующий эвиденс. Но эвиденс - предмет следующей части.