Обзор: Xencor (Live)
Долгорукова Антонина, https://t.me/long_handsXencor (NASDAQ: XNCR)
Терапевтическая область: онкология
Капитализация (11.05.22): $1.46 млрд, кэш: $683.6 млн, обязательства: $94,9 млн
На 31 декабря 2021 (за 2021 год):
- траты на R&D: $192.5 млн,
- чистая прибыль: $82.6 млн,
Выручка $275.1 млн (+124.2% г/г)
Сотрудники (10.05.22): 254
Год основания: 1997
____________________________
🧲 Фокус компании: Разработка антител для лечения рака и аутоиммунных заболеваний. Xencor имеет запатентованную платформу для синтеза антител XmAb, с помощью которой выполняются различные модификации Fc-домена. Это позволяют усилить активность и стабильность антител, а также увеличить период их полувыведения.
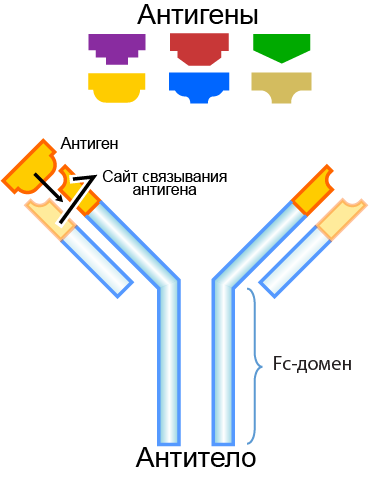
📖 Антитела - это особые белки, имеющие Y-образную форму и довольно сложное строение. Они вырабатываются клетками иммунной системы (B-лимфоцитами) для нейтрализации чужеродных веществ - патогенов (бактерий, грибов, паразитов, вирусов и др.). Для каждого патогена синтезируется армия антител-клонов, способных распознавать уникальный элемент этого патогена - антиген. Связываясь с антигенами на поверхности патогенов, антитела могут либо непосредственно нейтрализовать их, либо привлекать другие компоненты иммунной системы.
Модификации, которые позволяет платформа XmAb:
➡️ Биспецифичные антитела - это антитела, способные связываться с двумя мишенями, например, с раковой клеткой и иммунной Т-клеткой с противоопухолевой активностью.
✔️ Биспецифичные антитела составляют основу пайплайна Xencor, а некоторые были отданы на разработку другим, например, AMG 509 (Amgen) - связывается с рецептором STEAP1 на опухолевых клетках при раке простаты и комплексом CD3 на Т-клетках (способствует стабилизации ТCR-рецептора лимфоцитов, который в свою очередь ответственен за распознавание антигенов); сейчас проходит 1 фазу в качестве лечения метастатического резистентного к кастрации рака предстательной железы).
➡️ Антитела с увеличенным сродством Fc-домена к рецептору FcγRIIb (CD32b) на В-клетках. Это в конечном счете препятствует активации иммунных путей, играющих важную роль в аутоиммунных, аллергических и воспалительных заболеваниях.
✔️ Технология, позволяющая такую модификацию Fc-домена, используется в двух препаратах-кандидатах, разрабатываемых партнерами: обекселимаб (XmAb5871) и AIMab7195 (XmAb7195), лицензию на разработку и коммерциализацию которых компания Xencor предоставила Zenas BioPharma и Aimmune Therapeutics, соответственно.
➡️ Модификация домена Fc, которая позволяет увеличить его сродство (афинность, способность связываться) с рецептором FcγRIIIa на иммунных NK-клетках (натуральных киллерах), что значительно усиливает их способность уничтожать опухолевые клетки (антителозависимую клеточную цитотоксичность) и с рецептором FcγRIIa на других клетках, например, макрофагах, что может усиливать противоопухолевый иммунный ответ.
✔️ Технология, позволяющая такую модификацию Fc-домена, используется в двух партнерских препаратах, проходящих КИ, и в одном одобренном к применению лекарстве - тафаситамабе (tafasitamab, Monjuvi®) компаний Incyte и MorphoSys.
➡️ Использование Xtend™ технологии - позволяет увеличить сродство Fc-домена (афинность) с рецептором FcRn на лизосомах эндотелиальных клеток, выстилающих сосуды, что защищает антитела Xencor от разрушения. Антитела, произведенные с использованием технологии Xtend™ обладают периодом полураспада от нескольких дней до недель, а значит вводить их нужно реже (стоимость лечения ниже). Более длительный период полувыведения также позволяет подкожное введение препарата (обычно антитела вводят внутривенно).
✔️ Технология Xtend™ в настоящее время используется в 13 препаратах, проходящих КИ и в двух одобренных к применению лекарствах: равулизумаб (ravulizumab-cwvz, Ultomiris®) компании Alexion и сотровимаб (sotrovimab, Xevudy®) Vir Biotechnology и GlaxoSmithKline.
📍 Как видно, платформа XmAb может быть использована для разработки антител для совершенно разных патологий (инфекционные, аутоиммунные и воспалительные заболевания и различные виды рака). Именно потому Xencor активно развивает сотрудничество с другими компаниями, включая Биг Фарму.
Сотрудничество (список не полный)
Многие свои разработки Xencor активно продает другим компаниям. Кроме указанных выше, в августе 2022 года компания объявила о лицензионном соглашении о создании биспецифических или мультиспецифических антител XmAb с использованием уникального банка тканей человека Caris Life Sciences и биоинформатического подхода для поиска адресных маркеров опухоли.
Академия
M.D. Anderson Cancer Center, Abramson Cancer Center of the University of Pennsylvania и ICON Clinical Research спонсируют КИ вудалимаба.
ICON Clinical Research спонсирует несколько клинических программ.
Индустрия
Janssen Janssen получила эксклюзивные права на разработку и коммерческое использование пламотамаба в мире. Хотя КИ 2 фазы пламотамаба в сочетании с тафаситамабом (tafasitamab, Monjuvi®, Incyte и MorphoSys) и леналидомид (lenalidomide, REVLIMID®, Bristol-Myers Squibb) Xencor спонсирует сама.
Разработки на клинической стадии исследований
В пайплайне компании 7 биспецифических антител, которые в настоящее время проходят клинические исследования (КИ). Основные разработки - вудалимаб (vudalimab, связывает PD1 и CTLA4на иммунных клетках) и пламотамаб (plamotamab, связывает CD20 на опухолевых клетках и CD3 на Т-лимфоцитах).


💊 Вудалимаб (vudalimab, XmAb20717, XmAb®717) - биспецифичное антитело, способное связывать PD1 и CTLA4 рецепторы на иммунных клетках. Эти рецепторы являются контрольными точками иммунного ответа, так что их блокада имеет потенциал значительно усилить пролиферацию (увеличение количества в результате деления клеток) и активацию Т-клеток и, следовательно, их противоопухолевую активность. Вводится внутривенно.
Клинические исследования
➡️ Открытое КИ 1 фазы DUET-2 проводится для оценки XmAb®717 в качестве лечения 28 (!) различных солидных опухолей (в том числе, меланома, рак молочной железы, гепатоцеллюлярная карцинома, уротелиальная карцинома, плоскоклеточный рак головы и шеи (SCCHN), почечно-клеточная карцинома, колоректальная карцинома, немелкоклеточный рак лёгкого (NSCLC), аденокарцинома желудка или гастроэзофагеального перехода, эндометриальный рак) с участием всего 154 пациентов. Начато в июле 2018. XmAb®717 в разных дозах вводят на 1 и 15 день 28-дневного цикла, всего два цикла.
Цель: подбор оптимальной дозы и предварительная оценка эффективности и безопасности (56 дней).
📢 Результаты ожидаются: промежуточные в ноябре 2022, окончательные в феврале 2023.
➡️ Открытое КИ 2 фазы, XmAb®717 (10 мг/кг каждые 2 недели) отдельно или в сочетании с химиотерапией или таргетной терапией назначается мужчинам (n = 85) с запущенным раком предстательной железы (простаты), с которым не помогла справится кастрация (это основной способ лечения).
Цель: предварительная оценка эффективности (частота общего ответа, длительность ответа, выживаемость без прогрессирования по данным рентгенологического обследования) и безопасности (8 недель).
📢 Результаты ожидаются: ближайшие - во второй половине 2022, промежуточные в июне 2023, окончательные в июне 2024.
➡️ Открытое КИ 2 фазы изучает возможность назначения XmAb®717 (доза и режим не указаны) при некоторых видах рака репродуктивной и мочеполовой системы (рак яичников, почечно-клеточная карцинома, рак эндометрия, рак шейки матки, запущенный рак простаты, с которым не помогла справится ни кастрация). Начато в апреле 2022, планируется набор 150 участников.
Цель: предварительная оценка эффективности (частота общего ответа) (12 недель). Пациенты, прошедшие 1-й этап, с ORR ≥ 20% (по крайней мере, 2 из 10 субъектов с объективным ответом), продолжат прием препарата во 2-м этапе.
📢 Результаты ожидаются: промежуточные в июле 2023, окончательные в августе 2023.
➡️ В открытом КИ 2 фазы XmAb®717 (10 мг/кг, на 1 и 15 день 28-дневного цикла) назначают пациентам с раком желчевыводящих путей (n = 27) в течение 2 лет. Начато в апреле 2022.
Цель: предварительная оценка эффективности: частота общего ответа (2 года), выживаемость без прогрессирования, общая выживаемость (до 5 лет) .
📢 Результаты ожидаются: промежуточные в марте 2024, окончательные в декабре 2024.
➡️ Открытое КИ 2 фазы XmAb®717 (на 1 и 15 день каждого цикла, доза не указана) для лечения 8 редких видов рака (n = 140). Начато в мае 2022.
Цель: предварительная оценка эффективности (частота общего ответа, в среднем, в течение года).
📢 Планируется начало набора пациентов в 2022. Оценка результатов в апреле 2024.

💊 Пламотамаб (plamotamab, XmAb13676, XmAb®676) - биспецифичное антитело, способное связывать CD20 на опухолевых клетках и CD3 на Т-лимфоцитах. Это антитело теоретически должно усилить противоопухолевую активность лимфоцитов против раковых клетках, экспрессирующих рецептор CD20 (это в основном В-клеточные лимфомы). Вводится внутривенно или подкожно.
Клинические исследования
➡️ Открытое КИ 1 фазы с участием 160 пациентов с В-клеточной неходжкинской лимфомой, хроническим лимфоцитарным лейкозом (ХЛЛ), мелкоклеточной лимфоцитарной лимфомой (вариант В-клеточной лимфомы). Пламотамаб вводится внутривенно или подкожно до 8 недель (доза не указана), с возможным продлением курса лечения. Начато в октябре 2016.
Цель: предварительная оценка безопасности (8 недель) и подбор оптимальной дозы.
📢 Результаты ожидаются: ближайшие - во второй половине 2022 года, промежуточные в июле 2023, окончательные в октябре 2025.
➡️ Открытое КИ 2 фазы с участием 240 пациентов с рецидивирующей или рефрактерной к лечению диффузной В-крупноклеточной лимфомой. Эффекты пламотамаба (доза и режим не указаны) в сочетании с тафаситамабом (tafasitamab, Monjuvi®, Incyte и MorphoSys) и леналидомид (lenalidomide, REVLIMID®, Bristol-Myers Squibb) сравнивают с активным контролем (тафаситамаб + леналидомид). Набор пациентов начат в 1 квартале 2022.
Цель: предварительная оценка безопасности (12 недель) и эффективности (выживаемость без прогрессирования, до 5 лет).
📢 Оценка результатов в апреле 2027.

💊 XmAb®306 (XmAb24306, RO7310729) - рекомбинантный белок IL15/IL15Rα-Fc, нацеленный на иммунные клетки (NK и T). Разрабатывается совместно с Genentech (Roche Group). Вводится внутривенно.
➡️ Открытое КИ 1 фазы изучает эффекты XmAb®306 (доза и режим не указаны) отдельно и в сочетании с атезолизумабом (atezolizumab, TECENTRIQ®, Roche) у пациентов с запущенными солидными опухолями (n = 250, виды рака не указаны). Начато в марте 2020.
Цель: оценка безопасности (до 4 лет) и подбор оптимальной дозы. Также оценивается предварительная противоопухолевая активность (частота общего ответа, длительность ответа, выживаемость без прогрессирования, общая выживаемость).
📢 Результаты ожидаются: промежуточные в июне 2024, окончательные в июне 2024.
➡️ В КИ 1 фазы оценивается эффективность назначения XmAb306 (доза не указана) в сочетании с даратумумабом (daratumumab, DARZALEX®, моноклональное антитело к CD38 Janssen Biotech) пациентам с запущенной множественной миеломой (n = 60). Начато в апреле 2022.
Цель: оценка безопасности (до 3 лет) и предварительной эффективности (частота общего ответа, до 3 лет)
📢 Результаты ожидаются: в 2026.

💊 XmAb®104 (XmAb®23104) - биспецифичное антитело против PD-1 и ICOS. Вводится внутривенно.
➡️ Открытое КИ 1 фазы DUET-3 изучает эффекты комбинации XmAb®104 (10 мг/кг) и ипилимумаба (ipilimumab, Yervoy® - антитело против CTLA-4 компании Bristol-Myers Squibb) по сравнению монотерапией XmAb®104 у пациентов с солидными опухолями (n = 234, 16 видов рака). Начато в мае 2019. XmAb®104 назначается на 1 и 15 день 28-дневного цикла, всего 2 цикла.
Цель: предварительная оценка эффективности и безопасности (8 недель).
На конференции American Society of Clinical Oncology (ASCO) в июне 2022 был представлен постер со следующими результатами:
- Наиболее частыми НР (> 5 пациентов) были снижение аппетита (9,7%), диарея (9,7%), утомляемость (9,7%) и макулопапулезная сыпь (8,1%). У двух пациентов (3,2%) наблюдались серьезные НР, включая гипербилирубинемию 3 степени и бессимптомное повышение уровня липазы 4 степени; оба явления разрешились с помощью преднизолона. Четыре пациента (6,5%) прекратили участие в исследовании из-за побочных эффектов (всего n = 62).
- На момент анализа у 51 пациента наблюдались два подтвержденных частичных ответа (4%) (PR), один неподтвержденный PR и стабилизация заболевания.
📢 Результаты ожидаются: промежуточные в июле 2023, окончательные в декабре 2024.

💊 XmAb®564 (XmAb27564 ) - модифицированный аналог интерлейкина 2 IL-2-Fc, разработанный с использованием технологии Xtend™ для избирательной активации регуляторных Т лимфоцитов (Tregs) путем воздействия преимущественно на рецептор интерлейкина 2 IL-2Rα (CD25). Вводится подкожно.
Tregs в норме мешают иммунным клеткам атаковать собственные неповрежденные клетки; однако при многих аутоиммунных заболеваниях их регуляция нарушена.
➡️ КИ 1 фазы изучает эффекты XmAb®564 (подкожно, с увеличением дозы - не указана) по сравнению с плацебо (n = 24) у здоровых добровольцев. Начато в апреле 2021.
Цель: оценка безопасности (4 недели), фармакокинетических параметров.
📢 Результаты ожидаются: первые - в конце 2022, промежуточные в декабре 2023, окончательные в июне 2022.

💊 XmAb®841 (XmAb22841 ).
⛔️ Разработка остановлена, так как клинический профиль лекарства - неконкурентоспособен (читай препарат оказался неэффективен).
➡️ Открытое КИ 1 фазы DUET-4 изучает эффекты XmAb®841 (доза и режим не указаны) отдельно и в сочетании с пемпролизумабом (pembrolizumab, KEYTRUDA®, Merck) у пациентов с солидными опухолями (n = 242, 23 вида рака). Начато в мае 2019.
Цель: оценка безопасности и переносимости (8 недель) и подбор оптимальной дозы. Также оценивается предварительная противоопухолевая активность.
📢 Результаты ожидаются: промежуточные в июне 2024, окончательные в ноябре 2025.

💊 Tidutamab (XmAb®087, XmAb18087) - биспецифичное антитело против SSTR2 и CD3.
⛔️ Разработка остановлена, так как клинический профиль лекарства - неконкурентоспособен (читай препарат оказался неэффективен).
➡️ Открытое КИ 1b/2 фазы DUET-1-02 изучает эффекты XmAb®087 (режим и доза не указаны) отдельно и в сочетании с пемпролизумабом (pembrolizumab, KEYTRUDA®, Merck) у пациентов с карциномой Меркеля и мелкоклеточным раком лёгкого (n = 142). Начато в мае 2021.
Цель: оценка безопасности (6 недель) и предварительной эффективности (частота общего ответа) (6 недель).
📢 Результаты ожидаются: промежуточные в декабре 2023, окончательные в марте 2024.

💊 XmAb®819 - биспецифичное антитело против ENPP3 и CD3. ENPP3 экспрессируется на клетках некоторых видов рака, а CD3 способствует стабилизации ТCR-рецептора лимфоцитов, который в свою очередь ответственен за распознавание антигенов. Взаимодействие ТCR-рецептора с антигеном является ключевой точкой в запуске иммунного ответа. Такое двойное нацеливание, таким образом, должно способствовать лучшему иммунному ответу на конкретные раковые клетки.
➡️ КИ 1 фазы с участием пациентов с запущенным раком почки. Начато в июне 2022. В августе сообщили по получении дозы первым пациентом.
📢 Результаты ожидаются: промежуточные в апреле 2025, окончательные в апреле 2026.

💊 XmAb®808 - биспецифическое антитело, нацеленое на опухолевый антиген B7-H3, который экспрессируется на клетках многих видов рака и на рецептор CD28 на T-лимфоцитах, участвующий в активации T-клеток.
Предполагается, что это антитело будет притягивать больше активных Т-лимфоцитов к опухоли, что может улучшить противоопухолевую активность ингибиторов контрольных точек (например, пемпролизумаба) (pembrolizumab, KEYTRUDA®) от $MRK.
Планируется начало КИ 1 фазы в 2022.

⛔️ Novartis остановила разработку вибекотамаба (Vibecotamab, CD123 x CD3) с февраля 2022. Xencor тоже не намерена ее продолжать. Новость хорошо описана здесь.
Разработки на доклинической стадии

Вывод по разработкам компании
В целом, результатов пока очень мало. Да, у Xencor есть успешный опыт применения платформы XmAb, который был реализован в нескольких удачных препаратах, получивших одобрение FDA (см. выше), однако это не касается биспецифичных антител, которые сейчас составляют основу пайплайна компании. Любые инвестиции в эти разработки могут быть пока основаны только на доверии.
Для справки, сама идея двойного нацеливания антител появилась еще в 1960-х. На 2021 год FDA было одобрено три биспецифических антитела:
- блинатумомаб (blinatumomab, Blincyto®, Amgen, $AMGN), связывающий CD3 на Т-клетках и CD19 на В-клетках;
- катумаксомаб (catumaxomab, Removab®, Fresenius Biotech и Trion Pharma ), связывающий CD3 и EpCAM на раковых клетках (отозван через 4 года из-за иммуногенности и токсичности);
- эмицизумаб (emicizumab, Hemlibra®, Genentech) - в отличие от остальных - не противоопухолевый препарат, связывает IXa и X факторы свертывания крови.
____________________________
Написанное здесь не является инвестиционной рекомендацией. Это живой обзор, он будет периодически обновляться.
Последнее обновление: 08 августа 2022.