Обзор: Karuna Therapeutics (Live)
Долгорукова Антонина, https://t.me/long_handsKaruna Therapeutics (NASDAQ: KRTX)
Терапевтическая область: психиатрия
Капитализация (13.06.22): $3.03 млрд, кэш: $443.2 млн, обязательства: $? млн
На 31 декабря 2021 (за 2021 год):
- траты на R&D: $128.2 млн, (всего $180.8 млн)
- прибыль: $36.9 млн,
Сотрудники (13.06.22): 118
Год основания: 2009
____________________________
🍄 Фокус компании: Разработка новых молекул и комбинаций веществ, способных влиять на работу мускариновых рецепторов, для лечения психических расстройств.
📖 Мускариновые рецепторы (мускариночувствительный холинорецептор, м-холинорецептор) активируются мускарином - алкалоидом, содержащимся в грибах. Это класс холинорецепторов, то есть, они находятся на нейронах, которые передают сигнал друг другу с помощью нейромедиатора ацетилхолина. Такие нейроны играют важную роль в процессах памяти и обучения (см. обзор по болезни Альцгеймера).
Сотрудничество
Права на разработку ксаномелина Karuna выкупила у Eli Lilly.
В июле 2020 Karuna заключила соглашение с PsychoGenics - компанией, которая занимается поиском потенциальных кандидатов для лечения нейропсихиатрических расстройств с использований AI технологий (машинное обучение и компьютерное зрение). У PsychoGenics есть такие платформы, как SmartCube®, NeuroCube®,PhenoCube®, and eCube™️. Их услугами также пользуются Sunovion и Roche.
В мае 2021 Karuna заключила эксклюзивное лицензионное соглашение на разработку, производство и коммерциализацию своего основного кандидата KarXT в Китае, включая континентальный Китай, Гонконг, Макао и Тайвань. Компания получила по этой сделке предварительный платеж в размере $35 млн и право на получение дополнительных $80 млн США при регистрации препарата.
Dr Brannan, Stephen старший исследователь, получил грант от Wellcome Trust на сумму почти в $6 млн в 2018.
Разработки на клинической стадии исследований
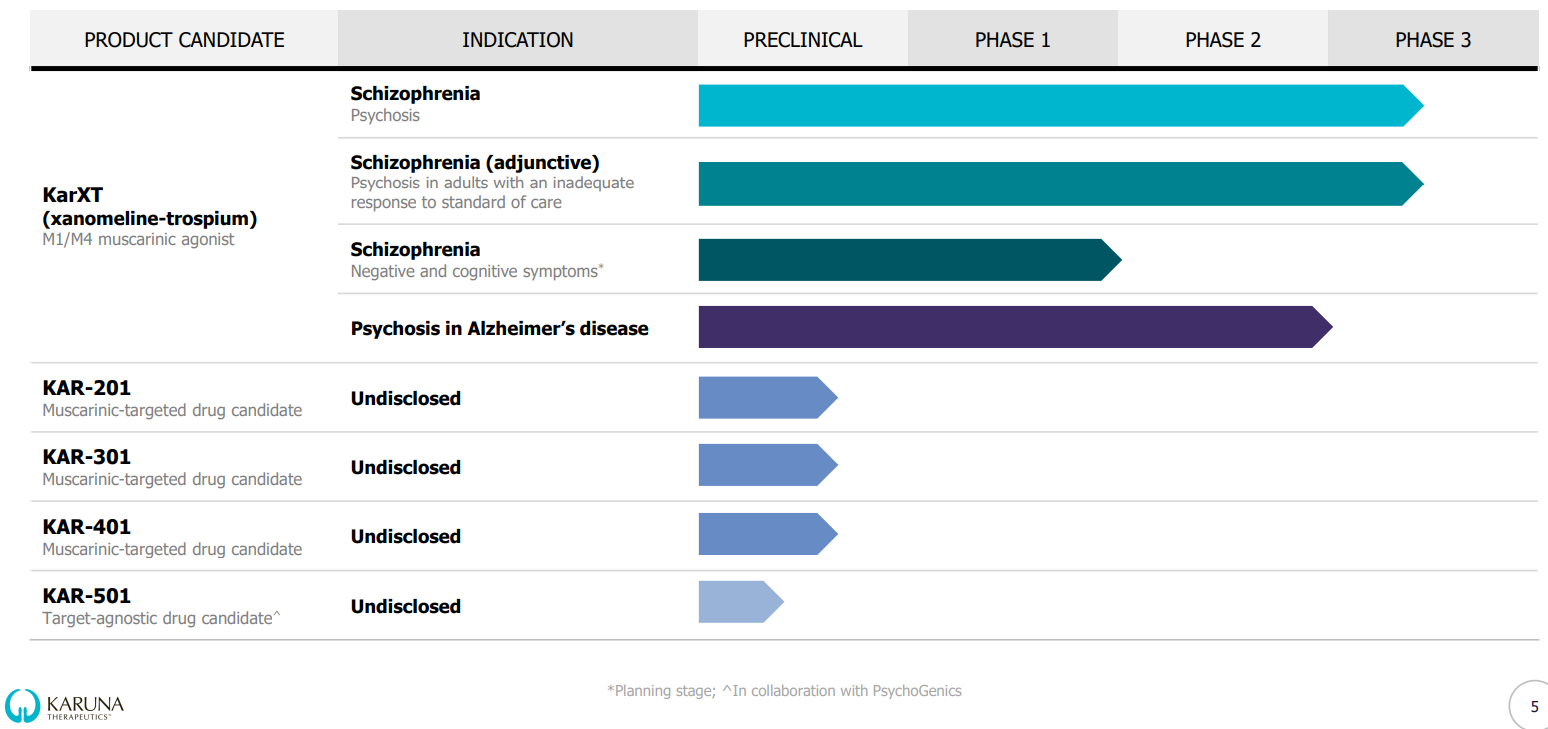
В пайплайне компании 1 препарат-кандидат на клинической стадии исследований - KarXT. Исследуется по двум показаниям - шизофрения и психоз при болезни Альцгеймера.
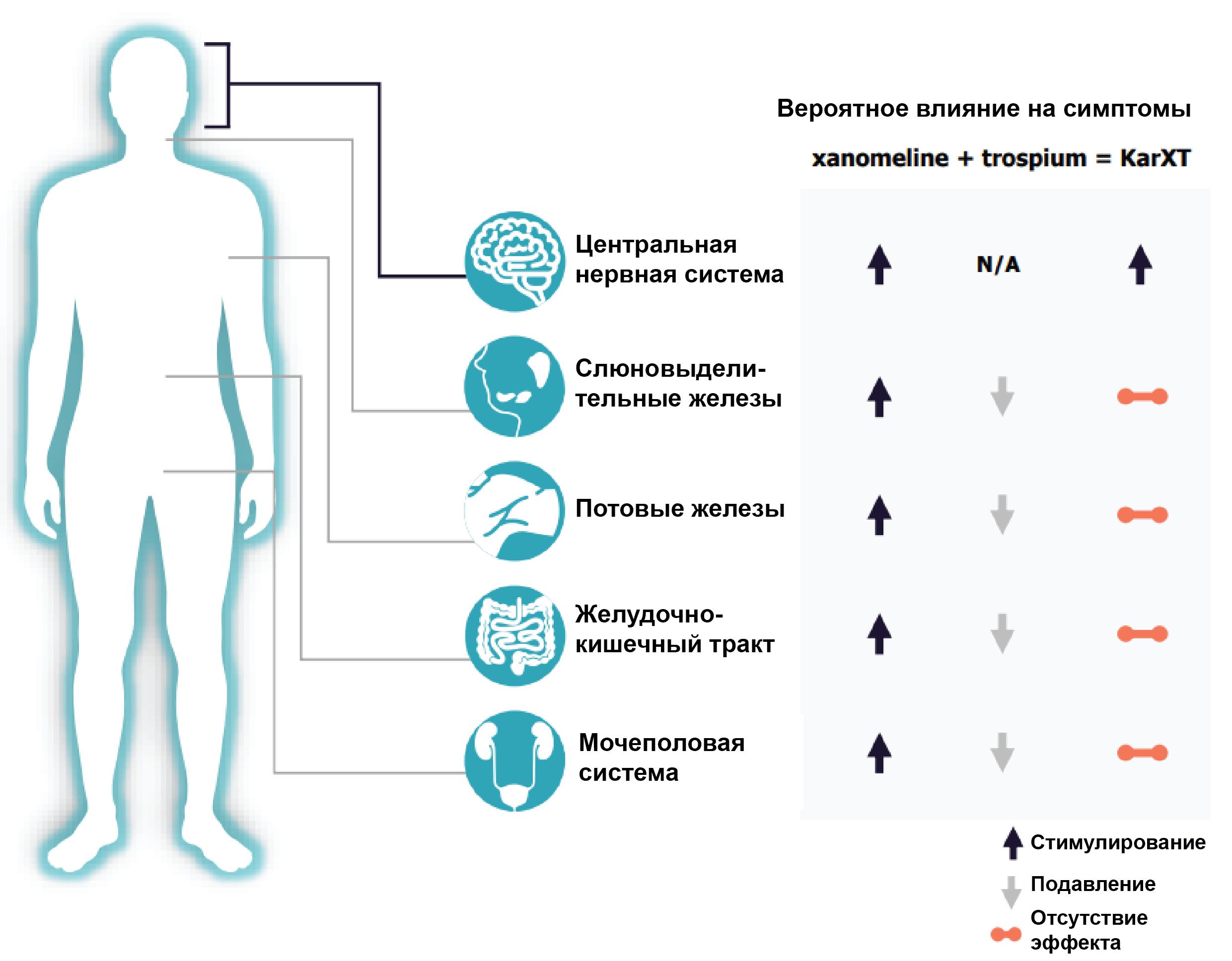
💊 KarXT (xanomeline, старое название LY246708 и trospium, он же SANCTURA® Allergan и Indevus) - капсулы для приема внутрь, 2 раза в день. Ксаномелин (xanomeline) - это агонист (т.е. стимулятор) M1 и M4 мускариновых рецепторов. Активация данных рецепторов в мозге может влиять на когнитивные функции и подавлять симптомы психоза, а вот в других тканях - способствовать развитию нежелательных явлений (НЯ) (слюноотделение, потливость, сужение зрачков, брадикардия, сужение бронхов, тошнота, рвота, учащение мочеиспускания, понос).
Троспиум (trospium) - антагонист (т.е. блокатор) мускариновых рецепторов М1 и М3. Однако он воздействует преимущественно на периферические рецепторы, и таким образом, может нивелировать большинство побочных эффектов ксаномелина.
Троспиум одобрен для лечения гиперактивности мочевого пузыря с симптомами неотложного недержания мочи или острого учащённого мочеиспускания. Применяется в дозе 20 мг 2 раза в день. Может вызывать серьезные НЯ (частота 2.9%)(аллергические реакции, затрудненное дыхание, сильная боль в желудке, вздутие живота, сильный запор, затруднения или задержка мочеиспускания, делирий и галлюцинации). Наиболее частые побочные эффекты: сухость во рту (20%), легкий запор (9.6%), головная боль (4.2%), боль в животе (1.5%), диспепсия (расстройства желудка, 1.2%). Несмотря на мнение Karuna о том, что троспиум не проникает в ЦНС, SANCTURA® может вызывать побочные эффекты, связанные с нервной системой: галлюцинации, головокружение, сонливость.

KarXT изучается как средство для лечения шизофрении, в том числе, у пациентов, которым не помогает стандартное лечение, в 7 КИ, 6 из которых на 3 фазе.
Клинические исследования
➡️ КИ 1 фазы с участием 70 здоровых добровольцев. Проведено совместно с PureTech Health с целью оценить, уменьшит ли добавление троспиума к ксаномелину количество и тяжесть периферических холинергических НЯ. Ксаномелин назначали в дозе 75 мг трижды в день, а троспиум в дозе 20 мг дважды в день; курс лечения 1 неделя. Проведено в сентябре-октябре 2016. Результаты сообщили в декабре 2016.
- Добавление троспиума к ксаномелину привело к уменьшению НЯ на 46%;
- сообщается также, что частота сообщения о каких либо холинергических НЯ у пациентов до начала лечения была около 32%, а после лечения комбинацией - 34%.

➡️ КИ 2 фазы EMERGENT-1 (182 пациента с шизофренией (в основном, афроамериканцы), 7 центров США, ~5 недель лечения). Проходило с сентября 2018 по сентябрь 2019. Результаты опубликованы в The New England Journal of Medicine и The Journal of Clinical Psychiatry.
- Эффект наступал со второй недели лечения. Снижение общего балла PANSS (облегчение как позитивных, так и негативных симптомов шизофрении) на 11,6 на 5-й неделе (-17,4 KarXT против -5,9 в группе плацебо, p<0,001).
- Любое НЯ произошло у 54% пациентов лечебной группы и у 43% участников группы плацебо. Наиболее частыми побочными эффектами в группе KarXT были запор (17%), тошнота (17%), сухость во рту (9%), диспепсия (9%) и рвота (9%). Тошнота, сухость во рту и рвота чаще наблюдались в начале лечения, а на 5 неделе - реже.
➡️ КИ 3 фазы EMERGENT-2 (246 пациентов с шизофренией, 22 центра США, ~5 недель лечения). Начато в декабре 2020.
Мой прогноз в июне: Результаты КИ 3 фазы не должны существенно отличаться от результатов КИ 2 фазы:
1) медицинские центры те же, за исключением тех, что в штатах Florida, Illinois, Missouri, Nevada, а значит популяция пациентов должна быть схожей;
2) дизайн, режим и сроки терапии - те же;
3) появились новые критерии исключения: какие-либо побочные эффекты, связанные с ксаномелином или троспиумом в прошлом, ВИЧ и заболевания печени или желчевыводящих путей в анамнезе.
О результатах сообщили в пресс-релизе, сопровождающем отчет за 2 квартал 8 августа 2022:
- Эффект наступал со второй недели лечения. На 5 неделе лечения снижение общего балла PANSS (облегчение как позитивных, так и негативных симптомов шизофрении) составило 9.6 (-21.2 KarXT против -11.6 в группе плацебо, p<0.0001)
- Частота НЯ составила 75% в группе KarXT и 58% в группе плацебо. Наиболее частыми побочными эффектами в группе KarXT (> 5% ) были запор, диспепсия, тошнота, рвота, головная боль, повышение артериального давления, головокружение, гастроэзофагеальная рефлюксная болезнь, дискомфорт в животе и диарея.
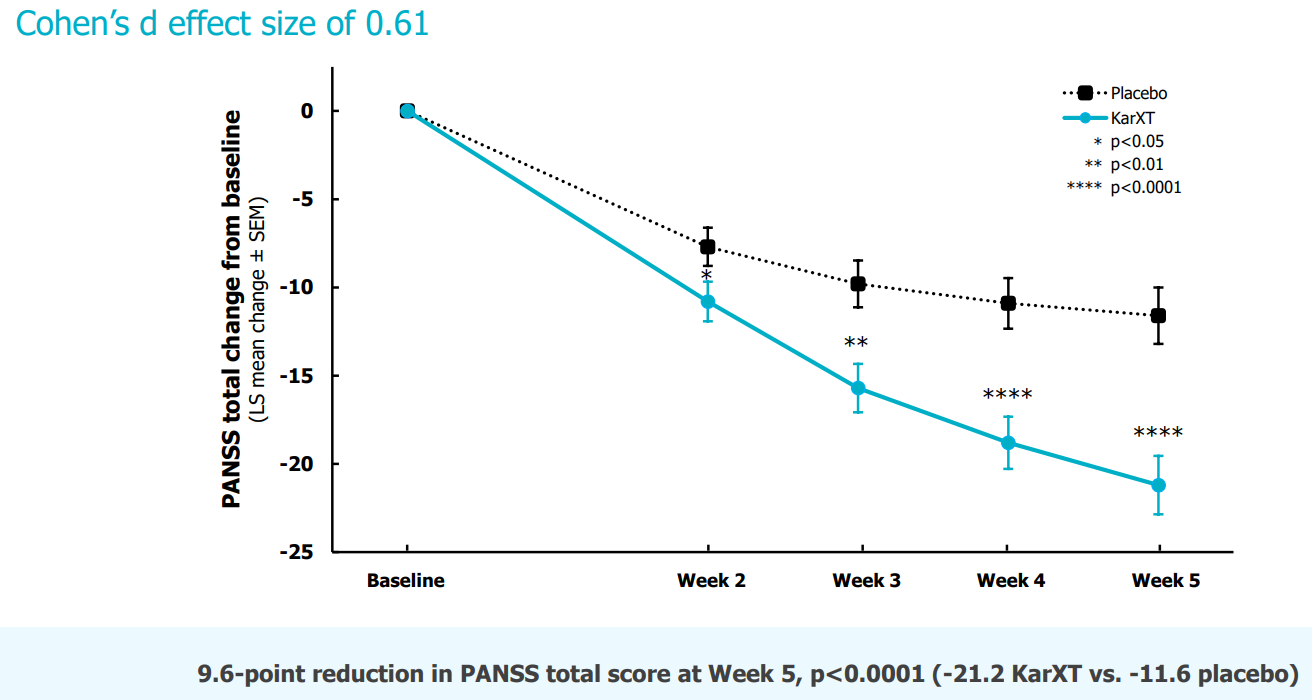
📢 Дополнительный анализ данных исследования фазы 3 EMERGENT-2 продолжается и будет представлен на будущих конференциях.
В КИ EMERGENT 3, 4 и 5 изучается также долгосрочная безопасность KarXT.
➡️ КИ 3 фазы EMERGENT-3 (246 пациентов с шизофренией, 23 центра США и Украины, ~5 недель лечения). Начато в апреле 2021.
📢 Результаты ожидаются: Согласно отчету Q3 - в 1 квартале 2023.
➡️ Открытое КИ 3 фазы EMERGENT-4 (350 пациентов с шизофренией, 40 центров США и Украины, 52 недели лечения) - продолжение EMERGENT-2 и 3. Начато в феврале 2021.
📢 Результаты ожидаются: промежуточные и окончательные в июне 2023.
➡️ Открытое КИ 3 фазы EMERGENT-5 (400 пациентов с шизофренией, 43 центра США, 52 недели лечения). Начато в июне 2021.
📢 Результаты ожидаются: промежуточные и окончательные в июле 2023.
___________________________________________________________________________
Данные программы EMERGENT будут использоваться для подачи заявки на маркетинг (NDA) в FDA, которая запланирована на середину 2023.

Во всех этих КИ KarXT назначается в дозе 50/20 мг первые 2 дня, затем 100/20 мг следующие 5 дней, и до 125/30 мг с 8 дня, в зависимости от ответа и переносимости.
Также ведутся исследования:

➡️ КИ PENNANT - трехлетнее открытое амбулаторное исследование фазы 3b для оценки долгосрочной безопасности, переносимости и эффективности KarXT в качестве монотерапии (380 пациентов США с шизофренией).
📢 Начало КИ запланировано на 4 квартал 2022.
➡️ КИ 3 фазы ARISE (400 пациентов с шизофренией, которую не удается контролировать стандартным лечением, 7 центров США, 6 недель лечения). Начато в ноябре 2021.
📢 Результаты ожидаются: промежуточные в ноябре 2023, окончательные в декабре 2023 (в корпоративной презентации августа 2022 указан 1 квартал 2024).
➡️ Открытое КИ 3 фазы (280 пациентов с шизофренией, которую не удается контролировать стандартным лечением, 3 центра США, 52 недели лечения) - продолжение КИ ARISE. Начато в марте 2022.
📢 Результаты ожидаются: промежуточные в ноябре 2024, окончательные в декабре 2024.
В этих КИ KarXT назначается в дозах 50/20 мг, 75/20 мг, 100/20 мг, 125/30 мг - с увеличением каждую неделю.
Оценка эффективности проводится по шкале позитивных (галлюцинации, бред, возбуждение) и негативных (невозможность выражения эмоций, нарушения когнитивных функций) синдромов шизофрении PANSS.
📍 Минимальной клинически значимой разницей балла (до - после) по шкале PANSS считается разница от 15 баллов (~24- 34% снижение в зависимости от исходных значений).
Вывод по направлению
✅ Данные программы EMERGENT будут использоваться для подачи заявки на маркетинг (NDA) в FDA, которая запланирована на середину 2023. На сегодня видны хорошие предпосылки к успеху:
Эффективность:
➕ Препарат показал хороший эффект в отношении как позитивных, так и негативных симптомов шизофрении в двух ослепленных КИ 2 и 3 фазы.
➖ Оба КИ проведены исключительно в США, а в одном из них - участники в основном, афроамериканцы. Так что популяцию сложно назвать репрезентативной.
➗ Минимальной клинически значимой разницей балла (до - после) по шкале PANSS считается разница от 15 баллов (~24- 34% снижение в зависимости от исходных значений), а KarXT демонстрирует снижение порядка 17-21 балла (~21%). Хотя размер эффекта и клиническая значимость, как показывает практика, не являются ключевыми факторами для принятия решения FDA.
Безопасность:
➕ В соответствии с EMERGENT-1 и -2, KarXT не вызывает НЯ, свойственные имеющимся на рынке средствам терапии (седативный эффект = сонливость, увеличение веса и экстрапирамидные симптомы).
➖ у больных наблюдались НЯ, связанные как с активацией, так и с блокадой мускариновых рецепторов. Интересно, что несмотря на использование стандартной дозы троспиума в KarXT, частота некоторых НЯ, свойственных троспиуму, в КИ 2 фазы Karuna значительно выше (запор 17% vs 9.6%, диспепсия 9% vs 1.2%), а сухости во рту - ниже (9% vs 20%), чем в КИ троспиума. Все это может указывать на высоковатую дозу.
Для заявки FDA потребовала дополнительные к EMERGENT-1 и 2 данные по безопасности. Так что следим за результатами КИ 3 фазы (EMERGENT-3 - 1 квартал 2023, EMERGENT-4 и -5 - в июне-июле 2023) с основным фокусом на безопасность.

Планируется также изучить KarXT в качестве средства для лечения психоза у пациентов с болезнью Альцгеймера. Для этого разработана программа КИ ADEPT, которая включает три КИ 3 фазы.

Клинические исследования
➡️ КИ 3 фазы ADEPT-1 - с целью оценить способность KarXT предотвращать эпизоды психоза. Планируется 12 недель лечения (доза не указана)+ 26 недель наблюдения после прекращения лечения (n = 400).
📢 Начало в 3 квартале 2022. Завершение ожидается в 2025.
➡️ КИ 3 фазы ADEPT-2 для оценки эффективности в купировании приступа психоза, 12 недель лечения. Стартовая доза - 60/6 мг, затем 90/9, 120/12, с возможным последующим повышением до 150/15 и 200/20 (каждую неделю).
📢 Начало в 2023. Завершение ожидается в 2025.
➡️ Открытое КИ 3 фазы ADEPT-3 - для исследования долгосрочных эффектов и безопасности, 52 недели лечения. Это продолжение ADEPT-1 и ADEPT-2.
📢 Начало в 2023.
Вывод по направлению
✅ Идея опробовать KarXT для лечения психоза при болезни Альцгеймера подкрепляется хорошей научной гипотезой. Вспомним, например, о предполагаемой роли ацетилхолиновой передачи в развитии болезни Альцгеймера. Кроме того, дозу обоих компонентов-таки решили немного снизить (а стартовую троспиума - вообще более чем вдвое). Чтобы оценить перспективы KarXT в этом направлении, однако, нужны данные, подтверждающие безопасность и переносимость. Так что следим пока за результатами комбинации в КИ EMERGENT.
Конкуренты
Emraclidine (CVL-231, Cerevel Therapeutics) - аллостерический молудятор M4 мускариновых рецепторов.
КИ:
➡️ КИ 2 фазы EMPOWER-1
➡️ КИ 2 фазы EMPOWER-2
Начаты в июне 2022. These trials are expected to read out in the first half of 2024.
➡️ КИ EMPOWER-3, с периодом наблюдения 52 недели для оценки долгосрочной безопасности. Начато в сентябре 2022.
https://clinicaltrials.gov/ct2/results?cond=&term=Emraclidine&cntry=&state=&city=&dist=
____________________________
Написанное здесь не является инвестиционной рекомендацией. Это живой обзор, он будет периодически обновляться.
Последнее обновление: 14 февраля 2023.