Обзор: Affimed NV (Live)
Долгорукова Антонина, https://t.me/long_handsСайт компании: https://www.affimed.com/
Терапевтическая область: онкология (онкогематология), иммуноонкология
Капитализация (11.04.22): 0.5 млрд $
На 31 декабря 2021: кэш 197.6 млн €, траты на R&D 81.5 млн €
Сотрудники (11.04.22): 187
Год основания: 2000
_________________
Фокус компании
📖 Рак – это результат мутаций собственных клеток организма. Особые клетки нашей иммунной системы «выслеживают» такие измененные клетки и уничтожают. Но часто раковые клетки «обманывают» иммунитет. А иногда, иммунная система попросту не справляется с активным опухолевым ростом.
Так вот, обычно в иммуноонкологии стараются повлиять не на опухоль, а на иммунитет, чтобы он лучше опознавал раковые клетки и боролся с ними. При этом чаще используют технологии активации клеток приобретенного иммунитета. А вот исследователи Affimed NV решили сфокусироваться на активации клеток врожденной иммунной системы.
👨🏼🏫 Особенность компании: платформа ROCK®(Redirected Optimized Cell Killing) – позволяет синтезировать молекулы ICE® - активаторы врожденных клеток.
ICE® - молекула, которая как бы образует мостик между раковой клеткой и иммунной клеткой, в результате иммунная клетка активируется и уничтожает раковою. Видео на английском.
Если подробнее, то ICE® воспроизводят естественные процессы защиты - антителозависимую клеточную цитотоксичность и антителозависимый клеточный фагоцитоз.

Разработки
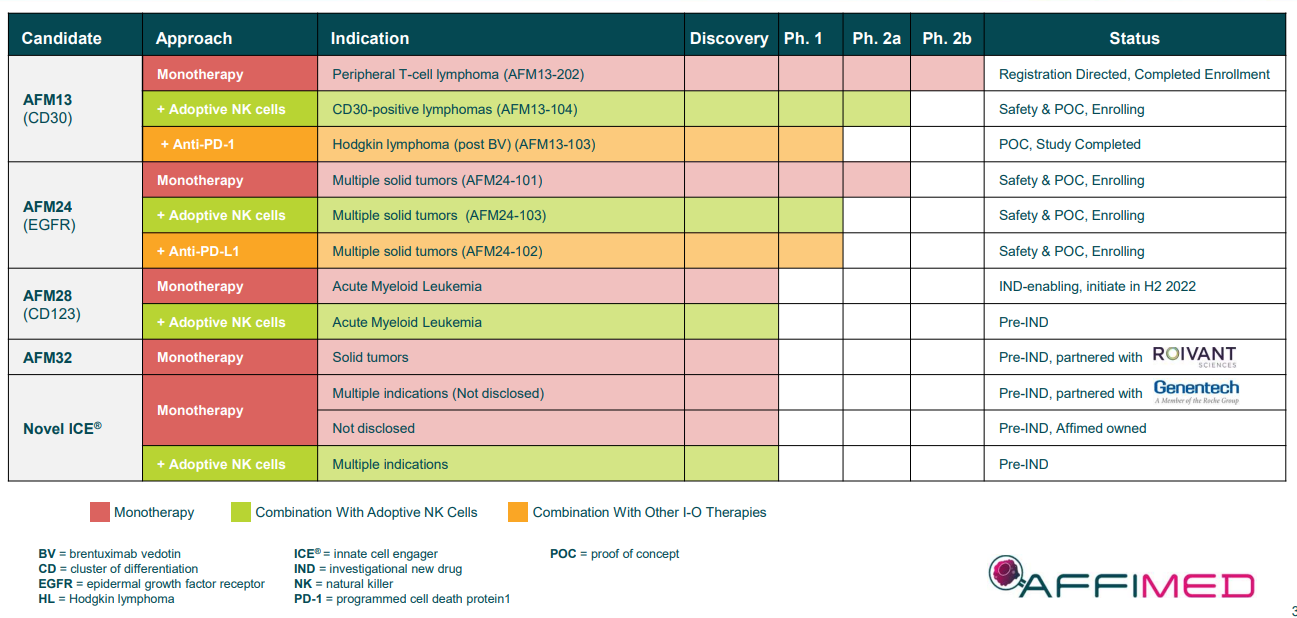
В пайплайне 4 молекулы и по двум из них ведется 8 клинических программ в фазах 1/2. Активных клинических исследований (КИ) сейчас 5 и все они - с повышением дозы в 1 части для установления оптимальной для 2 части КИ.
💊 Однако стоит упомянуть и AFM11 - это TandAb®, антитело способное связываться с двумя рецепторами CD19 на опухолевых клетках и CD3 на Т-клетках иммунной системы (Reusch и соавторы, 2015). Он разрабатывался для лечения рецидивирующих или устойчивых к лечению CD19-позитивных неходжкинских лимфом и острого лимфобластного лейкоза. Однако программа была остановлена в 2018 из-за смерти одного пациента и серьезных побочных явлений у двух других.

💊 AFM13 - это ICE®, способный связываться с CD16A и CD30.
CD16A присутствуют на поверхности иммунных клеток, к том числе - NK-клеток (естественных киллеров), а CD30 - на опухолевых клетках, в особенности в лимфомах. Соответственно, в КИ включают только пациентов с разными лимфомами, для которых наличие CD30 подтверждено результатами биопсии, то есть CD30 используется в качестве предиктивного биомаркера.
📍 Использование биомаркеров позволяет выделить группу пациентов с наибольшей вероятностью выраженного ответа на терапию.
Клинические исследования
Завершенные
➡️ В КИ 1/2 фазы AFM13-103 (KEYNOTE- 206) AFM13 назначали вместе с пембролизумабом (pembrolizumab, KEYTRUDA® компании $MRK, Merck) 30-ти пациентам с лимфомой Ходжкина, которую не удалось вылечить brentuximab vedotin (Adcetris®). Завершено в 2019. Статья с результатами опубликована в журнале Blood.
- общая частота ответа - 88%, полный ответ на лечение был у 46%; для сравнения приводится эффект лечения KEYTRUDA из другого КИ: частота общего ответа - 69%, полный ответ у 22.4%.
- выживаемость без прогрессирования (PFS) - 78% после 6 мес наблюдения и 45% после года.
➡️ КИ 1b/2a фазы AFM13-102 проведено с участием 18 пациентов с Т-клеточными лимфомами и фунгоидным микозом. Завершено в 2020, окончательные результаты здесь.
- общая частота ответа - 42% (6/14);
- найдены биомаркеры, подтверждающие активацию NK-клеток;
- на основании этих результатов, инициировано КИ 2 фазы REDIRECT.
➡️ В КИ 1/2 фазы AFM13-201 AFM13 назначали 25-м пациентам с лимфомой Ходжкина, которую не удалось вылечить brentuximab vedotin (Adcetris®) или ингибиторами контрольных точек (анти-PD1 или PD-L1 антителами). Завершено в 2020.
- общая частота ответа - 16.6% (1 полный ответ и 3 частичных); стабилизация заболевания - у 6, а прогрессирование у 14 пациентов
- завершено предварительно, из-за "проблем с набором пациентов".
Текущие
➡️ AFM13 в качестве монотерапии Т-клеточных лимфом и фунгоидного микоза исследуют в КИ 2 фазы REDIRECT (AFM13-202, n = 145). Оценка конечных точек проводилась дважды каждые 8 недель, затем каждые 12 недель. Результаты для 108 пациентов, которые получали лечение AFM13 внутривенно 200 мг/нед сообщили в пресс-релизе 10 декабря 2022.
- Частота общего ответа (ORR) составила 32,4%, а частота полного ответа (CR) - 10,2%
- Медиана длительность ответа (DoR) составила 2,3 месяца, медиана выживаемости без прогрессирования (PFS) - 3,5 месяца, а медиана общей выживаемости (OS) - 13,8 месяца.
➡️ В КИ 1/2 фазы AFM13-104 AFM13 изучают в комбинации с NK-клетками.
📖 NK-клетки относятся к врожденной иммунной системе и способны убивать опухолевые клетки. В Affimed их выделяют из пуповинной крови, активируют с помощью смеси цитокинов и образуют комплексы с AFM13.
Только вот трансплантация клеток чревата опасным осложнением - реакцией «трансплантат против хозяина». Поэтому предварительно проводят терапию, подавляющую иммунный ответ, в данном случае - смесью флударабина с циклофосфамидом. Кроме того, пациентам дополнительно вводили AFM13 через 7, 14 и 21 день после лечения комплексами AFM13-NK. Примечательно, что участники получили раньше несколько безуспешных курсов терапии (медиана = 7 курсов).
Итак, что нам поведала Affimed на онкологической конференции AACR (8-13 апреля 2022)?
- среди всех 22 пациентов, получивших разные дозы NK-клеток, общая частота ответа составила 89%: у 53% наблюдался полный ответ, у 37% - частичный ответ, а у 11% - прогрессирование заболевания (представлено на AACR);
- выживаемость без прогрессирования для всех 22 пациентов за 11 мес. составила 53%, а общая выживаемость - 79%;
- оптимальную дозу, установленную ранее, получили пока всего 13 пациентов (планируется добрать до 40 и провести 4 цикла терапии);
- результаты поразительные: подтвержден 100% ответ на лечение! Однако нового мало: о 100% ответе сообщали еще с первых 4 пациентов (апрель 2021), потом подтвердили на 12 пациентах (полный ответ был у 5/12 (42%) после первого цикла терапии);
- к этим данным пока добавили только 1 пациента и результаты второго цикла лечения: полный ответ произошел уже у 8/13 (62%) после двух циклов терапии;
- профиль безопасности отличный: основной побочный эффект - реакции на укол (НО это без учета побочек предварительной иммуносупрессии).
📢 Плановая дата завершения КИ AFM13-104 - апрель 2023. В дальнейшем ожидаются данные о частоте ответа через 2 года, выживаемости без прогрессирования и общей выживаемости (за 2-летний период).
Что это за показатели и какую роль играют при одобрении препарата - можно почитать здесь.
🧐 Результаты впечатляющие, но взглянем через призму скепсиса:
- выборка пока крайне мала и следующие 10 пациентов могут полностью изменить картину;
- частота полного ответа увеличилась, но после 2 цикла терапии: больше циклов = больше побочек от иммуносупрессии; интересно посмотреть увеличится ли она после первого цикла лечения, но пока добавили лишь 1 пациента.
- подход и режим лечения - крайне перспективны, так как в отдельности, все три компонента могут способствовать подавлению роста опухоли, но это же и основной недостаток КИ. Нужен контроль, чтобы понять, что именно помогло пациентам: NK клетки, иммуносупрессивная химиотерапия или AFM13.
К примеру, флударабин одобрен (в том числе, в России) для применения лимфолейкозов и неходжкинских лимфом, а циклофосфамид - показан при лейкозах, лимфомах и других видах рака, а также используется для профилактика отторжения трансплантата. Оба оказывают противоопухолевое действие.
- далее, для ускоренного одобрения потребуются данные о выживаемости без прогрессирования за более длительный период, а после - понадобятся данные об общей выживаемости для подтверждения эффективности.
✅ Вывод: очень интересная история на 1-2 года, за которой определенно стоит следить. Основной риск сейчас - растущий пиар и хайп, что чревато переоценкой препарата, да и компании в целом. А в будущем - в проявлении тяжелых побочных эффектов предварительной иммуносупрессивной терапии, утихании эффекта со временем, снижении частоты ответа при добавлении новых пациентов.

💊 AFM24 - ICE®, способный связываться с CD16A и EGFR.
EGFR - это рецептор, который экспрессируется на клетках некоторых опухолей, есть хорошая статья о нем на русском языке. Вкратце, мутации гена, кодирующего белок-рецептор EGFR приводят к чрезмерной активации последнего, что способствует росту опухоли.
AFM24 участвует в трех исследованиях по 7 показаниям в качестве терапии опухолей, устойчивых к другому лечению. Биомаркером служит экспрессия EGFR.
Клинические исследования
➡️ В КИ фазы 1/2a фазы (AFM24-101 , n = 155) препарат назначают в качестве монотерапии пациентам с солидными EGFR-положительными опухолями.
- На AACR 2022 сообщили, что первая цель достигнута - оптимальной оказалась доза 480 мг, однако максимальную еще не нащупали, продолжат повышать;
- стабилизация заболевания была наилучшим ответом у 8 из 24 (33%) пациентов.
- основные побочки (у 29 первых пациентов) были реакции в месте введения, тошнота и головная боль.
📢 Плановая дата завершения КИ - ноябрь 2025.
➡️ КИ 1/2a фазы AFM24-102 проводится для комбинации AFM24 с ингибитором контрольных точек (PD-L1) атезолизумабом (atezolizumab, Tecentriq®, Roche) у пациентов с немелкоклеточным раком легкого, раком желудка и поджелудочной железы.
📢 Набор пациентов начат в декабре 2021, а плановая дата первичного анализа - январь 2023.
➡️ КИ AFM24 в комбинации с SNK-01 (NKGen Biotech) фазы 1/2: в ноябре объявили о начале набора пациентов с немелкоклеточным раком легкого, плоскоклеточным раком области головы и шеи и колоректальным раком.
📢 Плановая дата завершения КИ - ноябрь 2025.
📢 В 2022 Affimed также обещала апдейт по AFM24.
✅ Вывод: пока строить не на чем, а эффективность показана скромная. Ждем первые результаты на большей выборке пациентов.

💊 AFM28 - ICE®, способный связываться с CD16A и CD123
Разрабатывается для пациентов миелоидными злокачественными образованиями, экспрессирующими CD123 (острый миелоидный лейкоз и миелодиспластический синдром).
📢 Подача IND (заявка на разрешение исследования на людях) ожидается во 2 квартале 2022, а начало первого КИ планируется во второй половине 2022.
✅ Вывод: пока строить не на чем. Ждем первые результаты.

💊 AFM32 тоже пока на доклинической стадии. Разработка ведется совместно с Roivant. Есть и другие программы в партнерстве с Genentech.
✅ Вывод: пока строить не на чем. Ждем начало КИ и первые результаты.
____________________________
Написанное здесь не является инвестиционной рекомендацией. Это живой обзор, он будет периодически обновляться.