«Неуспешный успех»: Гендицин и Имлигик
БиомолекулаКитай выступил пионером в области генной терапии рака: в 2003 году китайский регулятор SFDA одобрил Гендицин для лечения рака головы и шеи. А уже значительно позже (в 2015 г.), американский FDA одобрил Имлигик — это стало вообще первым одобрением генной терапии в регионе со зрелой регуляторной системой. Но вот только смогли ли эти лекарства оправдать оказанное им «высокое доверие» ─ вопрос как минимум дискуссионный.
Гендицин: «гладко было на бумаге»
В борьбе с раком можно (и нужно) использовать защитные силы самого организма, и ученым это давно известно: это основа иммунотерапии. Чтобы всё это делать правильно, нужно замечать, как сам организм справляется с внешними и внутренними угрозами. И здесь на первый план выходит ген-супрессор опухолей, который явно не стоит игнорировать, — вышеупомянутый «страж генома» p53. Его роль в защите от опухолевого перерождения так велика, что он стал одним из самых изучаемых. Функциональный белок p53 способен прервать клеточный цикл и индуцировать апоптоз (при накоплении повреждений в ДНК), а в опухолевых клетках, как мы уже говорили, часто выявляют повреждения гена p53 — это как неисправность ручника в машине. Как же можно использовать эти знания с пользой?
Принцип действия китайского противоракового препарата Гендицина ─ доставка в клетку функциональной копии p53 при помощи аденовирусного вектора. По идее, если такой носитель попадет в нормальную клетку, это ей не повредит: активность p53 там особо ни к чему (у нее нет триггерных генетических повреждений). А вот если p53 окажется в раковой клетке, она должна бы совершить «харакири», чтобы не опозорить свое честное имя противоправными действиями. Теоретически это должно ликвидировать опухоль, направив организм на путь выздоровления, — идея шикарная, но, как быстро выяснилось, «гладко было лишь на бумаге»...
Что же здесь не так?
По Гендицину существует целый ряд публикаций, описывающих его эффективность в сочетании с химио- и лучевой терапией, говорящих, что в исследованиях он показал эталонную безопасность; и даже содержащих экспертный консенсус применимости в клинической практике (данное утверждение отражено в публикации журнала Nature — не абы что!).
Данный препарат применяют при лечении плоскоклеточного рака головы и шеи, а также при некоторых других.
Что же не так со всеми этими данными? Или этот препарат действительно по-настоящему эффективен и безопасен? Если внимательно присмотреться к «нахваливающим» Гендицин статьям, то оказывается, что это в основном статьи китайских авторов, и здесь возникает серьезный вопрос: а насколько им можно верить? Дело в том, что в системе лекарственного регулирования в Поднебесной существуют определенные проблемы с прозрачностью. Это означает, что далеко не самые эффективные и безопасные препараты вполне могут проскальзывать сквозь барьеры регулято́рного одобрения. Больше того, поскольку политическая система Китая по сути своей является элитарной диктатурой, нельзя исключать и фактор политического давления на местных регуляторов в случаях, когда госструктурам выгодно выведение на рынок каких-либо лекарственных средств.
К сожалению, для Гендицина всё это вполне может оказаться правдой, так как в этот препарат сделаны значительные вливания государственных средств , а его одобрение (основанное на сомнительных данных клинических испытаний, см. ниже) имело некоторую политическую подоплеку. Дело в том, что это была вообще самая первая генная терапия, одобренная к применению у людей, и в случае ее всеобщего признания это вполне могло бы стать более чем убедительным доказательством зрелости китайской биотехнологической промышленности и медико-научной сферы (а значит, и ее конкурентоспособности на международной арене).
Общий объем инвестиций в данный препарат составил около 9,66 миллиона долларов США, четверть из которых пришлась на различные источники китайского правительства, включая Министерство науки и технологий, государственный фонд высоких технологий и муниципальное правительство города Шэньчжэня.
Противоречивость клинических данных
По имеющимся клиническим данным, проблема Гендицина в следующем: на момент его одобрения все эти испытания просто-напросто не соответствовали международным стандартам, и это почти сразу вызвало сомнения в их достоверности. Свою роль здесь сыграли и некоторые расхождения между декларируемой разработчиками Sibiono GenTech эффективностью и безопасностью с опубликованными ими же данными исследований. В частности, доктор Чжаохуэй Пэн (гендиректор и основатель Sibiono GenTech) упоминал о более чем 2500 пациентов, пролеченных Гендицином без серьезных побочных эффектов, однако препарат был одобрен на основе данных лишь о 135 людях (что составляет около 5% от озвученных Пэном цифр). Всё бы ничего, но 135 ─ это ведь даже меньше обычно требуемого для коммерческого одобрения (во всяком случае, если оглядываться на международные практики). Обычно клинические исследования проводятся в три фазы, причем на третьей включают порядка тысячи человек.
На этом странности в дизайне испытания не заканчиваются: в нем пациенты были случайным образом разделены на группы: (1) контроль (лучевая терапия) и (2) экспериментальная (лучевая + Гендицин), причем разделили их не поровну (что уже само по себе не очень хорошо): в первой группе было 72 человека, а во второй ─ 63. Дальнейшие выводы по наблюдаемой эффективности делались с учетом не всех пациентов: описывали эффект для 63 человек из контрольной группы и 56 — из экспериментальной.
Это вызывает вопросы, так как с одной стороны не совсем ясно, что стало с пациентами, не вошедшими в «расчетный пул» (учитывая, что есть подозрения о сокрытии в Китае статистики смертельных случаев — это приобретает особую остроту), а с другой ─ тут налицо проблемы с рандомизацией. Считается, что для достоверного анализа необходимо включать всех пациентов из исходных групп (даже если по каким-то причинам они и вовсе не получали лечения). Такой статистический метод называется анализом «по намеченному лечению» (intention-to-treat population) и больше соответствует реальной жизни.
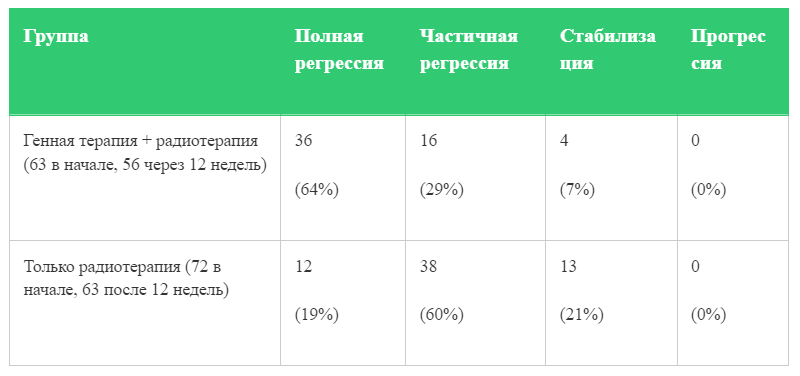
По результату: полная регрессия опухолей (по данным компьютерной томографии или магнитно-резонансной томографии) была в три раза выше, когда лечение включало лучевую терапию и Гендицин (что и объявляется разработчиками «несомненным успехом»), по сравнению с только лучевой терапией (36 случаев против 12). Однако частичная регрессия опухоли, напротив, происходила чаще при использовании только лучевой терапии (38 случаев против 16). Выглядит всё это как будто немного обнадеживающе, но скажем прямо: учитывая непрозрачный (и, по всей видимости, некорректный — как минимум с точки зрения статистической мощности) дизайн исследования, делать на основании этих данных далеко идущие выводы вряд ли правильно. Добавим к этому и то, что относительно данного исследования ничего не известно об «ослеплении», так что тут нельзя исключать свойственных «неслепым» исследованиям погрешностей (связанных с эффектом плацебо и предвзятостью оценки). Кроме того, регрессия опухолей, как говорилось выше, — это лишь суррогатный показатель эффективности терапии, а реальную эффективность показывают лишь данные по выживаемости.
Особенно же удивительно, что всего этого оказалось вполне достаточно для коммерциализации препарата; ну а, учитывая, что есть большие вопросы и к другим опубликованным доктором Пэном и его командой исследованиям, его громкие заявления о «тысячах спасенных Гендицином жизнях» выглядят в высшей степени спекулятивно.
Что было бы, если бы Гендицин попытались одобрить в странах с более жестким регулированием?
Мы можем предположить это, рассмотрев Адвексин (производства Introgen Therapeutics и Gendux) ─ препарат с аналогичным механизмом действия. Его планировали одобрить для лечения рака по орфанным показаниям, связанным с синдромом Ли-Фраумени в Европе и США; дополнительная заявка была подана на одобрение этого лекарства для лечения плоскоклеточного рака головы и шеи. В итоге рассмотрения были выявлены многочисленные проблемы в производстве, клинических и доклинических исследованиях, при этом убедительных доказательств пользы в отношении выживаемости и отсутствия прогрессирования заболевания (у ограниченного числа пациентов, лечившихся препаратом) выявлено не было. Также не было обнаружено и достоверной корреляции между выраженностью мутаций гена p53 в опухолях и клиническим ответом на Адвексин. В результате заявки на одобрение Адвексина в конечном итоге были отозваны компанией.
К сожалению, с учетом всего сказанного, похоже, что доставка p53 в опухолевую клетку, хотя и кажется перспективной технологией, на практике в лечении рака просто-напросто не работает :-(
Имлигик — скромная эффективность
Имлигик (talimogene laherparepvec; T-VEC) был первым основанным на вирусной онколитической технологии препаратом, одобренным FDA (в 2015 году, для лечения неоперабельной меланомы). Это лекарство представляет собой генетически модифицированный вирус простого герпеса типа 1, который после введения непосредственно в опухоль начинает в ней размножаться, продуцируя иммуностимулирующий белок GM-CSF. В нормальных клетках вирус не реплицируется, потому что у него отсутствует ген, отвечающий за подавление стрессового ответа. В опухолевых клетках система стрессового ответа сломана, что позволяет вирусу размножаться и вызывает лизис опухолей. Предполагается, что высвобождение затем опухолевых антигенов вместе с GM-CSF вирусного происхождения привлекает T-клетки иммунной системы, которые теперь уже могут «расправляться» и с другими новообразованиями.
Ситуация с этим препаратом в какой-то мере схожа с Гендицином: он инновационный и с виду интересный, но серьезным прорывом его не назвать. Дело в том, что, хотя Имлигик и показал способность уменьшать размеры некоторых опухолей, улучшение выживаемости пациентов оказалось совсем скромным. А точнее, на момент одобрения даже не было доказано, что он может существенно улучшить общую выживаемость или каким-либо образом повлиять на метастазы, имеющиеся на поздних стадиях меланом (по данным исследования OPTiM ─ на основании которого FDA и одобрили препарат).
В сравнении с контролем (введением GM-CSF), где медиана общей выживаемости составила 19 месяцев, этот же показатель при экспериментальном лечении (T-VEC) в 22,9 месяца не был статистически значимым (p = 0,116).
Узкие показания, внутриопухолевое введение, немалая стоимость (порядка $65 000 на пациента) и наличие альтернативных средств лечения сильно уменьшают смысл применения этого иммунотерапевтического препарата.
Множество других онколитических вирусов побывали в клинических исследованиях, но больше ни один не показал эффективности и безопасности, достаточной для одобрения в странах со зрелой регуляторной системой. В этом рассказе нельзя не упомянуть о так называемой суицидальной терапии с помощью тимидинкиназы (TK) вируса простого герпеса HSV. C помощью какого-либо вирусного вектора ген HSV-TK доставляется в клетки (в идеале — только в опухолевые), затем пациент получает относительно нетоксичный ганцикловир, который под воздействием HSV-TK превращается в ганцикловир-фосфат, а внутриклеточные ферменты фосфорилируют его до ганцикловир-трифосфата, который токсичен благодаря связыванию с ДНК, и при этом не выходит из клетки. Замысел элегантный, но так и не сработал — то ли из-за недостаточно специфичного нацеливания векторов на раковые клетки, то ли по каким-то другим причинам.
Однако, несмотря на многочисленные провалы, до сих пор остается надежда, что какой-то из подходов всё же сработает. Вирусы предоставляют широкие возможности для гибкой настройки того, какие ткани заражать, что в них экспрессировать, и по мере накопления знаний и клинических данных успех вполне вероятен.
Но на сегодняшний день самый громкий успех — в области иммунной клеточной генотерапии.