Метрономная химиотерапия: наши дни

Автор: Полина Федорова
Редакция: Снежанна Генинг, Наталья Усолова
Над материалом работали: Элина Добросоцкая
Верстка: Полина Федорова
Содержание:
- Метрономная терапия: что это такое?
- Механизмы действия
- Место в терапии злокачественных новообразований
- Новости с ASCO 2023 и не только
- Выводы
Что это такое?

При проведении химиотерапевтического лечения мы (и врачи, и пациенты) сталкиваемся с рядом трудностей. Стандартные схемы введения химиотерапии (ХТ) подразумевают введение максимально переносимых доз с определенной частотой. Такой подход обеспечивает цитостатическое действие препаратов, а за отведенный период «отдыха» организм восстанавливается и готовится к следующему цитостатическому удару. Однако стандартные режимы введения ХТ бросают нам интересные (не очень:( ) вызовы.
К ним можно отнести
- различные побочные эффекты ХТ (хотя мы и вводим максимально переносимую дозу, иногда сталкиваемся с серьёзными осложнениями, которые заставляют отклоняться от графика терапии, что в свою очередь приводит к снижению эффективности терапии),
- развитие толерантности опухоли к цитостатикам,
- невозможность проведения терапии в срок,
- да и просто невозможность проведения того или иного режима у конкретного пациента.
Зачастую нам требуется индивидуальный подход, а стандартные режимы ХТ далеко не для всех будут обладать наибольшей эффективностью и оптимальной переносимостью. Есть некоторые «уловки» и способы миновать эти коллизии. Об одном из вариантов и пойдёт речь сегодня.
Метрономная химиотерапия (МХТ), или метрономный режим химиотерапии, – это один из режимов введения химиотерапии, когда цитостатики применяются в значительно меньших дозах, чем максимально переносимые, а также с большей частотой, чем стандартная.
Иными словами, при МХТ мы применяем препарат чаще, но в меньшей дозировке.
Чаще всего для метрономных режимов используются пероральные препараты ввиду их доступности для такого подхода. Их просто дозировать и легко представить себе их длительный и частый прием в отличие от инфузий.
Нам твердят на каждом углу, как важно соблюдать интенсивность и кратность введения цитостатиков, чтобы достичь должного эффекта. Мы отчаянно боремся с возникающими осложнениями, чтобы провести терапию в срок и ни миллиграммом меньше! Но не всегда мы побеждаем, не всегда удаётся выполнить план. Давайте разберемся на примере исследования FOCUS2.
Исследование посвящено изучению ХТ для пожилых и ослабленных пациентов.
Идея в том, что эти пациенты в реальной жизни часто получают ХТ, однако лишь малая часть исследований включает эту группу пациентов.
FOCUS2 демонстрирует применение ХТ в сниженных дозах для "пожилых и хрупких" пациентов с прогрессирующим метастатическим колоректальным раком.
В данном исследовании "пожилые и хрупкие" – это пациенты, которым не показано проведение стандартной комбинированной ХТ в полном объеме, не получавшие ранее терапию по поводу метастатического рака, а также имеющие следующие клинические и биохимические показатели крови:
- количество лейкоцитов не менее 3*109/л,
- тромбоцитов не менее 100*109/л,
- уровень билирубина не превышает 3-кратного увеличения выше верхней границы нормы,
- трансаминазы не превышают 2,5-кратного увеличения выше верхней границы нормы,
- СКФ не менее 30 мл/мин.
Начальные дозы терапии для всех пациентов составляли 80% от стандартных, однако была запланирована эскалация доз до стандартных через 6 недель.
Провернуть это удалось только примерно для трети пациентов.
Интересно, что и удержать изначальную редуцированную дозу (80% от стандартной) удалось тоже только для трети пациентов, остальной трети потребовалась повторная редукция дозы.
Отчасти и для таких пациентов может быть показана МХТ.
В исследовании заявлены две конечные точки:
1) PFS (и влияние на этот показатель добавления оксалиплатина к фторпиримидинам),
2) качество жизни и влияние замены фторурацила на капецитабин.
Для первой конечной точки статистически значимого увеличения PFS (и OS) на фоне добавления оксалиплатина к фторпиримидинам зарегистрировать не удалось, хотя частота объективных ответов была выше в группе с оксалиплатином. Качество жизни при замене фторурацила на капецитабин статистически не улучшилось.
Механизм действия

Механизмы действия метрономной терапии так или иначе являются открытым вопросом. Чаще в исследованиях можно встретить данные об:
- антиангиогенных свойствах МХТ (объясняют это непосредственным воздействием на эндотелий сосудов опухоли и ангиогенные факторы)
- влиянии МХТ на опухолевое микроокружение и, как следствие, активации противоопухолевого иммунного ответа
- цитотоксическое действие.
P. S. Есть ряд исследований, которые подтверждают некоторые механизмы in vivo, однако антиангиогенные свойства и влияние на опухолевое окружение всё-таки не являются 100% evidence based, а действительно крупных исследований с убедительными доказательствами этих свойств по прежнему нет.
Токсичность сильно меньше, определенная концентрация цитостатиков постоянно поддерживается в организме. С учётом того, что период полувыведения для большинства химиопрепаратов не больше 48 часов, а кратность введения для большинства стандартных режимов составляет 2-3 недели, все это может звучать очень заманчиво, не правда ли? Давайте попробуем разобраться, стоит ли игра свеч, и удастся ли вообще сыграть.

А что по рекомендациям?
В 2021 году в журнале Cancers MDPI вышел обзор, посвященный МХТ в лечении рака молочной железы, немелкоклеточного рака легкого, колоректального рака. Эти локализации выбраны как наиболее хорошо изученные с точки зрения применения такого режима. И в некоторых исследованиях МХТ действительно показывала эффективность.

Существует множество исследований по изучению применения низких доз капецитабина. Например, в исследовании II фазы сравнивали два различных режима всеми любимой Кселоды и один уважаемый режим (нет, не политический) в лечении 323 случаев метастатического рака молочной железы (при этом ХТ распространенного рака ранее не проводилась, а более интенсивные режимы ХТ неприменимы):
капецитабин 1000 мг/м 2 два раза в день в течение 14 дней, цикл 21 день (что на 20% ниже стандартной дозы, а также для 50% женщин пришлось редуцировать дозу ещё больше ввиду токсичности), капецитабин 650 мг/м 2 два раза в день ежедневно.
Противостоял таблеточкам по 500 мг классический CMF.
Спойлер: на последнем ASCO было представлено интересное исследование по снижению дозы капецитабина. Читайте до конца, чтобы все узнать
Рандомизированное исследование фазы II Tempo Lung показало, что у пациентов с распространенным НМРЛ, которым не подходит химиотерапия первой линии на основе препаратов платины, метрономный пероральный винорельбин в фиксированной дозе 50 мг три раза в неделю продлевает медиану PFS без токсичности 4 степени (это, кстати, была первичная конечная точка) по сравнению со стандартной схемой 60–80 мг/м2 еженедельно: 4 (95% ДИ: 2,6–4,3) и 2,2 месяца (95% ДИ: 1,5–2,9).
Разумеется, есть исследования и с менее явными бенефитами. Например, исследование MOMA, где сравнивали поддерживающую терапию метрономным капецитабином 500 мг 3 раза в день и циклофосфамидом 50 мг/день+бевацизумаб с монотерапией бевацизумабом после 4 месяцев индукции FOLFOXIRI+бевацизумаб.
В Российской Федерации мы часто можем столкнуться с такими режимами метрономной терапии, как циклофосфамид, метотрексат, капецитабин, винорелбин и их комбинации. А применение таких режимов вы можете наблюдать при самых разных локализациях и нозологиях.
Можно только догадываться, почему так исторически сложилось и как давно метрономы живут в мире российской онкологии.
Да, возможно, есть красивые объяснения работы метрономов в теории, однако на практике мы можем не увидеть результата или навредить пациенту вовсе. Возможно, назначение метрономов кто-то может оправдывать желанием назначить что-нибудь, желанием помочь пациенту как-либо, когда стандартные дозировки не показаны.
Метрономные режимы “на ход ноги” в большинстве случаев обязаны своим существованием двум факторам:
1) недостаточному количеству времени на приём пациента и, как следствие, невозможностью объяснить, что настало время сипмтоматики, химиотерапия в такой ситуации лучше сделает вряд ли, а токсичности точно добавит;
2) отсутствию выстроенной логичной системы паллиативной помощи, которая естественным образом забирала бы в свои объятия пациентов, лечебные опции в отношении коих исчерпались (или даже не начинались). C'est la vie. – Прим. ред.
Скорее всего, вы найдете такие опции только для лечения распространенного рака молочной железы и в адъювантной терапии местнораспространенной назофарингеальной карциномы.
К сожалению, в настоящее время хорошо спланированные, многоцентровые, рандомизированные проспективные исследования практически отсутствуют.
Вопрос применения метрономов является открытым и, возможно, в будущем этот вид терапии нас еще сможет удивить. А может, и уже начал удивлять.
Свежий взгляд


На ASCO 2023 доложили весьма любопытные данные, которые могут свидетельствовать о возвращении метрономной терапии в ранг интригующих и подающих надежду
Данные 3-й фазы (3-я фаза, КАРЛ!) клинического исследования 2 линии терапии для опухолей головы и шеи показывают нам преимущество метрономного режима метотрексат+эрлотиниб+целекоксиб в сравнении со стандартными рекомендованными схемами терапии.
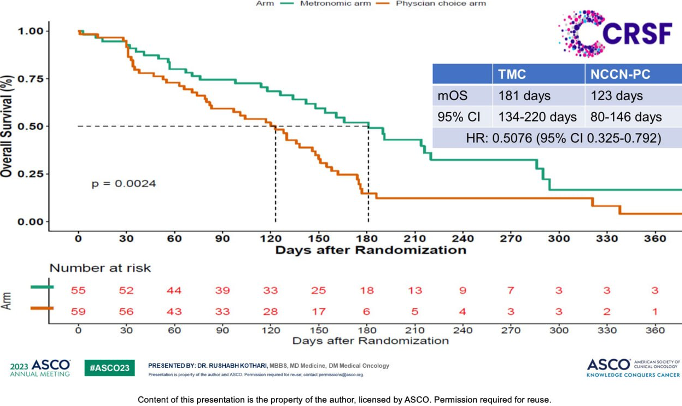
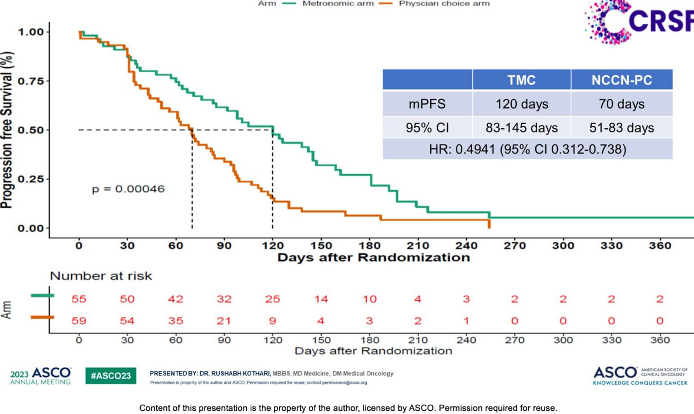
Также по горячим следам ASCO касательно метрономов замечено еще одно исследование X-7/7, посвященное метастатическому раку молочной железы, где исследовали применение фиксированной дозы (FD) капецитабина (1500 мг 2 раза в день, ежедневно в течение 7 дней, 7 дней перерыв) в сравнении со стандартной (SD) схемой (1250 мг/м2 2 раза в день, ежедневно в течение 14 дней, 7 дней перерыв).
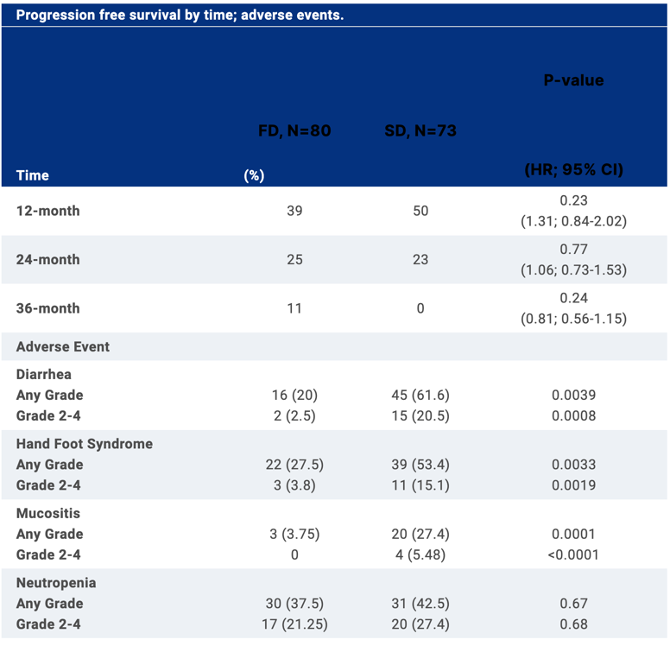
Впрочем, сами исследователи назвали режим “7 дней приём, 7 дней перерыв” dose dense…
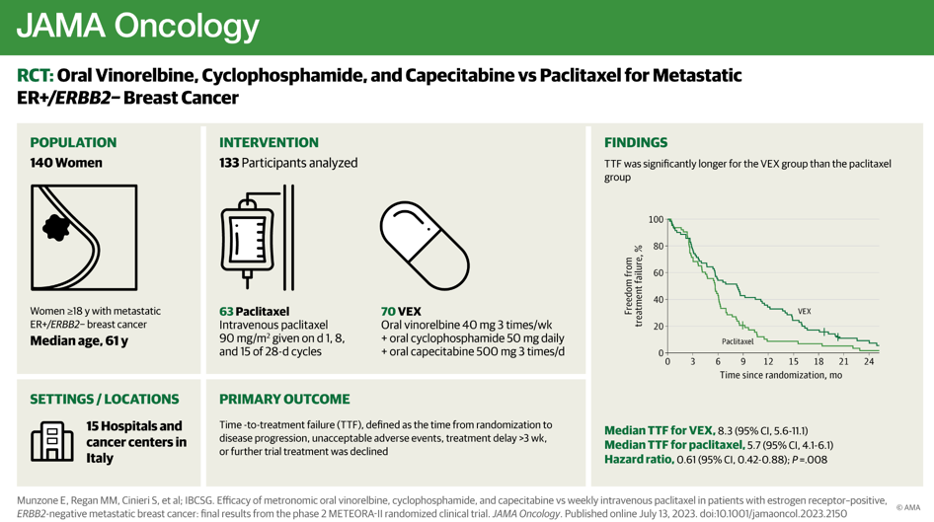
Еще одно занимательное исследование II фазы, представленное на ESMO 2022, а также опубликованное с окончательными результатами в июле 2023, METEORA-II, поднимает вопрос применения метрономного режима винорелбин+циклофосфамид+капецитабин у пациенток с ранее предлеченным, метастатическим, эстроген-позитивным, HER2-негативным раком молочной железы.
Контрольная группа получала еженедельно паклитаксел в стандартной дозировке.
- Первичной конечной точкой было время до наступления неэффективности лечения (TTF – time to treatment failure), определяемое как интервал между датой рандомизации и прекращением лечения ввиду прогрессии заболевания или непереносимости лечения или отказа пациентки от лечения
- Вторичными конечными точками были PFS (progression-free survival) и OS (overall survival)
По результатам исследования применение метрономного режима винорелбин+циклофосфамид+капецитабин (VEX) имело преимущество в сравнении с еженедельным введением паклитаксела.
Медиана TTF для пациенток, получавших VEX, составила 8,3 месяца в сравнении с TTF для пациенток, получавших паклитаксел, 5,7 месяца. 12-месячный интервал TTF был достигнул для 34,3% пациенток, получавших VEX, в сравнении с 8,6% для пациенток, получавших паклитаксел. Также была обнаружена статистически значимая разница в PFS: медиана для VEX составила 11,1 месяца против 6,9 месяца для паклитаксела. Разницы в OS выявлено не было.
Выводы:

- Метрономная химиотерапия – определенный режим применения химиопрепаратов, подразумевающий меньшую дозировку и более частое введение в сравнение со стандартными режимами.
- Для метрономной терапии чаще всего применяют пероральные цитостатики.
- Основными механизмами действия принято считать антиангиогенный эффект, воздействие на опухолевое микроокружение и активацию противоопухолевого ответа, цитостатический эффект (однако крупных и достоверных исследований in vivo практически нет).
- Наиболее изученные локализации рака для применения метрономной терапии – рак молочной железы, рак лёгкого, колоректальный рак.
- В РФ метрономная ХТ часто встречается в рекомендациях по различным нозологиям и применяется вне рамок доказательной медицины, в то время как мировые гайдлайны практически не содержат рекомендаций к применению метрономов.
- Несмотря на низкую токсичность данного режима нельзя считать, что она вовсе отсутствует.
- Метрономная химиотерапия может быть эффективна для определенных групп пациентов и требует дополнительного изучения