Лишний Вес После Отказа От Курения

💣 👉🏻👉🏻👉🏻 ВСЯ ИНФОРМАЦИЯ ДОСТУПНА ЗДЕСЬ ЖМИТЕ 👈🏻👈🏻👈🏻
Перевод: Джавохир Турамурадов, Александра Стеценко, Катерина Никитина, Cornu Ammonis
Редакция: Анастасия Нагорняк, Алиса Скнар
Рисунок 1 | Механизмы, обуславливающие снижение веса при курении сигарет
Снижение массы тела при курении можно объяснить увеличением энергетических затрат при отсутствии ожидаемого компенсаторного увеличения потребляемых калорий. Никотин способствует расходу энергии как за счет прямого воздействия на периферические ткани (данный эффект в значительной степени обусловлен катехоламинами), так и при помощи влияния на нейроэндокринные процессы, протекающие в ЦНС. Эффекты воздействия никотина в тканях головного мозга выражаются в подавлении аппетита; также курение само по себе может служить модулятором пищевого поведения, заменяя прием пищи.
AgRP — агути-подобный белок; CART — белок транскрипта, регулируемого кокаином и амфетамином; Epi — адреналин; ГАМК — γ-аминомасляная кислота; NEpi — норадреналин; NPY — нейропептид Y; ПОМК — проопиомеланокортин.
Рисунок 2 | Механизмы, за счет которых никотин обуславливает развитие резистентности к инсулину
Никотин подавляет активность 5'-АМФ-активируемой протеинкиназы (AMPK), способствует снижению количества потребляемой пищи и повышению теплопродукции. Также никотин оказывает потенцирующее воздействие на процесс липолиза и увеличивает доставку свободных жирных кислот (FFA) в печень и скелетные мышцы. Данные эффекты никотина ассоциированы с увеличением образования холестерина ЛПОНП в печени и накоплением жиров в миоцитах, а также с периферической инсулинорезистентностью. В культивируемых миоцитах линии L6, образующих мышечные трубочки, никотин оказывает воздействие на мишень рапамицина млекопитающих (mTOR) и киназу p70S6 (p70S6K), увеличивая их активность, а также вызывает повышенное фосфорилирование субстрата рецептора инсулина 1 (IRS-1) в положении Ser636 и снижает стимулируемый инсулином захват глюкозы клетками; ингибитор mTOR — рапамицин — блокирует данные эффекты никотина.
GLUT-4 — инсулинзависимый транспортер глюкозы 4; Н-ХР — Н-холинорецептор; PI3K — фосфатидилинозитол-3-киназа; p85 — регуляторная α-субъединица PI3K; p110 — каталитическая субъединица PI3K.
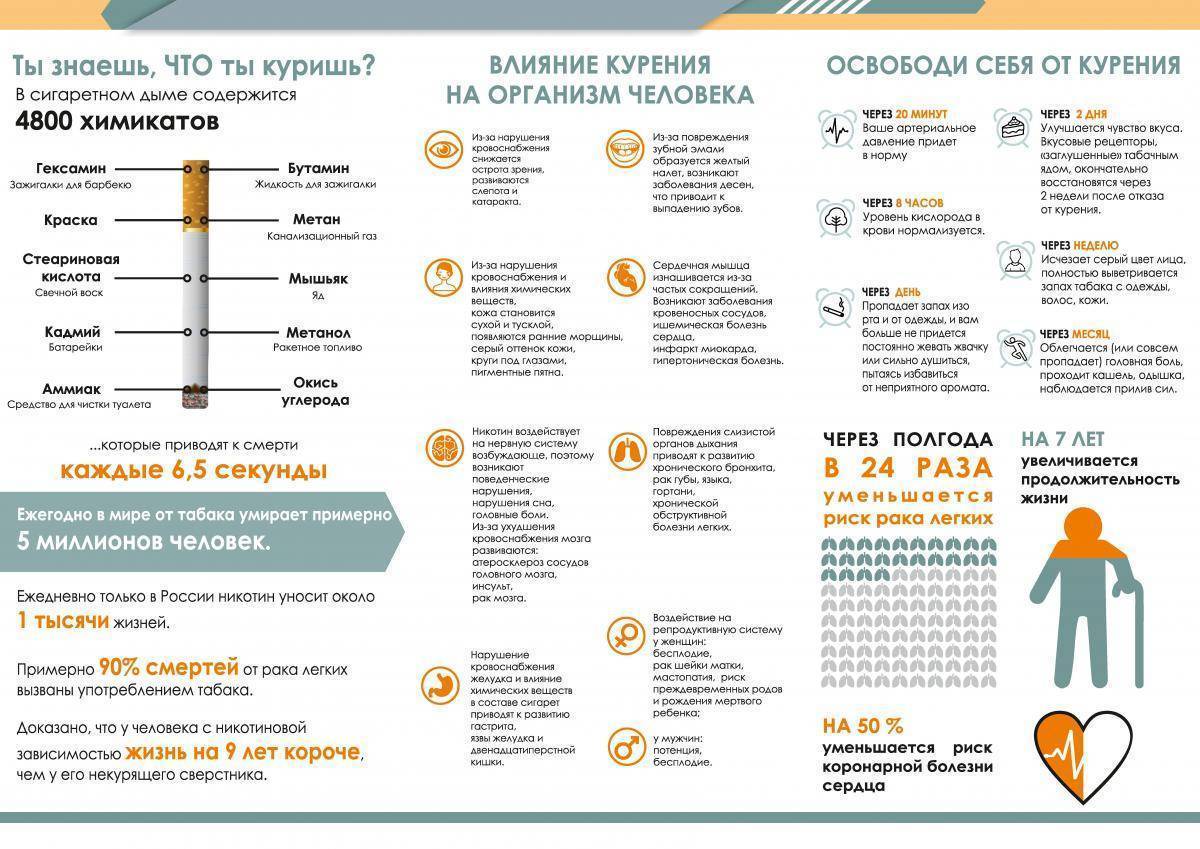
Рисунок 3 | Распространенность курения и ожирения
Данные показывают распространенность курения и ожирения среди совершеннолетних жителей штата Калифорния, США за период 1989–2009.
Вставка 1 | Основные результаты систематического обзора о наборе веса после прекращения курения [46]
Поиск данных (до января 2015) производился по пяти электронным базам данных. В обзор были включены популяционные проспективные когортные исследования, включавшие изменение веса с момента бросания курения до трех месяцев спустя, что в итоге составило 35 исследований с суммарным количеством в 63 403 участников, бросивших курить, и 388 432 курильщиков.
У бросивших курить наблюдалась четкая связь отказа от курения с набором веса; среднее увеличение массы тела у них составило 4,10 кг (ДИ 95 %, 2,69–5,51; P < 0,001 по сравнению с теми, кто продолжил курить), в то время как среднее увеличение ИМТ составило 1,14 кг/м² за пятилетний период (ДИ 95 % 0,50–1,79; P = 0,137 по сравнению с теми, кто продолжал курить).
Эти данные свидетельствуют о том, что набор веса является главным неблагоприятным последствием прекращения курения.
Однако набор веса не нивелирует благоприятные эффекты прекращения курения. Поэтому врачам следует продолжать рекомендовать пациентам прекращение курения для улучшения здоровья и устранения или ослабления неблагоприятных последствий для здоровья. Кроме того, клиницистам и исследователям стоит сосредоточиться на разработке и внедрении успешных программ по контролю веса для пациентов на любой стадии попыток прекратить курение.
Рисунок 4 | Набор веса на протяжении первого года попыток бросить курить
Группа точечной распространенности воздержания прекращения курения включает испытуемых, которые не могли длительно воздерживаться от курения, но не курили за 7 дней до тестирования. Средний возраст участников на момент начала исследования (n = 196) составил 44,5 года.
Рисунок 5 | Изменения ИМТ на протяжении 10 лет курения
Исходный возраст участников женского (n = 5 639) и мужского (n = 3 365) пола составлял 47,1 и 43,8 года соответственно.
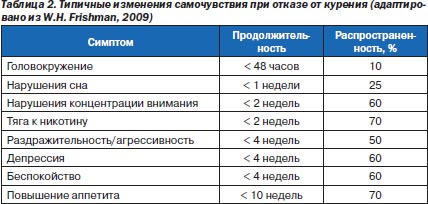
Таблица 1 | Отношение между стажем курения и метаболическим синдромом
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Абстракт | Несмотря на широкую осведомленность о негативном воздействии табака на здоровье, курение продолжает оставаться основной причиной предотвратимой смертности в США. Исследовательские данные показывают, что прекращение курения часто сопровождается постепенным набором веса и повышением чувствительности к инсулину. Однако, как бы парадоксально это ни звучало, ожирение, развивающееся после прекращения курения, может способствовать инсулинорезистентности. Более того, привес после отказа от курения является главной причиной, по которой курильщики, особенно женщины, не могут бросить курить или возвращаются к курению спустя непродолжительное время. В этом обзоре авторы обсуждают метаболические эффекты отказа от курения и освещают перспективы развития программ для прекращения курения и разработки методов лечения, уделяя при этом особое внимание уменьшению набора веса после отказа от курения.
Сокращение потребления табака или полное прекращение курения требует особого внимания в области здравоохранения на глобальном уровне. По оценкам ВОЗ, каждый год приблизительно 6 миллионов человек преждевременно умирают от болезней, связанных с курением, при этом большая часть смертности приходится на страны со средним и низким уровнем дохода [1].
В 2008 году ВОЗ представила практический и экономически эффективный способ уменьшения потребления табака во всем мире под названием MPOWER [1]. В список шести мер MPOWER входят:
Из 6 миллионов смертей от курения более 5 миллионов являются результатом прямого употребления табака и более 600 тысяч — результатом пассивного курения [1]. Курение связано с повышенным риском многих состояний, среди которых различные виды новообразований, сахарный диабет 2 типа (СД2), сердечно-сосудистые заболевания, хроническая обструктивная болезнь легких (ХОБЛ), врожденные пороки развития, негативное воздействие на репродуктивную функцию мужчин (например, эректильная дисфункция), остеопороз, переломы шейки бедра и позвоночника, а также общее ухудшение здоровья [2‒5]. Побочные эффекты табака у курящих женщин (снижение фертильности, преждевременные роды и внематочная беременность) встречаются чаще, чем у некурящих [5, 6], поскольку курение снижает уровень эстрогена в организме [7]. Более того, в 2015 году было показано, что курение и никотин связаны с повышенным риском несчастных случаев и суицидов. Связь с суицидом, вероятно, осуществляется через влияние никотина на уровень серотонина [8]. Некоторые канцерогенные эффекты никотина также были освещены в обзоре, опубликованном в 2014 году [9]. Помимо этого, пассивное курение связано с серьезными негативными последствиями, такими как низкая рождаемость у женщин, подвергающихся пассивному курению, синдром внезапной детской смерти и СД2 [10]. В 2012 году сообщалось о том, что пассивное курение связано как с СД2, так и с ожирением, тогда как активное курение связано только с СД2 [11].
Кроме того, курение приводит к значительным финансовым затратам для общества. В период с 2009 по 2012 год курение обошлось США в $289–332,5 млрд. (≈20 трлн. ₽), причем 46–53 % этой суммы пришлось на медицинское обслуживание взрослых, а остальное было потрачено из-за снижения производительности труда [5]. Таким образом, негативное воздействие курения приводит к снижению качества жизни и гибели людей и может привести к личным и государственным финансовым нагрузкам. Следовательно, отказ от курения является личной (для курильщиков), национальной и глобальной необходимостью. Один из наиболее значительных успехов в понимании связи между табачным дымом и сердечно-сосудистыми заболеваниями был достигнут в 1992 году в результате исследования, в котором использовались методы оценки инсулин-опосредованного поглощения глюкозы для того, чтобы показать, что курильщики имеют более высокую инсулинорезистентность (и компенсаторную гиперинсулинемию), чем некурящие [12]. У курильщиков также повышен уровень триглицеридов в плазме и понижен — холестерина ЛПВП [12]. С тех пор эти данные были воспроизведены в многочисленных исследованиях [13‒19] и подтвердили мнение о том, что резистентность к инсулину приводит к дислипидемии [20] и эндотелиальной дисфункции [21] у курильщиков. Курение также является основным фактором риска неалкогольной жировой болезни печени [22]. Будучи вариантом нормы для некоторых людей и животных, избыточное отложение жира в печени может привести к воспалению печени и рубцеванию, а в тяжелых случаях — к печеночной недостаточности [23‒25].
Чтобы понять влияние прекращения курения на обмен веществ, мы должны сначала понять влияние курения и никотина на массу тела и метаболические показатели. Курение и никотин непосредственно влияют на метаболизм глюкозы и массу тела в результате изменений в обмене веществ, активации липопротеинлипазы, расщепляющей триглицериды с образованием свободных жирных кислот, активации симпатической нервной системы и других изменений, приводящих к увеличению потребления энергии и потере веса [26]. Употребление никотина снижает аппетит и ускоряет обмен веществ, что приводит к потере веса у грызунов и людей [27]. Таким образом, употребление никотина может привести к снижению массы тела (Рис. 1) и другим метаболическим и эндокринным эффектам. К некоторым механизмам, с помощью которых никотин вызывает потерю веса, относят: прямую стимуляцию рецептора меланокортина-4 (MC4-R), что приводит к снижению потребления пищи [28] и к снижению уровня лептина в сыворотке [29, 30]; повышенную стимуляцию симпатической нервной системы, что приводит к увеличению уровней адреналина и норадреналина [31] (Рис. 1); активацию липолиза [32] (Рис. 2) и другие изменения [30‒32].
Снижение распространенности курения сопровождается увеличением распространенности ожирения, хотя причинно-следственная связь до сих пор не была показана (Рис. 3). Существует обратная дозозависимая связь между курением и ИМТ, причем некоторые курильщики имеют ИМТ ниже нормы [33]. С другой стороны, существует положительная корреляция между количеством выкуренных сигарет и накоплением абдоминального жира [34]; многие люди ценят способность никотина снижать массу тела [35]. В целом как активное, так и пассивное курение увеличивает риск СД2 [10]. Хотя использование электронных сигарет приводит к потере веса у мышей [36], пока не проводилось исследований по изучению влияния электронных сигарет на массу тела или гликемические показатели у людей.
Никотин-индуцированная потеря веса является результатом снижения передачи сигналов чувства голода в гипоталамусе и увеличения энергозатрат из-за повышенной двигательной активности, увеличения термогенеза в бурой жировой ткани, увеличения в ней экспрессии UCP1 и UCP3 и изменений в процессах утилизации субстратов энергии [29, 37]. На биохимическом уровне никотин вызывает потерю веса в результате инактивации 5'-АМФ-активируемой протеинкиназы (AMPK), контролирующей энергетический баланс клеток гипоталамуса [37].
Широкая осведомленность населения о негативных последствиях курения привела к уменьшению количества курящих людей среди представителей всех этнических групп в США [38]. Согласно статистическим данным, опубликованным в 2014 году, процент курящего взрослого населения США снизился с 20,9 % (2005 г.) до 17,8 % (2013 г.) [39]. При этом наилучшее состояние здоровья было отмечено у тех, кто отказался от курения как можно раньше [40]. Хотя потребление табачной продукции в целом снизилось, использование электронных сигарет, напротив, стало более распространено, особенно среди подростков [5, 41].
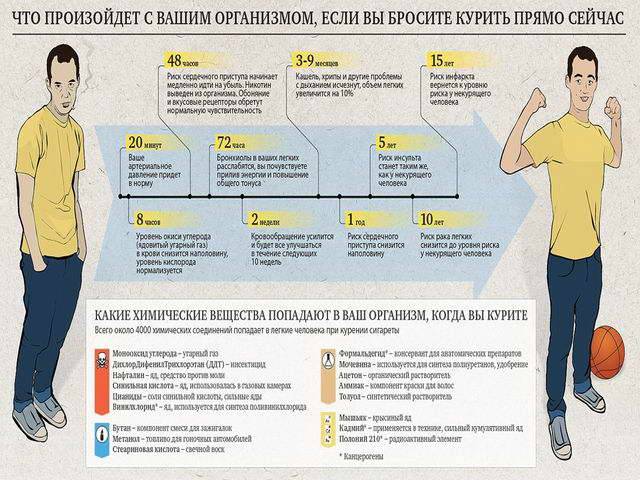
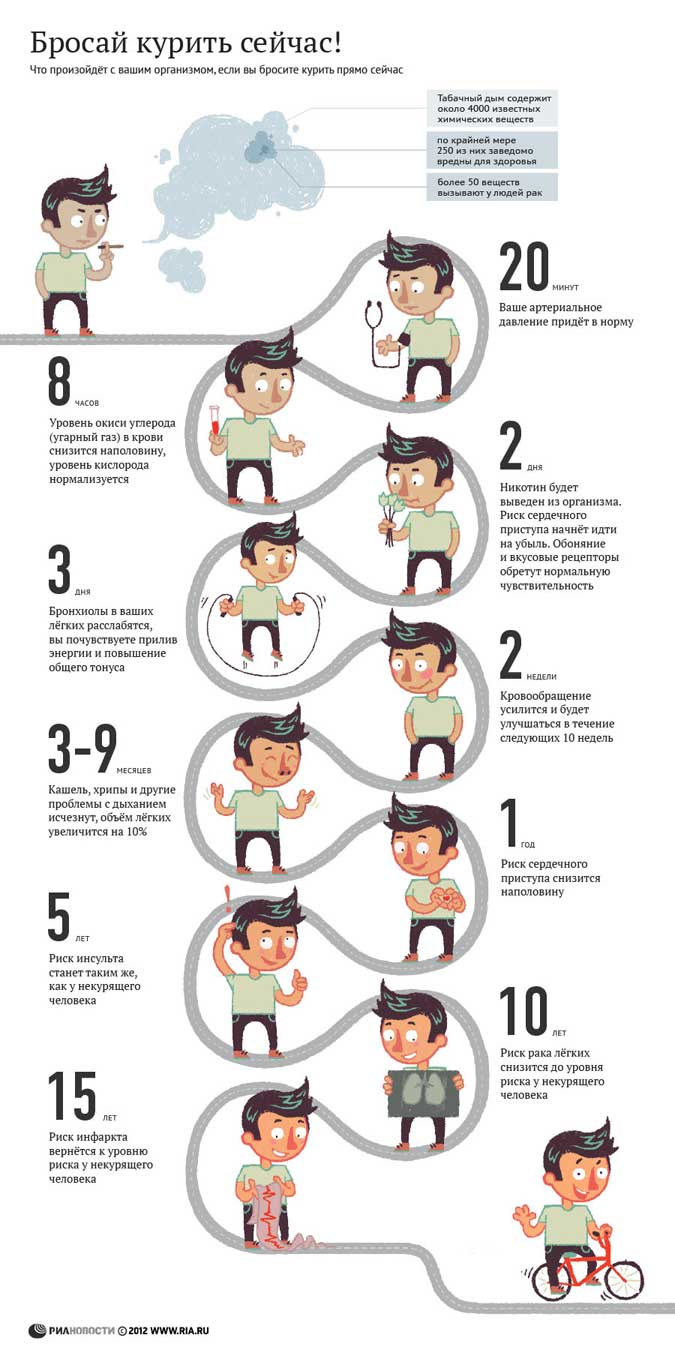
Научно обоснованные рекомендации для курильщиков, решивших бросить, предлагают различного рода стратегии по отказу от курения и могут быть полезны в преодолении данной зависимости [42], однако в реальных условиях курение было и остается тяжелым бременем, от которого сложно избавиться. Несмотря на то, что около 70 % курящих людей (как подросткового возраста, так и взрослых) заявляют о своем желании перестать курить, ежегодно только около 7 % из тех, кто пытается бросить курить самостоятельно, удается достичь устойчивого результата [43].
Имеющиеся в настоящее время на рынке продукты для прекращения курения (включая лекарственные средства и заменители табака) повышают шансы курильщика на преодоление зависимости при условии его личной заинтересованности в результате, но в действительности эффективность подобных средств остается довольно низкой [44]. Основной причиной, по которой зависимые от курения люди продолжают испытывать тягу к табаку, является действие никотина, вызывающее сильное привыкание [43]. При этом основным препятствием на пути избавления от зависимости оказывается прибавка в весе после отказа от курения, из-за чего курильщики, особенно женщины, не могут решиться на отказ от привычки или же возвращаются к курению снова вскоре после отказа [45]. Поэтому далее в нашем обзоре будут рассмотрены метаболические эффекты, вызванные отменой курения, с акцентом на увеличение массы тела.
Во вставке 1 обобщены результаты метаанализа, проведенного в 2015 году и отражающего увеличение веса у взрослых людей после отказа от курения [46]. По данным другого исследования [47], вес людей, зависимых от курения, был в среднем на 4‒5 кг меньше в сравнении с некурящими людьми, однако после отказа от привычки курильщики набирали около 4,5 кг за 6‒12 месяцев и значения массы их тела выравнивались с показателями кривой вес-возраст, наблюдаемой для некурящих людей (Рис. 4) [31]. Такое увеличение массы тела у бывших курильщиков может продолжаться вплоть до десяти лет после отказа от курения (Рис. 5) [31, 48]. Набор до 69 % веса в первые 3 месяца после прекращения курения объясняется повышением количества потребляемых за сутки калорий в среднем на 227 ккал [48]. Около 13 % людей, бросивших курить, набирали более 10 кг веса в год, причем наибольшая прибавка веса наблюдалась в первые месяцы после отказа от курения, а затем вес продолжал расти в течение шести месяцев и более [48]. Увеличение массы тела в период отказа от курения сопровождается, соответственно, и увеличением процента жировых отложений в организме [31]. В США к факторам риска, ассоциированным с набором веса после прекращения курения, относят: принадлежность к афро-американской этнической группе, возраст до 55 лет; предшествующую сильную табачную зависимость (курение > 25 сигарет в день), низкий социально-экономический статус, наличие факторов генетической предрасположенности (продемонстрировано в исследованиях на близнецах) [31]. Кроме того, следует учитывать, что многие курильщики уже имеют избыточный вес на момент начала их попыток бросить курить [33].
Результаты еще одного метаанализа, включающего 62 исследования, говорят об увеличении веса у курильщиков, которые воздерживались от курения как минимум в течение 12 месяцев [49]. Оказалось, что прибавка в весе после отказа от курения была гораздо большей, чем предполагалось ранее. Участники исследования, бросившие курить без помощи лекарственных средств (включая заменители никотина), в среднем набрали 1,1 кг за первый месяц и 2,3 кг за второй; вес продолжал расти и достигал прибавки 4,7 кг по прошествии 12 месяцев после отказа от курения. У 13 % человек прибавка в весе составила более 10 кг; при этом у 16 % бросивших курить, напротив, отмечалось снижение веса после прекращения курения [49]. Использование фармакологических препаратов не помогло умерить набираемый после отказа от курения вес. Таким образом, прибавление веса было сходным по динамике и у тех людей, кто не принимал никаких средств, и у тех, кто использовал заменители никотина, такие как бупропион или варениклин.
Хотя в среднем вес курящего человека меньше, чем у некурящего, тем не менее, процент людей с избыточным весом или ожирением среди курильщиков (включая тех, кто пользовался консультационными услугами горячей линии по вопросам отказа от курения [50]) в целом совпадает с распределением в некурящей популяции. Согласно исследованию с участием 595 человек, получивших консультацию по горячей линии, 206 человек имели нормальный вес (34,6 %), 182 — избыточный (30,6 %) и у 207 человек избыток веса соответствовал состоянию ожирения (34,8 %) [51]. Причем ожирением страдали в основном женщины, и их больше, чем мужчин, заботил вопрос прибавки веса после отказа от курения. Кроме того, что уже имеющие проблемы с лишним весом курильщики выражали опасения по поводу набора веса после прекращения курения, именно люди данной категории, в отличие от лиц без ожирения, сомневались в том, что смогут поддерживать свой вес в определенных рамках после отказа от привычки, и более негативно воспринимали перспективу еще большей прибавки в весе [51].
Набор пяти лишних килограмм после отказа от курения мог стать поводом для возвращения к привычке и причиной нежелания возобновить попытки бросить курить [33]. Несмотря на это, по результатам другого исследования, участниками которого стали 595 человек, обратившихся в службу горячей линии, не было отмечено стойкой взаимосвязи между исходным весом курильщика перед началом мероприятий по борьбе с привычкой и успехом в соблюдении терапевтических предписаний по отказу от курения, хотя отказ от курения и сопровождался набором веса [52]. В течение шести месяцев наблюдения у участников исследования было отмечено увеличение веса как во время активного лечения от зависимости, так и после него [52].
Проведенное в Оксфордшире (Великобритания) проспективное когортное клиническое исследование эффективности использования никотиновых пластырей против плацебо с последующим восьмилетним наблюдением показало, что отказавшиеся от курения участники за весь срок наблюдения набрали 8,8 кг веса [53], продолжавшие курить испытуемые набрали за тот же период времени 2,2 кг, а те, кто бросал и периодически снова возвращался к курению, набрали 3,3 кг. Испытуемые, которым удалось отказаться от курения, но не сразу (продолжали курить, согласно первой проверке через год после начала эксперимента, но по истечении срока восьмилетнего наблюдения более не являлись подверженными привычке курить), набрали 8,3 кг веса. Для курильщиков наблюдалась обратная линейная корреляция количества набранных килограммов со значением ИМТ (курильщики с более низким ИМТ набирали больше веса, чем те курильщики, чей ИМТ был выше), тогда как для курильщиков, отказавшихся от курения, график взаимосвязи увеличения веса с ИМТ имел вид J-образной кривой, причем наибольшие темпы набора веса наблюдались в первые шесть месяцев после отказа от курения [53].
Было изучено влияние половой принадлежности и количества выкуриваемых в день сигарет на набор веса в течение года после отказа от курения [54]. Так, в рамках одного из исследований была определена взаимосвязь между полом, возрастом и количеством выкуриваемых в день сигарет до отказа от курения и последующим изменением массы тела. Согласно результатам, участники, отказавшиеся от курения минимум на 40 недель, прибавили 4,6 кг веса, а те, кто прекратил курить на срок 20 недель и менее, прибавили 1,2 кг [54]. При этом наиболее молодые участники эксперимента (нижний терциль) набирали больший вес, чем самые возрастные участники эксперимента (верхний терциль). Среди заядлых курильщиков увеличение веса было наиболее выраженным у представительниц женского пола, тогда как среди тех, кто был подвержен привычке не так сильно (выкуривали меньше сигарет), больший вес набирали мужчины. Таким образом, полученные данные указывают на то, что молодые женщины, крепко привязанные к табакокурению, составляют группу с наибольшим риском набора веса после отказа от курения.
В одном из исследований был выявлен ряд факторов, связанных с набором веса после прекращения курения [55]. Было зафиксировано существенное увеличение ИМТ: если на первичном приеме значени
Отказ от курения и набор лишнего веса : правда или вымысел?
Прибавка в весе после отказа от курения
Увеличение веса при отказе от курения . - Здоровая Россия
Чтобы не рос живот: как бросить курить и не потолстеть
«Бросил курить – начал толстеть». Врач о том, как пережить синдром отмены
Определение Лишнего Веса
Корм Для Кошек С Лишним Весом
Сбросить Лишний Вес После
Лишний Вес После Отказа От Курения