История химиотерапии онкозаболеваний
Правда о прививкахЭто переработка поста, написанного нами в 2019 году.
История химиотерапии злокачественных опухолей началась не так давно, но корни её уходят в прошлое почти на 200 лет. В 1822 году Сезар Депре синтезировал вещество – дихлорированный этиленсульфид, или горчичный газ – которое оказалось сильнейшим ядом. В 1916 году Вильгельм Лёммель и Вильгельм Штайнкопф изобрели метод получения этого вещества в промышленных количествах, а уже через год, 12 июля 1917 года, Германская империя применила его во время одной из у бельгийского города Ипр, поэтому с тех пор оно носит название «иприт».
Это была не первое применение химического оружия – так, во время сражения при Болимове 31 января 1915 года применялись слезоточивые газы, а во время второй битвы за Ипр 22 апреля 1915 года применялся хлор.
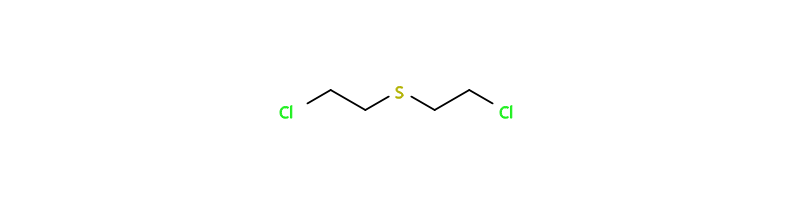
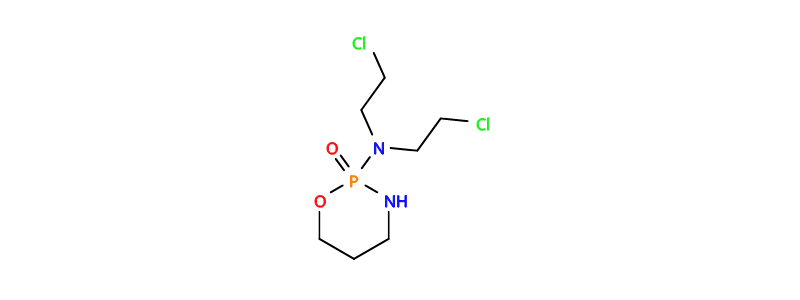
В процессе разработки похожих на иприт веществ были найдены ещё два: кислородный и азотистый иприты. Именно о последнем и пойдёт речь.
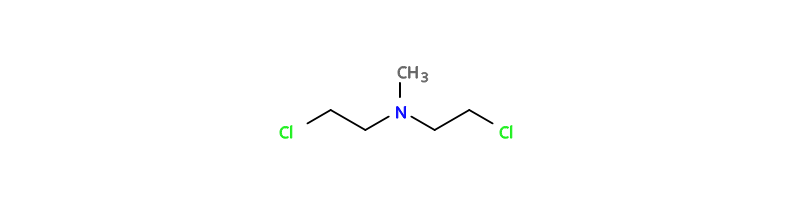
Механизм действия иприта – алкилирование ДНК (присоединение CH𝓃-группы со свободным электроном), за который ответственны хлорэтиловые группы –CH₂CH₂Cl. Наиболее существенным является наличие двух таких групп, поэтому у трёхвалентного азота третьей группой может быть что угодно, как, например, у хлорметина это –CH₃.
Рассмотрим механизм действия алкилирующих агентов немного подробнее. Вначале происходит образование этилениминового кольца:
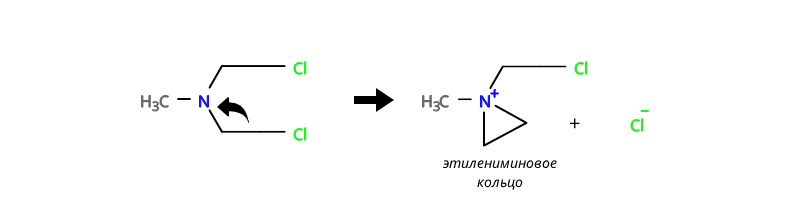
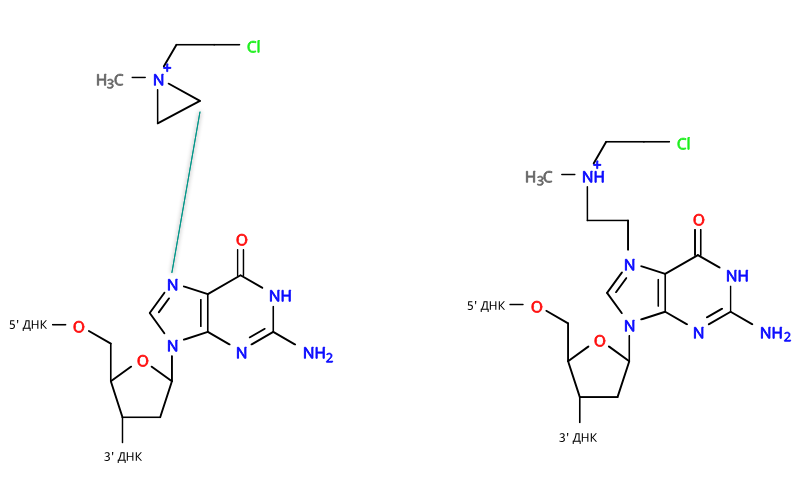
Это нестабильное этилениминовое кольцо стремится присоединиться к нуклеотиду, «кирпичику» ДНК:
Льюис Гудман и Альфред Гилман из Йельского университета начали изучать медицинское применение трёх вариантов азотистых ипритов в 1942 году. Исследования на мышах показали ремиссию злокачественных опухолей – и вскоре эти препараты, начиная с показавшего максимальную эффективность хлорметина, были испытаны на людях.
Для некоторых видов опухолей – например, гематологических – на то время просто не существовало никакого лечения.
Эмалированное судно, окошко, тумбочка, кровать, – жить тяжело и неуютно, зато уютно умирать. // Борис Рыжий
Хлорметин и другие азотистые иприты действительно действовали на эти опухоли – при этом, конечно, повреждая и здоровые клетки. К сожалению, первоначальный регресс злокачественных новообразований сменялся рецидивом, а новообразование становилось резистентным к хлорметину и другим азотистым ипритам.
Некоторые из найденных лекарств были достаточно удачными – например, циклофосфамид, который и по сей день входит во многие основные схемы лечения различных опухолей.
Основное отличие раковых клеток от нормальных – стремительное размножение, т.е. постоянное многократное деление. Раковые клетки настолько быстро делятся, что не успевают ни созреть, сформировав поверхностные структуры, а иногда даже обзавестись нужным количеством кровеносных сосудов.
Противоопухолевые препараты так или иначе мешают клеткам делиться. В первую очередь страдают раковые клетки, но и здоровым тканям организма приходится перенести трудные времена, пока идёт лечение. Поэтому побочные эффекты химиотерапии связаны с быстро обновляющимся тканями: эпителий кишечника, внутренняя выстилка стенок сосудов (особенно таких обильных и нежных, как в почках), волосяные луковицы и половая система. Также страдает кроветворная функция, потому что кровяные тельца приходится постоянно пополнять из стволовых клеток костного мозга.
Эти побочные эффекты можно снизить, используя подбираемые для каждого случая комплексы препаратов, и большую помощь оказывает гормонотерапия.
Другой класс цитостатических препаратов – это антиметаболиты, вещества, которые ингибируют (замедляют/подавляют) процессы, критически важные для размножения клеток опухоли.
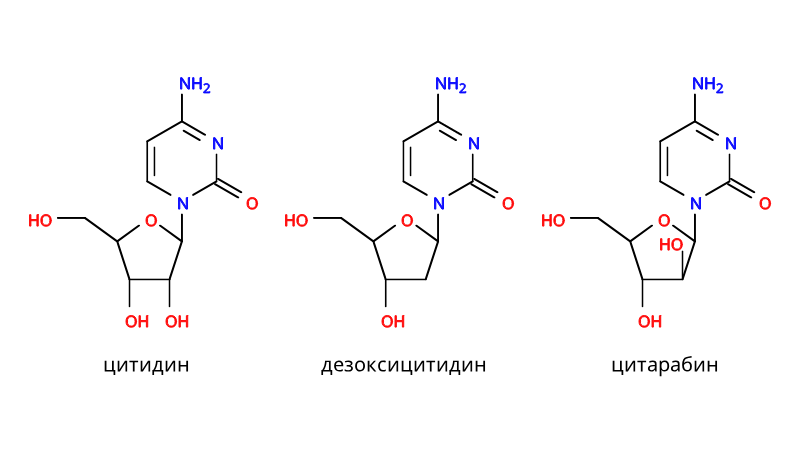
К антиметаболитам можно отнести аналоги нуклеозидов («кирпичиков», из которых строится ДНК). Полимераза пытается использовать эти вещества в процессе синтеза нуклеиновой кислоты, однако не может завершить процесс, потому что они отличаются от нуклеозидов. Примером такого вещества может служить аналог цитидина цитарабин, применяемый в онкогематологии.
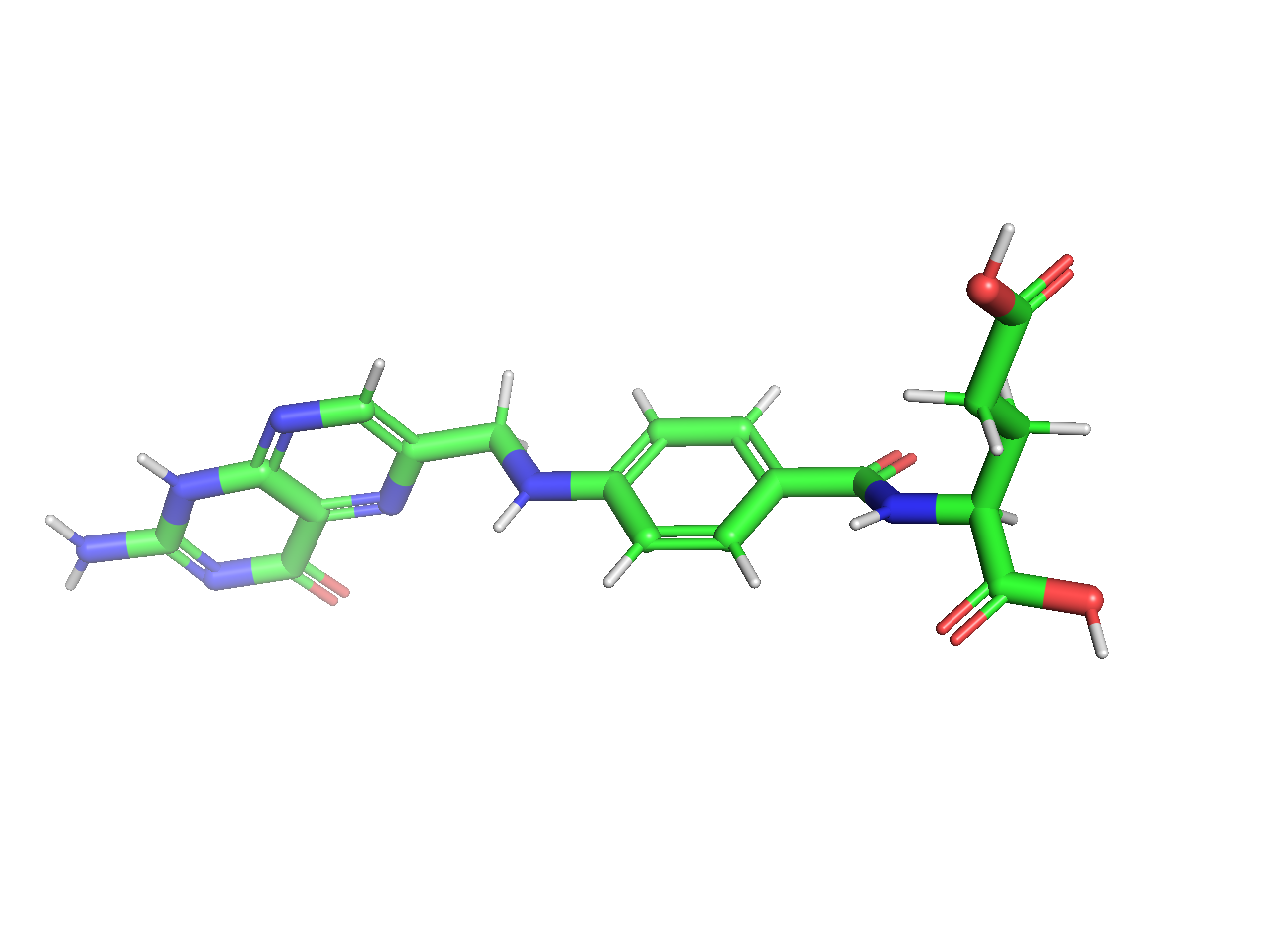
Другой пример антиметаболитов – метотрексат, антагонист фолиевой кислоты (витамина B9). Метотрексат структурно схож с фолиевой кислотой, поэтому он необратимо связывается с дигидрофолатредуктазой – ферментом, который восстанавливает одно производное фолиевой кислоты (фолата) – дигидрофолат – в тетрагидрофолат (активную форму фолиевой кислоты). В результате дигидрофолатредуктаза не может вступить в реакцию с дигидрофолатом и не может преобразовать его в тетрагидрофолат, необходимый для постройки ДНК. Метотрексат в низких дозах не обладает заметной гематологической токсичностью и может употребляться в качестве иммуносупрессивного препарата.
Поскольку, как мы уже говорили, новообразования умеют вырабатывать резистентность (устойчивость) к химиотерапии, схемы лечения включают в себя не один препарат, а несколько. Так, например, одна из типичных схем лечения неходжкинской лимфомы включает в себя циклофосфамид, доксорубицин, винкристин и преднизолон.
В рамках нашего небольшого обзора мы, конечно же, не можем охватить все классы цитостатических препаратов. Однако даже рассмотренных веществ достаточно, чтобы составить общее представление об основных принципах химиотерапии злокачественных опухолей.