Исследование ORATOR: TORS против химиолучевой терапии
https://t.me/headneckjcЖурнальный клуб
Разбор статьи
Radiotherapy versus transoral robotic surgery and neck dissection for oropharyngeal squamous cell carcinoma (ORATOR): an open-label, phase 2, randomized trial
Anthony C Nichols, Julie Theurer, Eitan Prisman, Nancy Read, Eric Berthelet, Eric Tran, Kevin Fung, John R de Almeida, Andrew Bayley, David P Goldstein, Michael Hier, Khalil Sultanem, Keith Richardson, Alex Mlynarek, Suren Krishnan, Hien Le, John Yoo, S Danielle MacNeil, Eric Winquist, J Alex Hammond, Varagur Venkatesan, Sara Kuruvilla, Andrew Warner, Sylvia Mitchell, Jeff Chen, Martin Corsten, Stephanie Johnson-Obaseki, Libni Eapen, Michael Odell, Christina Parker, Bret Wehrli, Keith Kwan, David A PalmaThe
Lancet, 12 August 2019
Введение. Трансоральная роботизированная хирургия (TORS) с одномоментной шейной лимфодиссекцией вытеснила лучевую терапию в США в качестве наиболее распространенного метода лечения орофарингеальной плоскоклеточной карциномы, однако ни одно рандомизированное исследование не сравнило эти методы. Мы поставили цель оценить различия в качестве жизни (КЖ) через 1 год после лечения.
Метод.Исследование ORATOR было инициированным исследователями многоцентровым международным открытым рандомизированным исследованием II фазы с параллельными группами. Пациенты набирались в исследование в шести больницах в Канаде и Австралии. Мы случайным образом распределили (1:1) пациентов в возрасте 18 лет и старше со статусом ECOG 0–2 и с плоскоклеточным раком ротоглотки T1–T2, N0–2 (≤4 см) для лучевой терапии (70 Гр, с химиотерапией, если N1–2) или трансоральная роботизированная хирургия с шейная лимфодиссекцией (с адъювантной химиолучевой терапией или без нее, в зависимости от данных гистологического исследования). После стратификации по статусу p16 пациенты были рандомизированы с использованием созданного компьютером списка рандомизации с переставленными блоками из четырех человек.
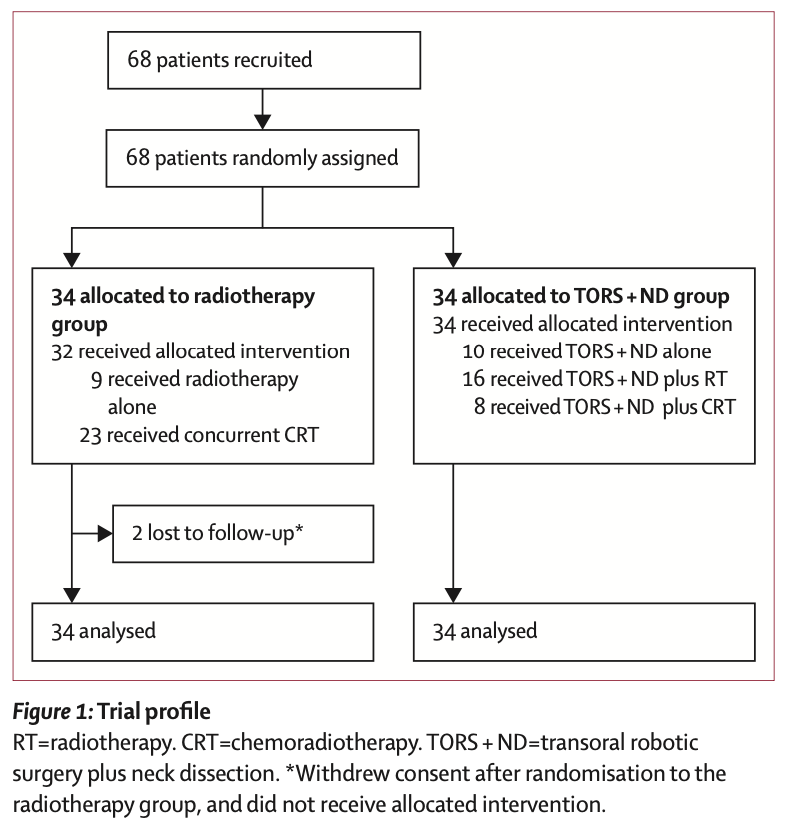

Первичной конечной точкой было качество жизни, связанное с глотанием, через 1 год, установленное с использованием шкалы MD Anderson Dysphagia Inventory (MDADI), способной выявить улучшение на 10 баллов (клинически значимое изменение) в группе трансоральной роботизированной хирургией с шейной лимфодиссекцией. Результаты оценены в соответствии с концепцией intention to treat analysis. Данное исследование зарегистрировано на ClinicalTrials.gov (NCT01590355) и активно, но в настоящее время набор участников не ведется.
Результаты. Шестьдесят восемь пациентов были рандомизированы (по 34 на группу) в период с 10 августа 2012 г. по 9 июня 2017 г.
Медиана наблюдения составила 25 месяцев (межквартильный интервал 20–33) для группы лучевой терапии и 29 месяцев (23–43) для группы трансоральной роботизированной хирургией с шейной лимфодиссекцией .
Общий балл MDADI через 1 год составил в среднем 86,9 (SD 11,4) в группе лучевой терапии по сравнению с 80,1 (13,0) в группе трансоральной роботизированной хирургией с шейной лимфодиссекцией (p=0,042).

Было больше случаев нейтропении (6 [18%] из 34 пациентов против 0 из 34), потери слуха (13 [38%] против 5 [15%]) и шума в ушах (12 [35%] против 2 [6%]. ]) в группе лучевой терапии, чем в группе трансоральной роботизированной хирургией с шейной лимфодиссекцией, и о большем количестве случаев тризма в группе трансоральной роботизированной хирургией с шейной лимфодиссекцией (9 [26%] против 1 [3%]).
Наиболее частыми побочными эффектами в группе лучевой терапии были дисфагия (n = 6), потеря слуха (n = 6) и мукозит (n = 4), все степени 3, а в группе трансоральной роботизированной хирургией с шейной лимфодиссекцией — дисфагия (n = 9, все 3 степени) и один летальный исход от кровотечения после трансоральной роботизированной хирургии.
Заключение. Пациенты, получавшие лучевую терапию, показали более высокие показатели качества жизни, связанные с глотанием, через 1 год после лечения, хотя разница не была клинически значимой. Структура осложнений (побочных эффектов) различались между группами. Пациенты с плоскоклеточным раком ротоглотки должны быть проинформированы об обоих вариантах лечения.
Сильные стороны
Многоцентровое рандомизированное исследование, в ходе которого удалось успешно набрать участников, несмотря на предыдущую неудачу исследования RTOG 1221.
• Размер выборки рассчитан для обнаружения конкретной конечной точки — улучшение качества жизни, связанного с глотанием (MDADI на 10 пунктов)
• Включение малого количества первичных пациентов с отсутствием экспрессии p16 отражает реальную ситуацию, когда пациенту, вероятно, по-прежнему будет предложена трансоральная роботическая хирургия по сравнению с первичной химиолучевой терапией.
Ограничения
- Небольшая медиана наблюдения означает, что отдаленные побочные эффекты в группах лечения, вероятно, не представлены. Сравнение показателей общей и безрецидивной выживаемости также необходимо учитывать с учетом того, что исследование не было способно обнаружить эту разницу.
- Лечение рака миндалин и основания языка имеет существенно разные профили побочных эффектов, но размер выборки слишком мал, чтобы можно было провести подгрупповой анализ.
- Неясно, у скольких пациентов в каждой группе было одностороннее облучение шеи по сравнению с двусторонним облучением.
- Не приводится обоснование требования, чтобы узлы были 4 см или меньше, без экстранодального распространения.
- О количестве профилактических трахеостомий не сообщалось, и это не является репрезентативным для большинства хирургических клиник.
- Использование адъювантной лучевой терапии для любых положительных лимфоузлов, вероятно, считается агрессивным по стандартам 2019 года и, следовательно, может не быть во многих лечебных учреждениях.