Иммуногистохимия
https://t.me/ad_researchИтак, не секрет, что мы состоим из множества разных молекул, отличающихся друг от друга по строению. Чтобы их идентифицировать и визуализировать в клетках или тканях используют антитела, распознающие какие-то специфические эпитопы в целевых молекулах. Допустим, мы в лаборатории сделали искусственный орган и хотим узнать, делятся в нём клетки или нет, а если делятся, то где именно. Для этого понадобится гистологический срез и какой-нибудь маркер пролиферации, например, белок Ki67. Идентифицировать белок в ткани мы сможем с помощью первичных антител, которые будут связываться только с ним и больше ни с чем другим (в идеале).

Для получения таких антител животному (как правило кролику, мыши и крысе) вводят нужный антиген (в нашем случае Ki67) и затем выделяют плазматические клетки, синтезирующие антитела. Иммунизированное животное называют хозяином антител (англ. host). Потом клетки иммортализуют путём слияния с раковыми клетками, и полученные гибридомы уже постоянно синтезируют необходимые нам антитела. Если антитела получают из клонов одной плазматической клетки, то их называют моноклональными, а если из нескольких – то поликлональными. Моноклональные антитела более специфичны, то есть не будут распознавать другие антигены. Однако, если при процессинге образца эпитоп сильно изменился, то они теряют способность с ним связываться. В таких случаях может помочь демаскировка антигенов (antigen retrieval), хотя она всё равно не гарантирует результат. Поликлональные антитела менее специфичны, но они способны связываться с разными эпитопами одного антигена, поэтому если один из них повредится - то ничего страшного.

Но нам мало связывания антител с целевым антигеном, это же надо ещё как-то увидеть. Для этого используются специальные метки: ферментные (например, пероксидаза хрена) или флуоресцентные. Метка может быть связана с первичными антителами, но чаще всего для увеличения чувствительности окрашивания используют вторичные антитела, несущие метку. В этом случае с одним первичным антителом могут связываться несколько вторичных, что позволяет усилить сигнал.

Вторичные антитела производятся также как и первичные с разницей в том, что животное иммунизируют с помощью антител хозяина первичных. То есть, если наши антитела против Ki67 были сделаны в кролике, то вторичные антитела должны распознавать константный участок кроличьих антител. И они так и будут называться: anti-rabbit antibodies. Производятся они уже не кролике (кролик же не будет защищаться от своих же белков), а например, в овце или осле. Как правило не рекомендуется использование вторичных антител, против того же животного, образцы тканей которого окрашиваются, поскольку это даёт сильный неспецифичный сигнал. Однако, на некоторых тканях (например, хрящ, мозг или эмбрионы) и при модификации протокола (расскажу в конце в лайфхаках) такое окрашивание возможно.
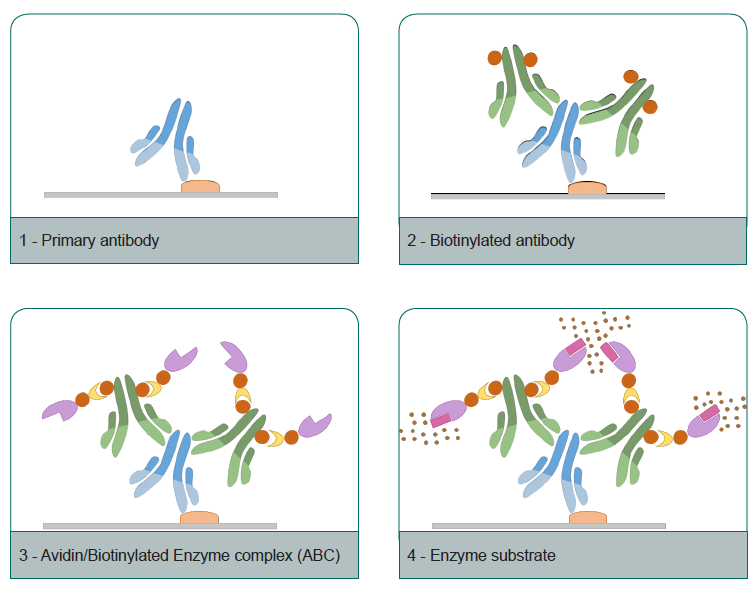
Теперь про метки. В качестве ферментных меток чаще всего используют пероксидазу хрена, реже щелочную фосфатазу и другие ферменты. Такие метки расщепляют субстрат с образованием окрашенного продукта, который визуализируется с помощью светового микроскопа. Сама пероксидаза может быть конъюгирована с антителом и после связывания с антигеном добавляется субстрат. Однако данный метод не очень чувствителен, поэтому чаще используют авидин-биотиновый или стрептавидин-биотиновый комплекс, включающий в себя несколько молекул фермента. В этом случае антитела связаны с биотином, затем к ним добавляется комплекс авидина/стрептавидина и биотинилированного фермента и только после этого субстрат. Авидин может связывать до 4 молекул биотина, что способствует усилению сигнала.
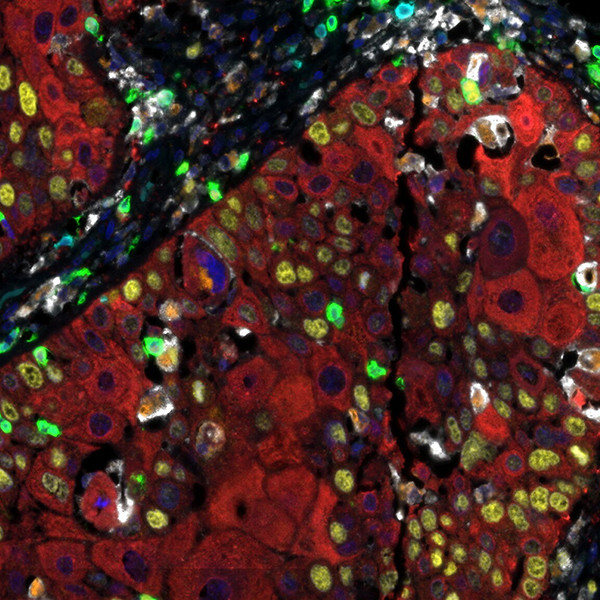
Помимо ферментной метки, антитела могут быть конъюгированы с флуоресцентными метками. Такие метки менее долговечны и могут быть визуализированы только с помощью флуоресцентного или конфокального микроскопа, однако с ними возможно многоцветное окрашивание нескольких антигенов, а сама процедура несколько проще. Можно получать вот такие крутые картинки:
Случается такое, что первичные антитела связываются не с тем эпитопом или не связываются вообще. Вторичные антитела тоже могу сесть куда не надо и дать неспецифический сигнал. Поэтому при отработке протоколов, особенно на новых образцах и для новых антител важно ставить положительные и отрицательные контроли. Например, я часто оцениваю наличие маркера хондроцитов Sox9 в выращенных в пробирке хрящах и в качестве контроля беру ткани здорового колена: в хряще окрашивание на Sox9 должно быть положительным, а, например, в мышцах его быть не должно. Важно проверять также локализацию белка. Если сигнал после окрашивания на ядерный белок Ki67 окажется где-то в цитоплазме - то что-то пошло не так.

Таким образом, чтобы быть уверенным в результате иммуногистохимического окрашивания:
1. Сигнал должен быть чётким и хорошо отделимым от фонового окрашивания/аутофлуоресценции.
2. Сигнал должен детектироваться только в местах локализации белка.
3. Сигнал должен детектироваться только в тех клетках, где белок заведомо должен присутствовать и отсутствовать во всех остальных.
Здесь оставлю ссылочку на общий протокол иммуногистохимии, но он может очень сильно отличаться для разных образцов и разных антигенов. Как правило в лабораториях уже есть проверенные годами протоколы для конкретных антител, но для чего-то новенького иногда приходится отрабатывать их самостоятельно и/или искать варианты по статьям.

А теперь немного лайфхаков. Какие-то могут быть уже знакомы, но вдруг найдёшь что-то полезное.
1. Окрашивание проходит во влажной камере на горизонтально лежащих срезах и я видела как её делают из чашки Петри и влажной бумаги. Использование обычных коробок для хранения стёкол гораздо удобнее, главное чтобы бортики были прямыми

2. При использовании флуоресцентной метки в морозилке окрашенные образцы хранятся сильно дольше. Мой рекорд - полтора месяца для окрашивания на модифицированные гистоны, причём уже окрашенные срезы были перевезены на самолёте из Швеции
3. Если так случилось, что источник окрашиваемой ткани и хозяин неконъюгированных первичных антител одинаковый и есть большой риск неспецифичного связывания, то можно:
а) PBS заменить на TBS
б) увеличить количество сыворотки в блокирующем буфере до 6% и время блокировки до 4 часов
в) уменьшить время инкубации со вторичными антителами до 1 часа
г) если метка флуоресцентная - лучше брать конъюгированную с дальним красным флуорофором, например Alexa 647. Да и в целом, в случае аутофлуоресценции и какой-то неспецифики дальний красный сильно спасает.
д) использовать сыворотку из того же хозяина, в котором произведены вторичные антитела.
Меня выручало в случае mouse-on-mouse и rabbit-on-rabbit окрашивания.
4. Для уменьшения количества наносимых растворов используются всякие гидрофобные штуки типа парафиновых мелков или специального гистомаркера (PAP pen). Сейчас хороший гистомаркер стоит в районе 50+ тысяч, китайские просто ужасные. Я использую маркер-краску, вполне себе сдерживают капли воды. Кстати, он также незаменимая вещь при работе в стерильных ламинарах: надписи сделанные спиртовыми перманентными маркерами стираются после дезинфекции этанолом.
5. Один из самых частых способов демаскировки - это кипячение в цитратном буфере. От него иногда срезы слетают со стекла, поэтому можно попробовать следующее:
а) кипятить срезы в скороварке или автоклаве. Из-за давления не образуются пузырьки и срезы не повреждаются
б) кипятить срезы в горизонтальном положении с нанесённым буфером в термостате
в) наливать только вскипевший буфер сразу на срезы и так минимум 5 раз
г) 5 минут демаскировки при 95-97С заменяются 20 минутами при 92-95С. Как правило срезы чуть лучше переживают более маленькие температуры
6. Флуоресцентные вторичные антитела производители рекомендуют хранить на +4С в холодильнике. Но так они сдохнут за пару лет, поэтому их можно растворить не в буфере, как рекомендуется, а в буфере с 40% глицерином и хранить аликвоты на -20С.
7. А это очень полезный сайт с разными протоколами для иммуногистохимии, я оттуда натаскала всяких демаскировок и с ними иногда получается заставить работать даже китайские антитела (Affinity Biosciences настоятельно не рекомендую)