HRD talks
HSO talks
Автор: Яна Белышева
Администратор: Элина Добросоцкая
Фактчекер: Гузель Рафикова
Верстальщик: Альбина Загидуллина
О чём мы будем говорить?
Ингибиторы PARP (PARP inhibitors, PARPi) входят в стандарты лечения многих опухолей, в том числе рака молочной железы, яичников, поджелудочной и предстательной желёз. К основным предиктивным маркерам чувствительности к PARPi относят герминальные и соматические мутации генов репарации путём гомологичной рекомбинации (homologous recombination repair, HRR). Однако мы не всегда можем сказать, чувствительна ли опухоль с конкретной мутацией в определённом гене HRR к PARPi. Также опухоль может иметь изменения, недетектируемые с помощью стандартного NGS (например, метилирование промотора какого-либо гена HRR). Это приводит к необходимости создания маркера, который бы показывал потенциальную чувствительность к PARPi без чётко установленной генетической или эпигенетической причины, т.е. являлся бы “биологическим следом” нарушенной геномной стабильности клеток. Такой “след” уже активно используется в клинической практике: это дефицит гомологичной рекомбинации (homologous recombination deficiency, HRD). Однако с таким сложным феноменом, как HRD, ещё есть много нерешённых проблем: отсутствие общепринятого определения, разнообразие тестов с разными оцениваемыми параметрами, отсутствие у большинства из них клинической валидации, высокая стоимость и длительность выполнения, особенности самого тестирования и так далее. В статье мы немного погрузимся в фундаментальную онкологию, молекулярно-генетическую диагностику и разберём ключевые исследования в этой области. Пристегните ремни – и поехали!
Что такое HRD? От основ до глубин молекулярной биологии.
ДНК постоянно находится под воздействием внешних факторов и внутренних процессов, в том числе репликации ДНК, формирования свободных радикалов, которые приводят к различным её повреждениям. Такими поломками могут стать точечные мутации, двухцепочечные и одноцепочечные разрывы, межнитевые и внутринитевые сшивки. Эти повреждения исправляются различными системами репарации, что поддерживает стабильность генома.
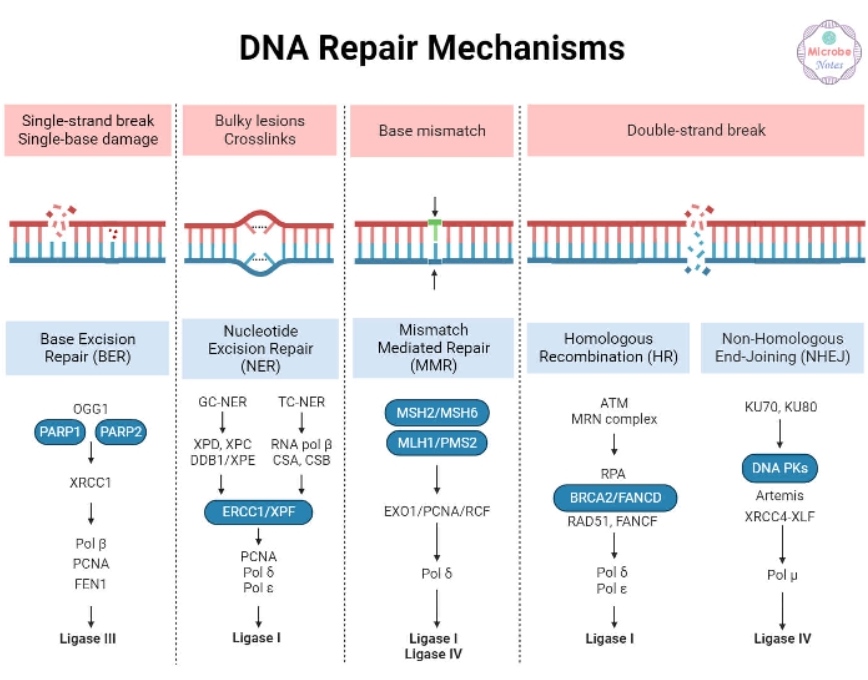
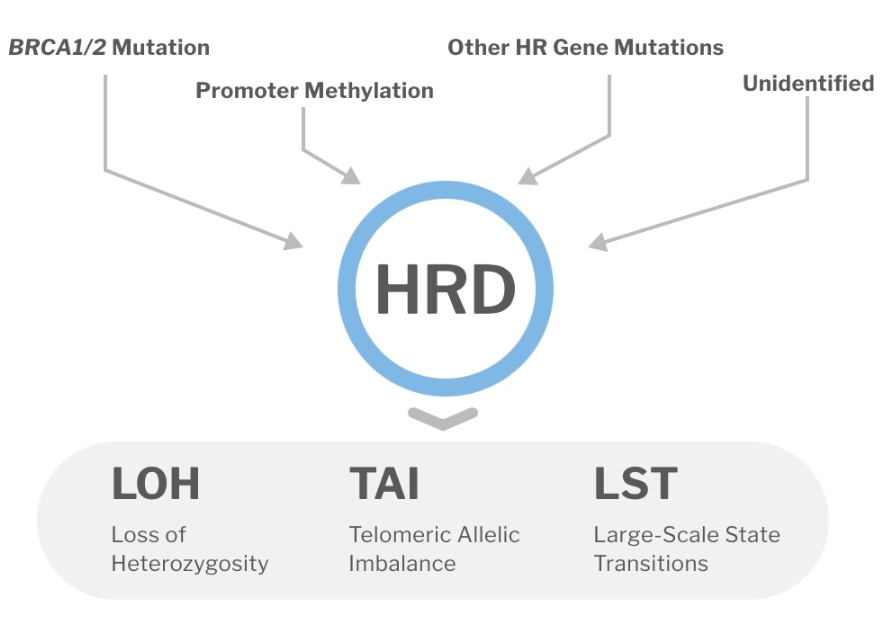
Гомологичная рекомбинация (homologous recombination, HR или HRR) – это механизм репарации двухцепочечных повреждений ДНК, при котором в качестве матрицы для исправления используется сестринская хроматида, что обеспечивает минимальный уровень ошибок. О работе белков HRR мы более подробно поговорим в отдельной статье. Клетки с дефицитом гомологичной рекомбинации (HRD) неспособны эффективно исправлять двухцепочечные разрывы, так как используют другие, менее эффективные системы репарации. Таким образом, клетки накапливают большое количество изменений, что ещё называется геномной нестабильностью. Дефицит гомологичной рекомбинации обычно вызван герминальными и соматическими мутациями генов HRR (чаще BRCA1 и BRCA2), но может быть обнаружен и без них. Причиной этого могут быть, например, эпигенетические изменения.
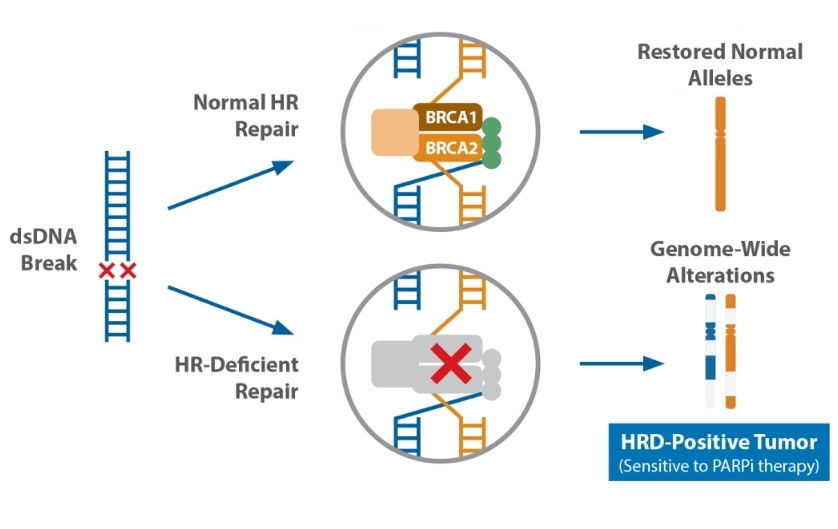
Эти знания начали активно применяться в клинической практике с появлением принципа синтетической летальности. Синтетическая летальность – это ситуация, когда инактивация одного из двух белков не оказывает значительного влияния на жизнедеятельность клетки, а инактивация сразу двух приводит к гибели. Обычно это два белка, которые функционально дополняют друг друга. Первым примером использования принципа синтетической летальности в онкологии стало использование ингибиторов PARP1 в BRCA-мутированных опухолях.
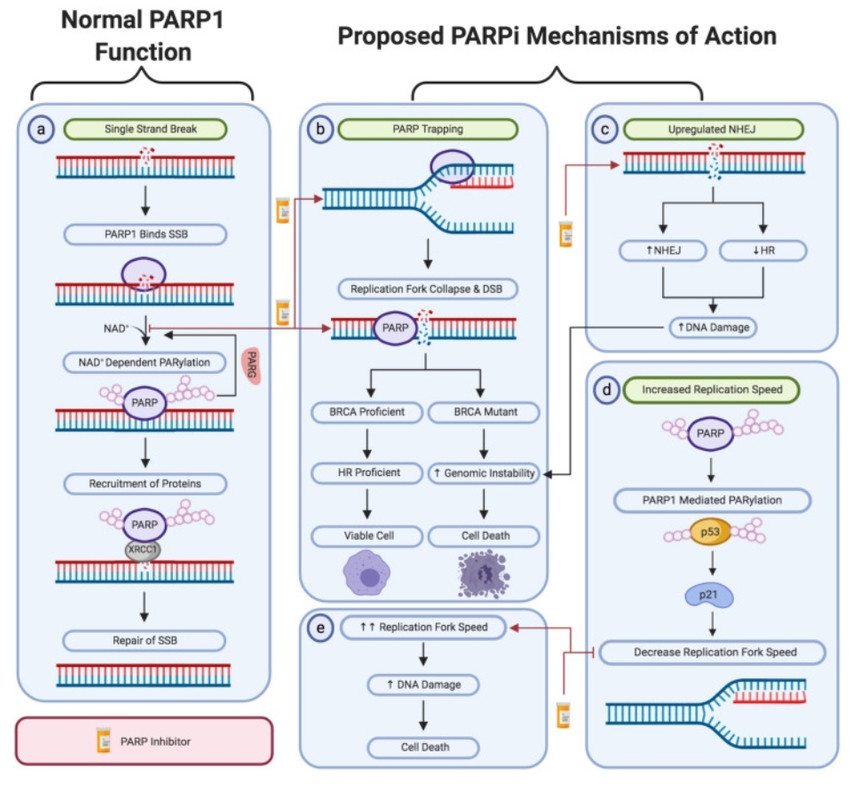
ДНК в области репликационной вилки подвержена одноцепочечным разрывам, устраняемым за счёт активности PARP1, который распознаёт повреждение и привлекает другие белки репарации к этому месту. Действие PARPi связывают с несколькими механизмами:
- Ингибирование PARP1 приводит к коллапсу репликационной вилки и формированию двухцепочечного разрыва, который должен быть исправлен системой HRR. BRCA-дефицитные клетки не способны устранять такие повреждения.
- PARPi как бы связывают белок PARP1 с ДНК в месте повреждения, физически мешая продвижению репликационной вилки.
- Увеличивается активность системы негомологичного соединения концов (non-homologous end joining, NHEJ), которая напрямую склеивает разорванные концы без использования матрицы. Такой процесс значительно увеличивает количество ошибок.
- PARPi увеличивают скорость репликации, соответственно, скорость накопления одноцепочечных и двухцепочечных разрывов увеличивается.
- PARP1 регулирует транскрипцию некоторых онкосупрессоров, таких как p53, NF-kB. Ингибирование PARP1 приводит к снижению их транскрипции.
Существует более сотни генов, участвующих в гомологичной рекомбинации, и несколько десятков из них связаны с повышенной предрасположенностью к раку. Есть несколько особенностей, которые ограничивают использование исключительно герминальных и соматических мутаций генов HRR в качестве предикторов ответа на PARPi:
- Белок не работает, если оба аллеля гена нефункциональны. Мутации в генах HRR необязательно поражают оба аллеля, а моноаллельные мутации не приводят к HRD. Доказать биаллельное повреждение может быть непросто технически.
- Мутации генов HRR (не BRCA1/2) могут иметь разное функциональное влияние. В связи с редкостью их выявления обычно информации об их влиянии на функцию HRR недостаточно. Так, например, часто встречаются мутации ATM и CHEK2, но есть большие сомнения, что они вызывают HRD.
- Даже в безусловно высокопенетрантных генах BRCA1/2 встречаются редкие варианты с неизвестной клинической значимостью.
- Пока неясно, какое количество генов HRR должно быть исследовано и как должен оцениваться их потенциальный вклад в онкогенез.
- HRD может быть обусловлен сложно выявляемыми эпигенетическими изменениями BRCA1/2.
В связи с этим используется другой подход для определения HRD: определение не только причины в виде конкретных мутаций, но и последствий нарушения работы HRR – геномной нестабильности. Определение пациентов, которые потенциально могут получить пользу от назначения PARPi при отсутствии безусловно патогенных вариантов BRCA1/2, на сегодняшний день является нерешённой проблемой. Давайте разберёмся почему.
Как делается тестирование?
Какие панели существуют
Основной проблемой является отсутствие общепринятого определения для HRD. Есть несколько тестов для его детекции, которые используют различные биомаркеры и алгоритмы, поэтому их трудно сравнивать между собой. Самих тестов существует множество, мы же обсудим самые известные в научной среде. В основном это специальные панели NGS с определённой биоинформатической обработкой. Чаще всего для косвенного обнаружения HRD используются панели, которые определяют так называемые геномные “шрамы”, или “рубцы”, оценивающие аллельный дисбаланс. К геномным шрамам относят:
- Потерю гетерозиготности (loss of heterozygosity, LOH) – генетическое событие, при котором теряются крупные участки одной из гомологичных хромосом. Такое событие ведёт к гомозиготному состоянию определённых генов.
- Крупные перестройки (large-scale transition, LST) – пространственное разделение соседних последовательностей за счёт транслокаций, тандемных дупликаций и инсерций более чем на 10 килобаз.
- Теломерный аллельный дисбаланс (telomeric allelic disbalance, TAI) – неравномерное распределение теломерных последовательностей отцовской и материнской хромосом.
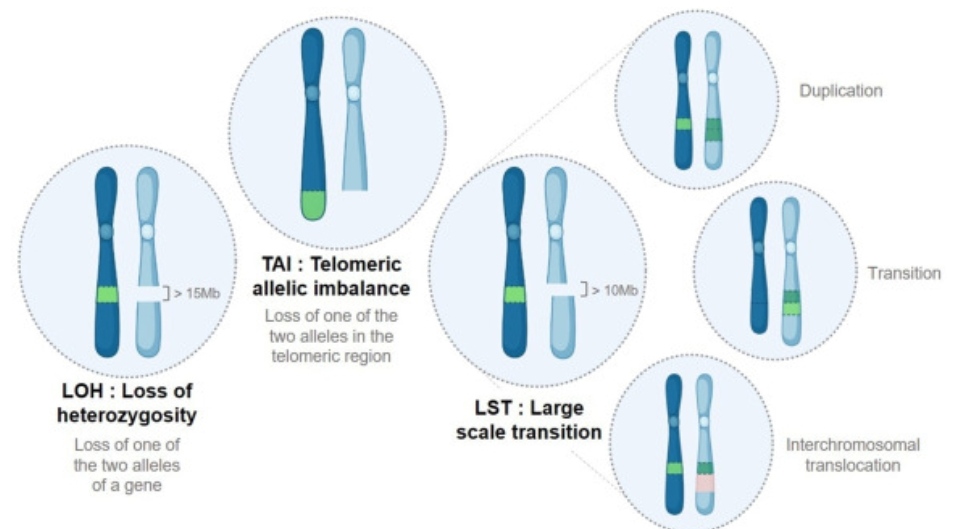
Наиболее популярный тест для обнаружения HRD MyChoice от Myriad Genetics считает общий балл на основании перечисленных трёх показателей: LOH, LST и TAI. Положительный статус HRD засчитывается при 42 баллах и более. Данная граница была установлена на основании способности теста определять 95% опухолей с мутациями BRCA1/2 и с метилированием промотора BRCA1. Тест валидирован в таких клинических исследованиях, как PAOLA-1, PRIMA, SOLO1, VELIA. Граница установлена только для пациенток с раком молочной железы и яичников, её применимость к другим опухолям неизвестна. Также с помощью MyChoice можно определить однонуклеотидные варианты, инсерции, делеции, крупные перестройки в кодирующих областях и на границе интронов и экзонов генов BRCA1/2 и нескольких других генов HRR.
Тест от Foundation Medicine также определяет наличие мутаций в генах HRR (без крупных перестроек), но статус HRD определяется только на основании процента LOH. Положительным результатом считается 16% и более. Тест также был валидирован клинически (SOLO1, ARIEL3). Myriad и Foundation одобрены FDA для использования в клинической практике, однако выполняются только в лабораториях Myriad и FMI. К тому же, они очень дорогие.
Альтернативой этим двум тестам является тест Amoy, который можно сделать на местах, т.е. закупить и выполнить в любой лаборатории, что сильно увеличивает доступность. Кроме того, он значительно дешевле и быстрее. Amoy определяет мутации BRCA1/2 (без крупных перестроек) и Genomic Scar Score. К сожалению, тест не валидирован клинически, однако конкордантность результатов Amoy и MyChoice высока.
Существующие тесты для определения HRD требуют использования больших панелей NGS и сложных биоинформационных алгоритмов. Предпринимаются попытки разработать относительно простые суррогатные маркеры для HRD. Например, анализ вариаций числа копий в MYC, CCNE1 и др., который может быть выполнен с помощью цифровой капельной ПЦР, обеспечивает быструю и экономичную оценку аллельного дисбаланса в геноме. Также изучается возможность использования фокусов RAD51 в оценке HRD. Для репарации двухцепочечных разрывов необходимо физическое взаимодействие между белками BRCA2 и RAD51. BRCA2 привлекает RAD51 к месту повреждения, где RAD51 формирует нуклеопротеиновые филаменты, необходимые для рекомбинации. Фокусы RAD51 могут быть видны в ядре клетки после определённых повреждений, что может указывать на места, где активно работают белки гомологичной рекомбинации. Клетки с дефицитом BRCA2 не формируют фокусов RAD51 в ответ на повреждение. На ИГХ такие клетки имеют слабое окрашивание на фокусы RAD51.
Также существуют тесты ex vivo, при которых свежие биопсийные образцы обрабатывают ДНК-повреждающими агентами и затем определяется формирование фокусов RAD51. Функциональные тесты имеют огромное преимущество над стандартными в том, что они оценивают реальную функцию HRR. Так, в предлеченной опухоли функция HRR может восстановиться (например, функция BRCA1/2 восстанавливается за счёт вторичных мутаций). Но при этом геномные “шрамы” никуда не исчезнут. В данной ситуации опухоль с положительным результатом HRD не будет чувствительна к специфической терапии. Конечно, в реальной практике функциональные тесты ex vivo практически не используются в связи со сложностью их проведения.
Проблемы тестирования
*здесь автор статьи берётся за левую половину грудной клетки и томно вздыхает, потому что работает с тестом HRD и несколько страдает*

1) Некорректный выбор материала. На этом этапе очень важно взаимодействие онколога, патоморфолога и генетика.
Ошибки преаналитического этапа:
- перепутаны гистологические блоки;
- выбран блок с большим содержанием некротизированной ткани;
- выбран блок с куском высокодифференцированной опухоли (хотя есть участки низкодифференцированной);
- отправлен материал с выраженным лечебным патоморфозом и т.д.
Также для сравнения у генетика должен быть генетический материал нормальной ткани (кровь или срез нормальной ткани). Поэтому если не будет отправлена кровь, то есть шанс, что у морфолога не получится срезать с блока нормальную ткань, и при необходимости сравнивать в итоге будет не с чем.
2) Недостаточное содержание опухолевых клеток в предоставленном материале.
Для достоверного результата HRD подходит материал с 30 и более процентами опухолевых клеток. При этом учитывается не просто площадь препарата и опухоли, а именно ядросодержащие клетки (т.е. потенциально сохраненная ДНК).
Важно! Если вы не хотите, чтобы результат задержался на неделю-другую, проследите, чтобы были отправлены и гистологические блоки, и соответствующие им стёкла. Если отправлены только блоки, в лаборатории будут делать стёкла самостоятельно, чтобы оценить процент опухолевых клеток, что определённо потребует времени. Также для увеличения вероятности получить информативный результат лучше отправить послеоперационный материал, а не биопсийный.
3) Отсутствие важной информации.
При отправке материала обязательно приложите гистологическое заключение и выписку с клинической информацией, если тест выполняется не в вашем учреждении.
После операций при раке яичников обычно готовится огромное количество гистологических блоков и стёкол, поэтому патоморфологу в лаборатории будет гораздо проще по гистологическому заключению определиться, откуда взять срез с наибольшим содержанием опухоли. А теперь представьте лицо патоморфолога, если будет отправлено 20 блоков без стёкол и без гистологического заключения (такое бывает). Также важно прикладывать выписку с наибольшим количеством клинической информации, в том числе потому, что в них часто можно найти гистологическое заключение.
Куда можно отправить на тестирование
Тестирование HRD в настоящее время можно сделать либо по программе AstraZeneca, либо платно. Возможность проведения и особенности теста лучше уточнять, связываясь с лабораторией напрямую. К сожалению, информация о проведении HRD на сайтах многих лабораторий отсутствует или глубоко закопана, поэтому приводим лишь некоторые возможные варианты: НМИЦ онкологии им. Н.Н. Петрова, Геномед, МНИОИ им. П.А.Герцена.
Что говорят рекомендации?
Кажется, самое время переходить к тому, зачем мы всё это обсуждали, – к клинической практике. Мы разберём, что и на основании чего говорят рекомендации разных сообществ. На данный момент статус HRD является предиктивным маркером только при high-grade раке яичников, маточной трубы и первичном раке брюшины.
Для удобства исследования будут представлены в форме вопроса по PICO, где:
Patient – какие пациенты включались в исследование;
Intervention – какое вмешательство, терапия изучались;
Comparison – с чем сравнивался экспериментальный подход;
Outcome – какие показатели в группах сравнивались, что было первичной и вторичными конечными точками.
Рекомендации NCCN по раку яичников, маточной трубы, первичному раку брюшины:
В отсутствие герминальных и соматических мутаций BRCA1/2 NCCN рекомендует тестирование на HRD. Положительный статус HRD позволит:
1) добавить олапариб или нирапариб (при непереносимости олапариба) к бевацизумабу в поддерживающем режиме после 1 линии химиотерапии для III-IV стадий заболевания.
Добавление олапариба основано на исследовании PAOLA-1:
P – пациентки с high-grade серозным или эндометриоидным раком яичников, маточной трубы и первичным раком брюшины III-IV стадий после 1 линии с отсутствием признаков заболевания, частичным или полным ответом после 1 линии платиносодержащей химиотерапии и бевацизумаба, вне зависимости от результатов операции;
I – олапариб и бевацизумаб, начиная от 3 до 9 недель после последнего введения химиотерапии;
С – плацебо и бевацизумаб, начиная от 3 до 9 недель после последнего введения химиотерапии. Введение олапариба/плацебо продолжалось до 2 лет, а бевацизумаба до 15 мес или до прогрессирования заболевания/непереносимой токсичности;
O – первичной конечной точкой служила ВБП.
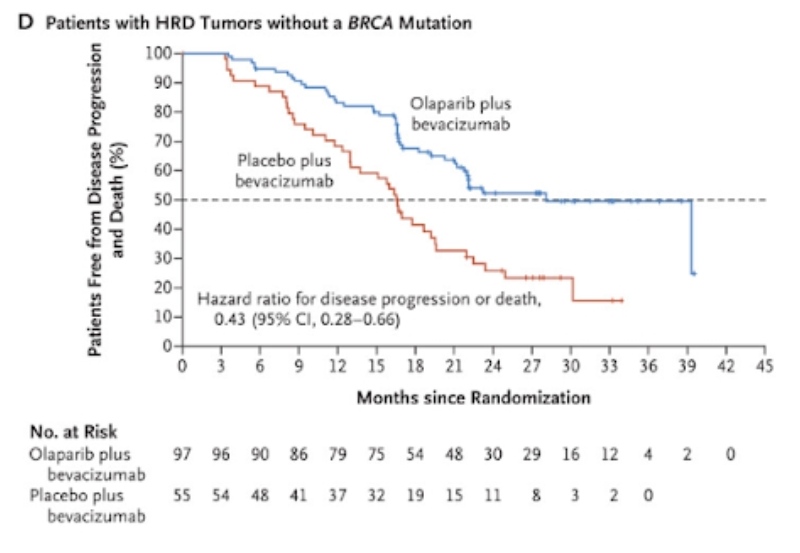
У пациенток с положительным статусом HRD без мутаций BRCA1/2 медиана ВБП составила 28,1 против 16,6 месяца (HR=0,43, 95% ДИ 0,28-0,66).
2) назначить нирапариб в поддерживающем монорежиме после 1 линии химиотерапии для III-IV стадий заболевания. Глобально от статуса HRD не зависит возможность назначения нирапариба в такой ситуации, но зависит магнитуда эффекта.
Нирапариб в монорежиме был изучен в исследовании PRIMA:
P – пациентки с high-grade серозным или эндометриоидным раком яичников, маточной трубы и первичным раком брюшины III-IV стадий с частичным или полным ответом после 1 линии платиносодержащей химиотерапии вне зависимости от результатов операции. Пациенты могли получать неоадъювантную терапию;
I – нирапариб, начиная до 12 недель после последнего введения платиносодержащей химиотерапии;
С – плацебо, начиная до 12 недель после последнего введения платиносодержащей химиотерапии. Приём препарата продолжался до 3 лет или прогрессирования заболевания;
O – первичной конечной точкой служила ВБП у пациентов с HRD и в общей популяции.
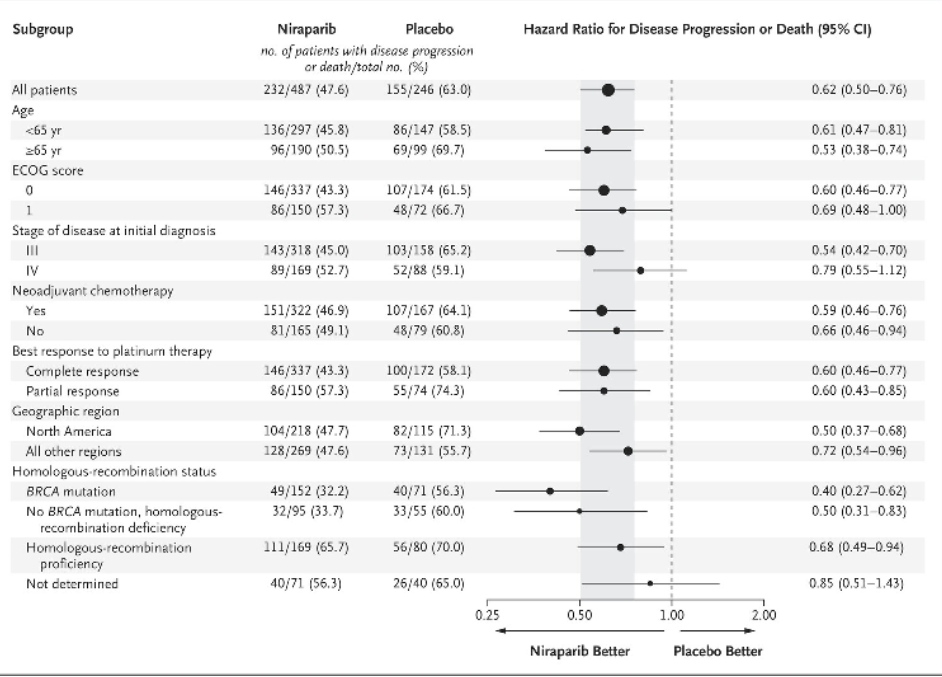
В подгруппе пациентов с HRD и без мутаций BRCA1/2 медиана ВБП составила 19,6 против 8,2 месяца (HR=0,5, 95% ДИ 0,31-0,83).
3) назначить нирапариб в поздних линиях лечения (4 и далее) при прогрессии более, чем через 6 месяцев после ответа на платиносодержащие режимы.
Данная рекомендация основана на однорукавном исследовании QUADRA 2 фазы:
P – пациентки с метастатическим high-grade серозным раком яичников, маточной трубы и первичным раком брюшины, предлеченные 3 и более линиями химиотерапии;
I – нирапариб до прогрессирования или непереносимой токсичности;
O – первичной конечной точкой была частота объективных ответов (ЧОО).
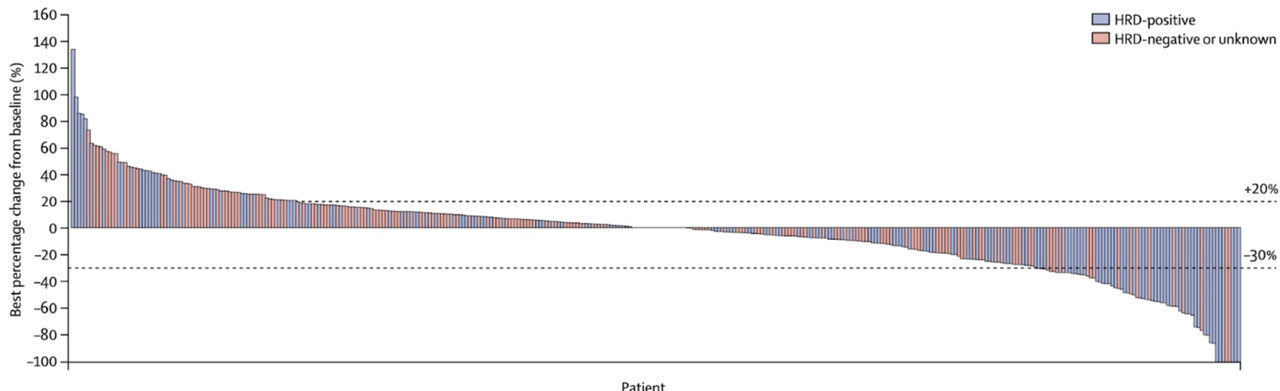
HRD+ пациентов, чувствительных к платиносодержащей химиотерапии после последней линии, было всего 47, 13 из них (28%) имели объективный ответ, 19 из 47 достигли стабилизации (40%). Важно понимать, что в эту группу входили пациенты с известными мутациями BRCA1/2.
ESMO – эпителиальные опухоли яичников.
В рекомендациях ESMO отсутствует опция назначения нирапариба в поздних линиях, в остальном рекомендации совпадают с NCCN.
Клинические рекомендации, 2024 – Рак яичников/рак маточной трубы/первичный рак брюшины.
Единственной опцией, отражённой в клинических рекомендациях, является добавление олапариба к бевацизумабу в рамках поодерживающей терапии после 1 линии платиносодержащей химиотерапии с бевацизумабом.
Take-home message
Я вас поздравляю, осталось немного! Повторим несколько важных мыслей из статьи, чтобы точно ничего не забыть:
- Для определения потенциальной чувствительности опухоли к PARPi используется определение не только причины сломанной системы HRR в виде герминальных и соматических мутаций, но и последствий – геномной нестабильности, маркера HRD.
- Есть несколько тестов для детекции HRD, которые используют различные биомаркеры и алгоритмы, поэтому их трудно сравнивать между собой. В основном это специальные панели NGS с определённой биоинформатической обработкой. Только 2 теста имеют клиническую валидацию, при этом оба недоступны для использования в России.
- Как и всегда, при отправлении материала на такое сложное и дорогостоящее исследование, как HRD, необходимо обращать внимание на качество отправляемого материала и прикладывать всю информацию о пациенте (последний выписной эпикриз, осмотр с наибольшим количеством данных, гистологическое заключение).
- В России статус опухоли HRD необходим для возможности назначения поддерживающей терапии в виде олапариба и бевацизумаба после 1 линии платиносодержащей химиотерапии с бевацизумабом.
Если вы хотите, чтобы мы разобрали ещё какой-нибудь сложный и непонятный молекулярный маркер, или у вас остались вопросы, обязательно пишите в комментариях!