ГЛИНТВЕЙН С УИЛСОНОМ ☕️
HSO talksНад выпуском работали: Ольга Селиверстова, Алина Рассолова, Мария Машкей
Верстальщик: Анастасия Алексеева
Полина Шило

Полина: “Вручаю свой Оскар исследованию CROWN!
Химиотерапевтическая штука: чтобы сказать, что результаты исследования действительно крутые - нужно, чтобы между кривыми выживаемости влез грузовик…
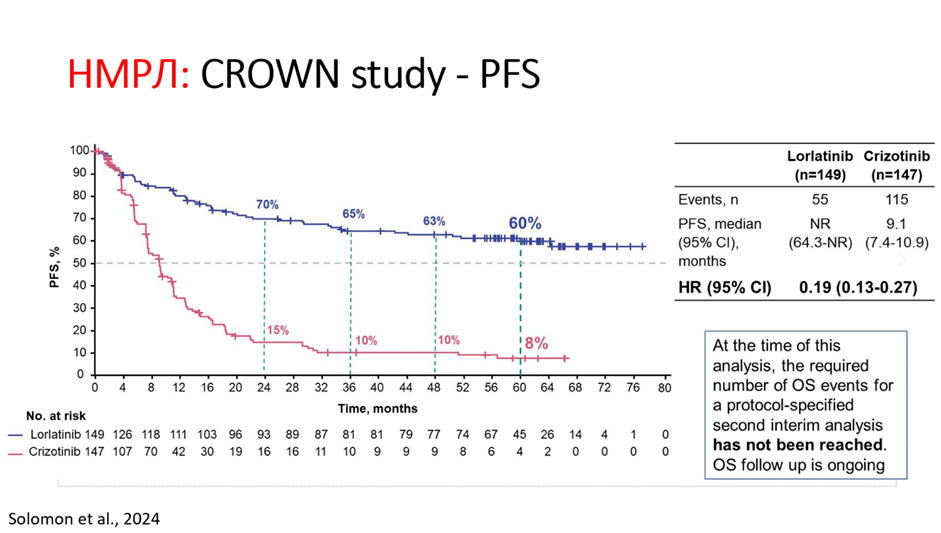
Кажется, сюда влезает) HR 0.19 тоже радует”
Справка от Уилсона:
Исследование CROWN посвящено лорлатинибу и его сногсшибательному выигрышу при ALK-позитивном мНМРЛ в сравнении с кризотинибом в 1-ой линии терапии.
При медиане наблюдения в 60,2 и 55,1 месяцев медиана PFS в группе лорлатиниба не была достигнута vs 9,1 месяцев в группе кризо (HR 0,19; 95% CI, 0,13-0,27). 5-летняя PFS составила 60% и 8% соответственно.
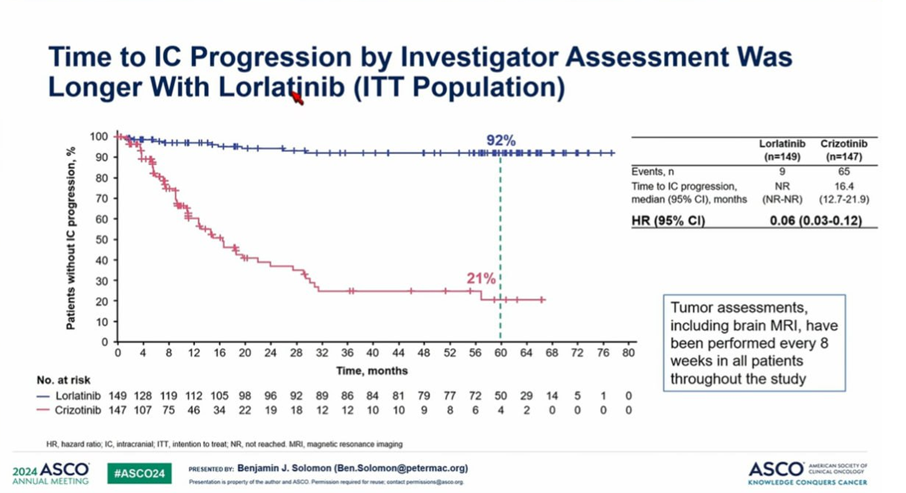
Дополнительным бонусом в пользу лорлатиниба является еще и интракраниальный контроль 🧠.
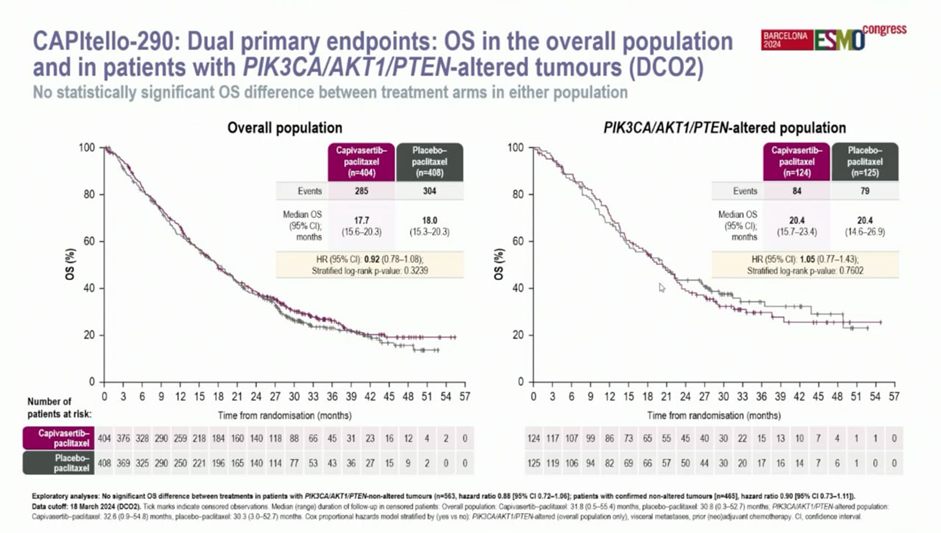
Полина: “"Золотая малина" - CAPITELLO-290.
Пакли + капивасертиб vs просто пакли в 1-ой линии ТНРМЖ с альтерациями PIK3CA/AKT/PTEN… Неуспешный неуспех…”
Справка от Уилсона:
Исследование CAPITELLO-290 посвящено добавлению капивасертиба к паклитакселу при мТНРМЖ в 1-ой линии терапии. В исследовании добавление капивасертиба не улучшает OS как в общей популяции, так и у пациенток с альтерациями в генах PI3K/AKT сигнального пути (PIK3CA, AKT1 или PTEN) 🙃.
Александр Аболмасов

Александр: “Во-первых, некоторую надежду вселяет эта работа. Мама, ты была права: помидоры раньше и правда были вкуснее, теперь это доказано научно 🙂.
Если же говорить про онкологию, то в масштабах лично меня упомяну не самый широко обсуждаемый PECATTI“.
Справка от Уилсона:
Речь идет об исследовании II фазы, в котором оценивалась эффективность и безопасность комбинации ленватиниб + пембролизумаб у предлеченных пациентов с тимомой B3 и тимической карциномой.
В исследование не включались пациенты с миастенией и пациенты, которые ранее получали сунитиниб.
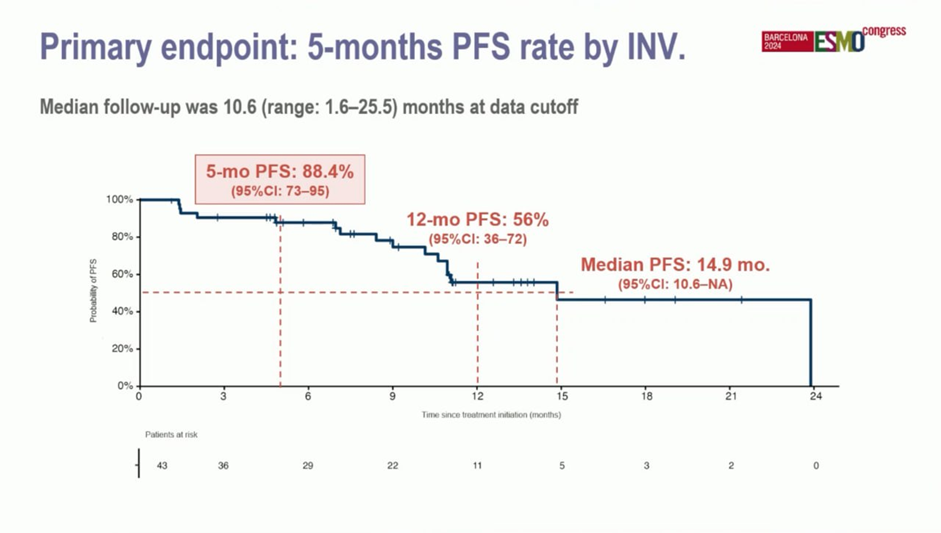
43 пациента получали ленватиниб 20 мг ежедневно + пембро 200 мг каждые 3 недели (84% страдали тимической карциномой, 16% - тимомой B3).
Результаты: 12-месячная PFS составила 56%. Медиана PFS 14.9 мес. ЧОО 23%.
Частота НЯ grade ≥3 составила 34.9%, чаще всего отмечали диарею (7%), гипертензию (7%) и печеночную токсичность (5%).
Александр: “Боюсь показаться пошлым, но исследования — это для пациентов и про людей. Я довольно давно лечу пациента с метастатической тимомой, и мы очень подробно и скрупулезно обсуждали и решались на иммунотерапию, которую до сих пор для тимомы как будто бы было нельзя. Были даже попытки включиться в это самое исследование, но не удалось. В итоге оно вышло почти с началом терапии, и тогда стало понятно, что не только для тимической карциномы можно рассматривать иммунотерапию.
Небольшой take-home-message: самый интересный вопрос, с моей точки зрения, заключается в том, чем же отличается это исследование и почти такой же CAVEATT, от остальных, которые показали неприемлемую частоту токсичности. Среди критериев включения были обязательными отрицательные тесты на антитела к ацетилхолиновому рецептору.
Так что, если вы будете обсуждать иммунотерапию с пациентом с метастатической тимомой В3, не забудьте проверить антитела к ацетилхолиновому рецептору, а также к скелетным мышцам и мышечно-специфичной тирозинкиназе.
Из исследований, которые действительно меняют практику, отмечу ниволумаб в лимфоме Ходжкина. И ранее опубликованный NIVAHL.
😉P.S. Теперь у исследований, которые непонятно вообще зачем проводились, где “слиплись кривые” и которые не отвечают ни на какие вопросы есть название“.
Справка от Уилсона:
В лечении лимфомы Ходжкина за последние несколько лет произошли революционные изменения. Анти-CD30 иммуноконъюгат брентуксимаб ведотин (BV) быстро проскочил от лечения рецидивов до первой линии. Его комбинация с ABVD при III-IV стадии привела к достоверному увеличению PFS по сравнению с одним ABVD (6-летняя PFS 82.3% BV+AVD и 74.5% с ABVD).
Затем в предпочтительные опции ворвался ниволумаб, к которому лимфома Ходжкина тоже оказалась высокочувствительна.
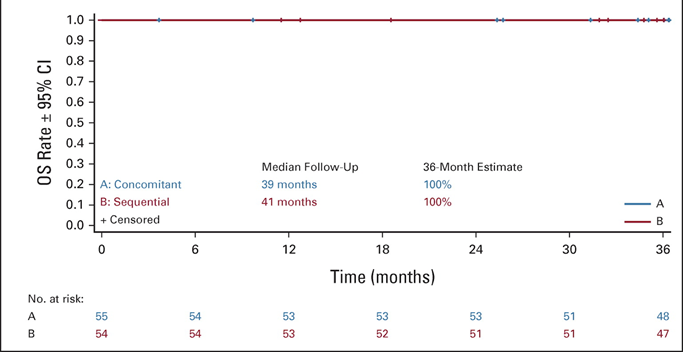
В исследовании II фазы NIVAHL пациенты (n=109) с ранней стадией лимфомы Ходжкина, имеющие неблагоприятный прогноз, получили одновременно 4 цикла N-AVD или последовательное лечение: 4 × ниволумаба, 2 × N-AVD, и 2 × AVD.
😱При медиане наблюдения 41 месяц не было зарегистрировано ни одного события после завершения лечения. PFS и ОS за 3 года составляют 100%.
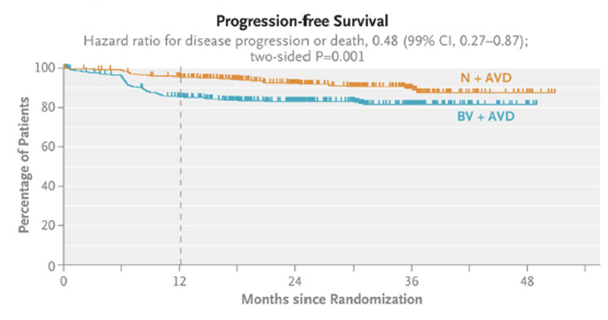
И вот появилось прямое сравнение: исследование III фазы, сравнивающее ниволумаб + AVD и брентуксимаб + AVD у пациентов III-IV стадии.
✅ 2-летняя PFS составила 92% с ниво+AVD по сравнению с 83% при BV+AVD (HR 0,45; 95% CI, 0,30 to 0,65);
✅ режим с ниволумабом оказался менее токсичным;
✅ лучевая терапия после ХТ потребовалась лишь 0,7% пациентов.
Элина Хачатурян

Элина: “В нашей непростой клинической и жизненной ситуации для меня хорошие исследования это те, которые я могу «завтра» внедрить в свою клиническую практику.
Топ 3:
ESOPЕC : периоперационная химиотерапия FLOT vs ХЛТ в лечении неметастатических аденокарцином пищевода.
Из этого исследования мы узнали, что резектабельную аденокарциному верхнего и среднего отделов пищевода необходимо лечить так же, как и аденокарциному желудка, это эффективнее и безопаснее стандартной химиолучевой терапии”.
Справка от Уилсона:
В исследовании ESOPEC периоперационная химиотерапия по схеме FLOT позволила достичь медианы OS, равной 66 месяцам, по сравнению в 37-ю месяцами при ХЛТ в режиме CROSS (HR 0.70, 95% CI 0.53-0.92, p=0.012).
Элина: “TRANSMET: трансплантация печени при мКРР.
Трансплантация печени у пациентов с метастатическим КРР и изолированным поражением печени по-настоящему прорыв этого года, поэтому и «Оскар» и свое сердечко я отдаю этому исследованию.
Трансплантация печени в сочетании с химиотерапией приводит к значительному улучшению 5-летней OS 73% и снижению риска смерти на 84% по сравнению с 9% при использовании только химиотерапии у пациентов с неоперабельными метастазами КРР в печени”.
Справка от Уилсона:
В исследование TRANSMET включали пациентов с резектабельности первичной опухолью; нерезектабельными метастазами в печени (по мнению экспертов); отсутствием других очагов (вне печени) по данным КТ или ПЭТ/КТ; диким типом BRAF первичной опухоли или очагов в печени; находящихся на лечении (до 3 линий ХТ) и с контролем заболевания (стабилизация или частичный ответ по RECIST) более 3 месяцев на последней линии ХТ. Рандомизация в группы ХТ vs трансплантация + ХТ.
В популяции ITT: 5-летняя ОS составила 57% в группе ТП+ХТ vs 13% в группе ХТ (log-rank test: p=0,0003, HR 0,37; 95% CI 0,21-0,65).
В per protocol анализе: 5-летняя ОS составила 73% в группе ТП+ХТ vs 9% в группе ХТ (HR 0,16; 95%CI 0,07-0,33).
Элина: “RENAISSANCE : оценивалось влияние только химиотерапии по сравнению с химиотерапией с последующей хирургической резекцией на выживаемость и качество жизни у пациентов с метастатической аденокарциномой желудка или пищеводно-желудочного перехода.
Очередное подтверждение, что лучшее, что мы можем сделать с пациентами с метастатическим раком желудка и пищеводно-желудочного перехода, это их не оперировать. Пациенты с прооперированным канцероматозом брюшины или отдаленными метастатическими лимфоузлами жили хуже и короче тех, кто получал только химиотерапию”.
Справка от Уилсона:
В исследовании RENAISSANCE пациенты с олигометастатическим раком желудка/кардиоэзофагеального перехода после 4-х циклов ХТ по схеме FLOT (с добавлением трастузумаба и ниволумаба по показаниям) при достижении частичного ответа или стабилизации рандомизированы в группы: хирургия + 4-8 циклов FLOT vs 4-8 циклов FLOT. Олигоместатическим заболеванием считалось изолированное поражение ретроперитонеальных лимфатических узлов (л/у); метастазы в одном органе с/без поражения ретроперитонеальных л/у. Медиана ОS в группе хирургии составила 18,5 месяца vs 23,6 месяца в группе ХТ (HR 1,037; 95% CI 0,691-1,556, р=0,8610). В подгрупповом анализе преимущество от хирургии только в группе поражения ретроперитонеальных л/у (медиана ОS 29,6 vs 17,1 мес).
Элина: “Самые неудачные исследования по моему скромному мнению, это исследования по адъювантной гормонотерапии ингибиторами CDK. Возможно лет через 15 MONARCH-E добьется увеличения ОВ, а пока это лишь слабительное за 160 тыс.”
Справка от Уилсона:
В исследовании MONARCH-E изучалось добавление ингибитора CDK4/6 абемациклиба к стандартной адъювантной гормонотерапии у пациентов с люминальным HER2-негативным (HR+/HER2-) ранним раком молочной железы с поражением лимфатических узлов (N+) и высоким риском рецидива. В 2024 году представлены промежуточные результаты 5-летнего анализа выживаемости. При медиане наблюдения 54 месяца в ITT популяции абсолютное улучшение IDFS (выживаемость без инвазивного заболевания) на 7,6%.
Элина: “Но «золотую малину» я отдам KEYNOTE-522 : неоадъювантная химиоиммунотерапия раннего рака молочной железы.
Неадекватные контрольные группы, неадекватно подобранная адъювантная терапия, смущающий подгрупповой анализ. Бенефит получили пациенты с низким PDL, небольшой опухолью (T2N0), и стоит вопрос, для чего все это затевалось? Лечить тех, кто и так хорошо лечится?”
Справка от Уилсона:
KEYNOTE-522 – это рандомизированное, двойное слепое исследование III фазы, изучающее добавление иммунотерапии к химиотерапии до и после хирургического лечения трижды-негативного рака молочной железы II-III стадии. 1174 пациентки рандомизированы 2:1 в зависимости от добавления пембролизумаба в группы: 4 ТС (паклитаксел + карбоплатин) + пембролизумаб/плацебо, затем 4 AC (доксорубицин + циклофосфамид) в неоадъюванте, операция, и 9 циклов пембролизумаба/плацебо в адъюванте. При медиане наблюдения 75,1 месяца 5-летняя ОВ составила 86,6% в группе пембролизумаба против 81,7% в группе плацебо (P=0,002).
Ольга Гордеева

Ольга: “Мы много говорим про успехи в лечении той или иной опухоли, но не всегда вспоминаем о тех, кто справился с болезнью и идёт дальше. А ведь там - целая жизнь, наполненная страхами за свое будущее: возможность создавать семью и быть таким, как те, кто не болел. В 2023 году мы узнали, что женщины с гормоночувствительным раком молочной железы могут прерывать гормональную терапию, чтобы успеть родить ребенка - и это не сказывается на риске рецидива. В этом году пришла новость о том, что мы можем без каких-либо опасений разрешать нашим пациенткам, завершившим лечение и родившим ребенка, кормить грудью.
Причем это касается как пациенток с мутацией, так и без неё”.
Справка от Уилсона:
Речь идёт о двух исследованиях, результаты которых были представлены на конгрессе ESMO.
- Проспективное исследование POSITIVE продемонстрировало отсутствие повышения риска рецидива у женщин с ранним HR+ РМЖ, которые прервали лечение для планирования беременности после 18-30 месяцев адъювантной эндокринной терапии.
При медиане наблюдения 41 месяц 317 пациенток родили ребенка, из них 196 (62%) кормили грудью. 52,6% кормили первого ребенка грудью более 4-х месяцев. Грудное вскармливание не повлияло на длительность безрецидивного периода (HR 1,12, 95% CI: 0,28 - 4,5).
- Второе ретроспективное когортное исследование оценивало риски рецидива у пациенток с BRCA мутацией. Медиана наблюдения составила 7 лет. Различий в кумулятивной частоте локорегионарных и контралатеральных рецидивов между группой грудного вскармливания (n=110) и некормящих грудью (n=68) не было (HR=1,08, 95% CI: 0,57-2,06, p=0,82). Различия в PFS и ОS также были статистически не значимы.
Ольга: “Да, возможно эти исследования не меняют коренным образом нашу практику, однако они позволяют тем, кто пережил болезнь, с меньшим страхом смотреть в будущее”.