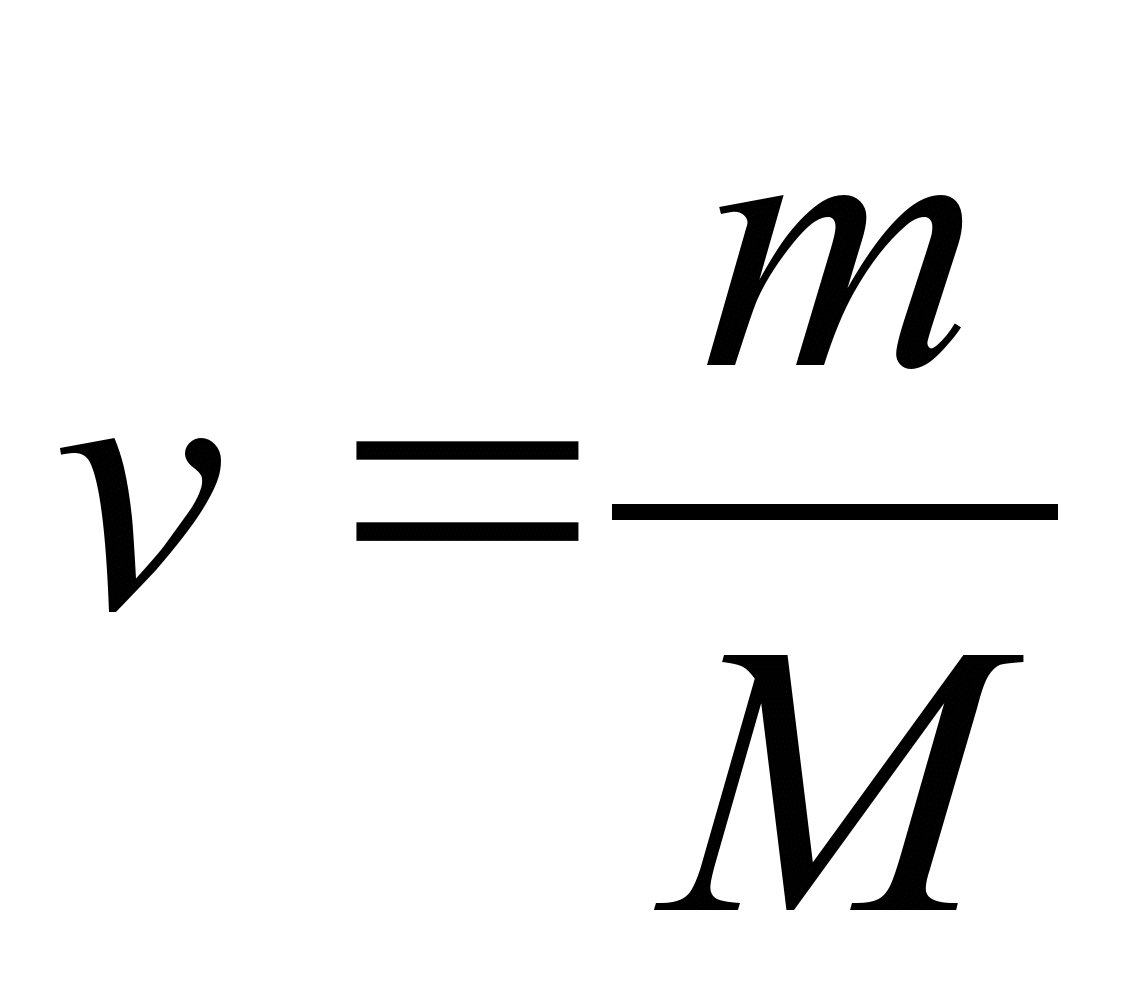Формула Ню Химия

Формула Ню Химия
Материал из Википедии — свободной энциклопедии
↑ Можно говорить о количестве вещества для молекул ( формульных единиц ) водорода
H
2
{\displaystyle {\ce {H2}}}
, можно говорить о числе молей атомов водорода
H
{\displaystyle {\ce {H}}}
, но словосочетание «один моль водорода» без конкретизации объекта обсуждения лишено смысла [3] .
↑ [dic.academic.ru/dic.nsf/polytechnic/4077/КОЛИЧЕСТВО Количество вещества] (неопр.) . Большой энциклопедический политехнический словарь (2004). Дата обращения: 31 января 2014.
↑ Деньгуб В. М. , Смирнов В. Г. Единицы величин. Словарь-справочник. — М. : Издательство стандартов, 1990. — С. 85. — 240 с. — ISBN 5-7050-0118-5 .
↑ Пресс И. А. , Основы общей химии, 2017 , с. 119.
↑ Avogadro constant (англ.) . Physical Measurement Laboratory . National Institute of Standards and Technology . Дата обращения: 7 февраля 2017.
↑
5
B
+
4
,
5
H
2
→
B
5
H
9
,
Δ
H
298
∘
=
+
62
,
8
k
J
{\displaystyle {\mathsf {5B+4{,}5H_{2}\ {\xrightarrow {}}\ B_{5}H_{9}}},~\Delta H_{298}^{\circ }=+62{,}8~\mathrm {kJ} }
Когда теплота реакции записывается так, как это сделано в данном уравнении, подразумевается, что она выражена в килоджоулях на стехиометрическую единицу («моль») реакции по записанному уравнению. В рассматриваемом случае теплота реакции равна 62,8 кДж на моль (+62,8 кДж · моль −1 ) B 5 H 9 (газообразного) , но составляет только 12,56 кДж на моль израсходованного бора (твёрдого кристаллического) или 62,8 кДж на каждые 4,5 моля газообразного водорода. Теплоты реакций всегда табулируются в расчете на моль образующегося соединения.
Это заготовка статьи по химии . Вы можете помочь проекту, дополнив её.
Информация должна быть проверяема , иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники . Эта отметка установлена 13 мая 2011 года .
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист .
Список проблемных доменов [показать]
Коли́чество вещества́ — физическая величина , характеризующая количество однотипных структурных единиц, содержащихся в веществе . Под структурными единицами понимаются любые частицы, из которых состоит вещество ( атомы , молекулы , ионы , электроны или любые другие частицы) [1] . Единица измерения количества вещества в Международной системе единиц (СИ) и в системе СГС — моль [2] . Без конкретизации объекта рассмотрения термин «количество вещества» не используют [K 1] .
Эта физическая величина используется для измерения макроскопических количеств веществ в тех случаях, когда для численного описания изучаемых процессов необходимо принимать во внимание микроскопическое строение вещества, например, в химии , при изучении процессов электролиза , или в термодинамике , при описании уравнений состояния идеального газа .
При описании химических реакций , количество вещества является более удобной величиной, чем масса , так как молекулы взаимодействуют независимо от их массы в количествах, кратных целым числам.
Например, для реакции горения водорода (2H 2 + O 2 → 2H 2 O) требуется в два раза большее количество вещества водорода, чем кислорода . При этом масса водорода, участвующего в реакции, примерно в 8 раз меньше массы кислорода (так как атомная масса водорода примерно в 16 раз меньше атомной массы кислорода). Таким образом, использование количества вещества облегчает интерпретацию уравнений реакций: соотношение между количествами реагирующих веществ непосредственно отражается коэффициентами в уравнениях.
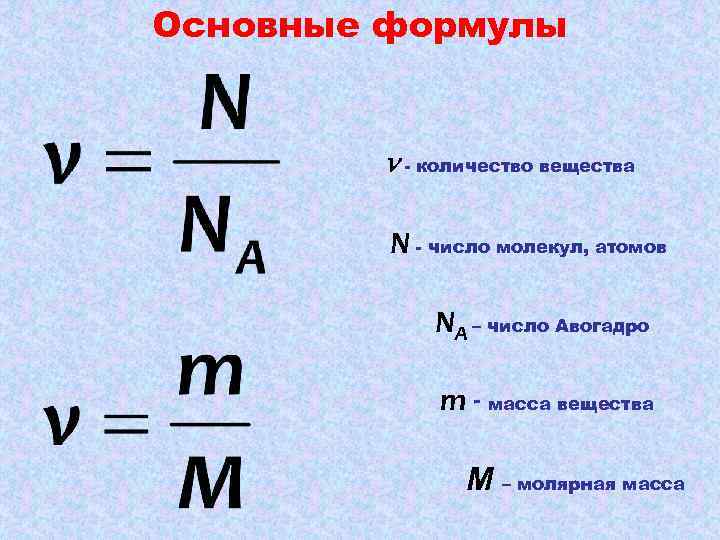
Так как использовать в расчётах непосредственно количество молекул неудобно, потому что это число в реальных опытах слишком велико, вместо измерения количества молекул в единицах «штука», их измеряют в молях . Фактическое количество единиц "штука" в 1 моле вещества называется числом Авогадро ( N A = 6,02214076⋅10 23 "штука"/моль [4] ).
Количество вещества обозначается латинской
n
{\displaystyle n}
(эн) и не рекомендуется обозначать греческой буквой
ν
{\displaystyle \nu }
(ню), поскольку этой буквой в химической термодинамике обозначается стехиометрический коэффициент вещества в реакции, а он, по определению, положителен для продуктов реакции и отрицателен для реагентов [5] . Однако в школьном курсе широко используется именно греческая буква
ν
{\displaystyle \nu }
(ню).
Для вычисления количества вещества на основании его массы пользуются понятием молярная масса :
n
=
m
/
M
{\displaystyle n=m/M}
, где m — масса вещества, M — молярная масса вещества. Молярная масса — это масса, которая приходится на один моль данного вещества. Молярная масса вещества может быть получена произведением молекулярной массы этого вещества на количество молекул в 1 моле — на число Авогадро . Молярная масса (измеренная в г/моль) численно совпадает с относительной молекулярной массой.
По закону Авогадро , количество газообразного вещества можно также определить на основании его объёма :
n
{\displaystyle n}
= V / V m , где V — объём газа при нормальных условиях , а V m — молярный объём газа при тех же условиях, равный 22,4 л/моль.
Таким образом, справедлива формула, объединяющая основные расчёты с количеством вещества:
n
{\displaystyle \ n}
,
ν
{\displaystyle \ \nu }
Секретная шпаргалка по химии . 2.3 Количество вещества (моль).
Формула количества вещества в химии
Химическое количество вещества . — урок. Химия , 8–9 класс.
Урок №38. Моль — единица количества вещества .
Количество вещества — Википедия с видео // WIKI 2
Большой Член В Малинкои Пизде
Порно Русское Натуральное Молодежное Подглядывание
Девственницы Самоубийцы
Порно Сильвестр
Порно С Секретаршей На Столе