El nanomundo en tus manos
7. Nanobiotecnología y nanomedicina
Página 18 de 22
Uno de los casos más controvertidos es el de ciertas «entidades replicativas» de las cuales ya hemos hablado en este capítulo: los virus y los viroides. Su adscripción entre los seres vivos o los sistemas inanimados es siempre conflictiva, porque pueden replicarse y evolucionar, pero no de forma autónoma sino a expensas de las actividades metabólicas de la célula que parasitan. Podría decirse que estos patógenos se comportan como seres vivos cuando están dentro de su célula hospedadora, pero no en su fase extracelular. Cuando salen de la célula, no son más que partículas nanométricas formadas por ácidos nucleicos (unidos a proteínas, en el caso de los virus) que se degradan rápidamente si no vuelven a infectar otra célula. En cualquier caso, existen sistemas aún más difíciles de clasificar, como los cristales inorgánicos capaces de hacer copias de sí mismos replicando incluso los errores presentes en sus sistemas cristalinos, o los programas informáticos que se copian a sí mismos y evolucionan para adaptarse a los recursos (de hardware y software) disponibles en el ordenador que los aloja. Ante la imposibilidad de consensuar qué es la vida, son muchas las definiciones operativas de vida que actualmente conviven, algunas de las cuales han sido propuestas por investigadores de las universidades del País Vasco y de Valencia. Una de las más aceptadas es la que ha acuñado el bioquímico G. F. Joyce, del Instituto de Investigación Scripps en California, y que ha sido asumida por el Instituto de Astrobiología de la NASA (NAI): «un ser vivo es un sistema químico automantenido que evoluciona como consecuencia de su interacción con el medio».
Por tanto, sintetizar vida en un laboratorio (una aspiración aún irrealizable) significaría construir una entidad replicativa y metabólicamente viable dotada de un genoma (en principio, de ADN o de ARN) capaz de transmitirse a su progenie. Para ello, algunos investigadores del ámbito de la «biología sintética» realizan una aproximación de tipo descendente, partiendo de información biológica contenida en la secuencia de los genomas de los organismos actuales. Los primeros pasos en este sentido comenzaron a darse hace cuatro décadas, con el desarrollo de la ingeniería genética y la biotecnología. Así, se ha logrado dotar a ciertos organismos ya existentes de nuevas funciones o propiedades (por ejemplo, la capacidad de que una bacteria degrade un determinado compuesto químico contaminante, que capture eficientemente el CO2 atmosférico, o que produzca insulina humana) gracias a la inclusión en ellos de los genes que codifican las proteínas necesarias. Así, cada vez con mayor frecuencia se están originando en los laboratorios organismos no naturales con distintas finalidades. Una variante de esta aproximación está relacionada con el desarrollo de plantas y animales transgénicos, que incluyen en su genoma secuencias exógenas para hacerlos resistentes a enfermedades o plagas, sobrevivir en diversos ambientes, adquirir nuevas características organolépticas, o aumentar su rentabilidad económica. En el extremo de esta visión de la biología sintética están los logros de C. Venter y su instituto de investigación en EE.UU., quienes han ensamblado el genoma completo de un virus (el bacteriófago PhiX174) y también el de la bacteria Mycoplasma genitalium a partir de fragmentos de ADN previamente sintetizados en otro laboratorio.
Sin embargo, desde el punto de vista de la bionanotecnología, resultan más relevantes las estrategias ascendentes que buscan construir un sistema vivo completo «pieza a pieza», a partir de cada uno de sus componentes moleculares por separado. Con ello, además, se lograría avanzar hacia la comprensión de los procesos que pudieron producirse durante el origen de la vida. De hecho, visto desde la óptica de la bionanotecnología, el origen de la vida podría identificarse con la aparición de nanosistemas moleculares capaces de replicarse a sí mismos… haciéndolo suficientemente mal como para producir errores y poder evolucionar. Intentando simular ese proceso, la «creación de vida» a partir de constituyentes inanimados es un tema controvertido dentro y fuera de la ciencia, pero está siendo ya explorado por muchos investigadores. Una primera limitación para lograr sintetizar vida ex novo es que, aunque la tecnología se ha desarrollado mucho, nuestro conocimiento de los seres vivos es aún insuficiente, sobre todo en cuanto a las interacciones entre moléculas que sustentan el proceso vital. Pero ya se están dando pasos decididos en esa dirección, como se muestra en los ejemplos de la Figura 7.9.
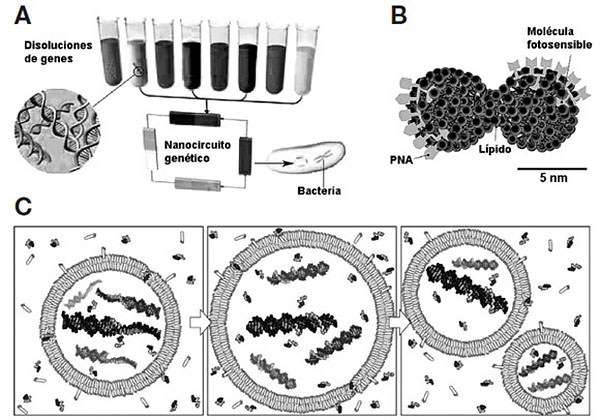
FIGURA 7.9. Algunos planteamientos de la biología sintética. A. Construcción de nanocircuitos genéticos capaces de funcionar dentro de una bacteria receptora (figura adaptada de W. Gibbs, Scientific American, 2004). B. Ensamblaje de agregados de macromoléculas biológicas que podrían llegar a constituir sistemas autorreplicativos (adaptada de S. Rasmussen et al., Artificial Life, 2003). C. Protocélulas experimentales con ácidos nucleicos en su interior, capaces de dividirse (adaptada de S. S. Mansy et al., Nature, 2008).
El grupo de D. Endy en la Universidad de Stanford (EE.UU.) construye «nanocircuitos genéticos» que en lugar de componentes electrónicos poseen genes con la información para producir las proteínas que catalizan reacciones metabólicas fundamentales en los seres vivos. Siguiendo esta línea de trabajo, en diferentes laboratorios (e incluso mediante concursos en los que participan estudiantes universitarios) se combinan biobricks o ladrillos genéticos (genes, o bien las regiones que regulan la activación de dichos genes), con el fin de construir sistemas biológicos sintéticos. En paralelo, otros investigadores ensamblan agregados biomoleculares progresivamente más complejos, con el objetivo de que lleguen a funcionar como células artificiales, o avanzan en la fabricación de protocélulas sintéticas, algunas de las cuales incluyen material genético capaz de reproducirse con ayuda de enzimas. En esta última línea de trabajo destacan los logros de J. W. Szostak y su grupo en la Universidad de Harvard (EE.UU.). Con todo ello, se está empezando a combinar de forma coherente los tres ingredientes básicos de la vida (compartimento, genoma y metabolismo), de forma que quizá algún día veamos cómo puede surgir vida a partir de sus componentes por separado. ¿Se podrá entonces construir en el laboratorio una bacteria que se comporte como las naturales y sea capaz de competir con ellas por los recursos? ¿Y una orquídea? ¿Un Boletus edulis? ¿Un hipopótamo? ¿Un ser humano? ¿Podría llegar a existir una «versión nanotecnológica» de aquel Frankenstein que M. W. Shelley imaginó hace dos siglos?
Ante estas inquietantes cuestiones, hasta el momento parece que los organismos que se están modificando genéticamente en los laboratorios son menos robustos que los naturales, debido a que estos últimos se han ido optimizando progresivamente a lo largo de millones de años de evolución. Por tanto, podemos pensar que incluso si los investigadores llegaran a unir exitosamente las nanopiezas del puzle de un ser vivo (usando técnicas como las descritas en el apartado 7.5, o las que se desarrollen en el futuro) no serían capaces de igualar el rompecabezas que la naturaleza ha ido construyendo desde el inicio de la vida y sometiéndolo paso a paso a la prueba de la evolución por selección natural. Además, como ha escrito el biólogo y filósofo A. Moya (del Instituto Cavanilles de Biodiversidad y Biología Evolutiva de Valencia), la aplicación a los sistemas biológicos del «Teorema de la Indecibilidad» de K. Gödel muestra que «existen propiedades dentro de una célula que no son ni demostrables ni refutables de acuerdo con las reglas que definen el sistema». Por tanto, aunque llegáramos a conocer todos los elementos que componen una célula y las reglas que definen sus interacciones, sería imposible predecir la aparición de nuevas propiedades en ella, o la ausencia de otras que resultan necesarias para su viabilidad. De hecho los seres vivos son un ejemplo de los denominados «sistemas complejos», en los que a menudo emergen propiedades nuevas que eran inicialmente impredecibles. Dicho de otra forma, en biología el todo es siempre más que la suma de las partes.
Nos esperan muchas horas de juego hasta completar el puzle de un ser vivo, y además puede que al final el resultado no se parezca a la fotografía que teníamos delante. En cualquier caso, hasta ahora la bionanotecnología y la biología molecular no hacen sino utilizar o copiar los componentes que ya existen en los seres vivos actuales, y son aún muy escasos los científicos que se plantean sintetizar formas de vida radicalmente distintas de las que ya han triunfado en nuestro planeta. Quizá, si alguna vez se encontrase vida fuera de la Tierra y además se demostrara que su origen fue diferente del nuestro, se podría empezar a disponer de claves sobre cómo la misma química puede originar distintas biologías.
7.8. Los nanobiosensores y sus aplicaciones
Los biosensores, tal como se indicó en el apartado 6.4, son dispositivos que permiten analizar muestras complejas (por ejemplo el agua de un río, un alimento o nuestra sangre) y determinar si en ellas existen determinadas sustancias o «moléculas diana» (que también pueden ser virus o bacterias completos). Por tanto, son herramientas de gran aplicabilidad en biotecnología, medioambiente, alimentación y medicina. Entre los numerosos biosensores que se han desarrollado durante los últimos años, algunos permiten detectar y/o cuantificar muchas moléculas simultáneamente: son los llamados microarrays, «chips» o «microchips». En ellos miles de «moléculas sonda» o sensoras, principalmente proteínas o cadenas cortas de ADN, se unen mediante enlaces covalentes a un soporte rígido (por ejemplo una placa de vidrio, silicio u oro) o bien a una membrana (habitualmente de nitrocelulosa o nailon). El uso de un sistema robotizado permite imprimir una disposición bidimensional de puntos con dimensiones micrométricas (por lo general, de 50 a 150 μm de diámetro) en posiciones predefinidas, en cada uno de los cuales hay un único tipo de molécula sonda. Para entender cómo funciona un biosensor de este tipo imaginemos, por ejemplo, un microarray de proteínas en el que cada punto contiene un tipo de anticuerpo (sonda) capaz de unirse a una proteína (diana) determinada. La muestra problema (que podría ser un extracto de las proteínas presentes en nuestra sangre) se une a una molécula orgánica capaz de emitir una señal fluorescente cuando es iluminada por un rayo láser con determinada longitud de onda (existen muchos reactivos de este tipo), y ese conjunto de proteínas marcadas se pone en contacto con el microarray. Como resultado, las proteínas presentes en la muestra problema que «encuentren» su anticuerpo específico en el microarray se unirán a él, mientras que las demás se eliminarán en un posterior proceso de lavado. Con ello, al hacer incidir la radiación láser sobre el microarray, mediante un escáner de alta resolución podremos ver algunos puntos fluorescentes mientras que otros no mostrarán señal: los primeros nos indican qué proteínas había en la muestra analizada.
Existen también distintos tipos de microarrays de ADN, en los que las moléculas sonda son cadenas cortas de ADN y las dianas son moléculas de ADN o ARN que se unen a las sondas si las secuencias de ambas son complementarias (ver apartado 7.6). Estos microarrays se usan, por ejemplo, para detectar la presencia del genoma de un virus o una bacteria en la sangre, y para determinar si en ellos existen mutaciones que los hacen resistentes a algunos fármacos antivirales o antibióticos, respectivamente. En general, una ventaja de los microarrays es su gran capacidad de «multiplexado», es decir, de analizar muchas muestras en paralelo. Así, las aplicaciones de los microarrays son numerosas en distintos campos de la biomedicina.
El siguiente paso en este campo se ha dado gracias a la nanotecnología, con la incorporación de nanomateriales a los biosensores (ver apartado 6.4) y con el uso de nuevos procedimientos de fabricación que permiten generar puntos de dimensiones nanométricas con las moléculas sensoras. Así, se dispone ya de «nanoarrays» de ADN y proteínas formados por puntos de entre 100 y 500 nm de diámetro (Figura 7.10), y se han desarrollado sensores formados incluso por moléculas individuales unidas a una superficie. Con ello, el proceso de detección de la molécula diana es más rápido, puede realizarse en mucho menos espacio, y es posible completar el análisis partiendo de cantidades muy pequeñas de muestra. Además, los nanoarrays permiten utilizar técnicas de detección distintas a la fluorescencia, algunas de las cuales no requieren ningún tipo de marcaje de la muestra problema, con lo que la sensibilidad de detección aumenta. En un campo que ya se conoce como nanoproteómica se están desarrollando nanoarrays de proteínas para detectar, en tiempo real y formato multiplex, proteínas o analitos poco abundantes en muestras naturales complejas. Así, se espera llegar a un nanochip con miles de puntos sensores que pudiera ser integrado en nuestro organismo, con el cual se analizarían y cuantificarían en tiempo real los componentes de la sangre.

FIGURA 7.10. Nanoarray de proteínas que contiene puntos de entre 100 y 300 nm de diámetro generados mediante técnicas nanolitográficas (figura adaptada de K. B. De Lee et al., Science, 2002).
La aplicación de la nanotecnología al mundo de los biosensores ha permitido construir otros sistemas analíticos totalmente diferentes a los conocidos hasta hace una década. Como ejemplo, se ha desarrollado un dispositivo basado en nanohilos de silicio, capaz de detectar y caracterizar virus individuales mediante el cambio en conductividad eléctrica que se produce en ellos al interaccionar con el virus. Estos nanocables pueden operar directamente al ser sumergidos en un fluido biológico natural (como agua, sangre o saliva), por lo que son utilizables como biosensores portátiles. Paralelamente, en la Universidad de California en Los Ángeles (EE.UU.) se ha desarrollado un material similar al velcro pero con dimensiones nanométricas, en el que los nanohilos de silicio están recubiertos de anticuerpos específicos contra ciertas proteínas que poseen en su membrana las células tumorales. Este «nanovelcro» es capaz de detectar y capturar las células cancerígenas que se desprenden de un tumor y circulan por los fluidos biológicos, lo que permite cuantificar su número y predecir la evolución de la enfermedad. Otra línea de investigación novedosa y muy prometedora consiste en unir los receptores olfativos (proteínas quimiosensoras de dimensiones nanométricas) de nuestra pituitaria a un dispositivo electrónico, generando así un biosensor capaz de «oler» artificialmente. Dichos nanosensores olfativos artificiales, también llamados «narices electrónicas», poseen aplicaciones clínicas ya que pueden implantarse en personas con el sentido del olfato atrofiado o alterado. Además tienen utilidad en la industria, por ejemplo para detectar la presencia de una sustancia tóxica o un gas explosivo en el aire, para analizar perfumes de manera sistemática, o para oler vinos sin la subjetividad del catador.
Con todo ello, los avances actuales permiten fabricar auténticos «laboratorios en miniatura» (conocidos en inglés como sistemas lab-on-a-chip), que integran nanobiosensores, sistemas de microfluídica, y componentes de excitación, lectura y análisis en un solo dispositivo. Así, un procedimiento analítico que hace pocos años requería el trabajo de varias personas en uno o más laboratorios se reduce extraordinariamente en cuanto a tamaño, velocidad de análisis y precio por muestra procesada. La posibilidad de disponer de biosensores miniaturizados y de gran sensibilidad es uno de los logros que nos están acercando al sueño de conseguir una medicina personalizada.
7.9. Los retos de la nanomedicina
Los múltiples avances conceptuales y tecnológicos descritos hasta este punto han hecho que la «nanomedicina» (también llamada «nanobiomedicina») se esté convirtiendo en una realidad esperanzadora. Esta disciplina emergente se basa en la combinación del estudio molecular del cuerpo humano con la posibilidad de construir dispositivos nanométricos, teniendo como objetivo mejorar el diagnóstico y proporcionar nuevas herramientas terapéuticas. En el ámbito del diagnóstico, se busca aumentar la sensibilidad y especificidad de las técnicas convencionales y desarrollar nanobiosensores de utilidad tanto in vitro como in vivo. En la dimensión terapéutica, la nanomedicina trata de optimizar fármacos ya existentes, desarrollar nuevos y más efectivos sistemas de suministro y dosificación de medicamentos, construir nanomateriales biocompatibles y poner a punto tecnologías alternativas para la ingeniería tisular y la medicina regenerativa. Además, al poder estudiar interacciones moleculares individuales, la nanotecnología permite comprender mejor el funcionamiento del cuerpo humano, y optimizar la respuesta clínica que debe darse cuando se produce una patología.
Uno de los campos en desarrollo es el nanodiagnóstico, que conlleva la utilización de nanodispositivos y nanobiosensores para identificar, a escala molecular, las enfermedades o la predisposición a ellas. Además, se intenta responder a un reto de la farmacología: poder detectar los potenciales efectos secundarios de los medicamentos antes de ser prescritos en sus dosis terapéuticas. Otra de las metas planteadas es optimizar el diagnóstico por imagen hasta poder visualizar moléculas individuales. Un curioso ejemplo de la aplicación de la nanomedicina al diagnóstico se está desarrollando en la Universidad Rovira i Virgili de Tarragona, donde colaboran con la industria textil para fabricar tejidos inteligentes que contienen un tinte elaborado con nanotubos de carbono modificados. Con ello, la ropa se convierte en un conductor eléctrico que detecta sustancias químicas presentes (por ejemplo, en el sudor) y diagnostica el estado de salud de quien la viste. Además de su uso en medicina, estos tejidos resultarían útiles en las prendas deportivas profesionales, al poder servir como sistemas de control antidopaje en tiempo real. En cuanto a las aplicaciones en terapia, uno de los retos de la nanomedicina consiste en el desarrollo de nuevos sistemas de liberación de fármacos, para mejorar la relación eficacia/toxicidad de las moléculas que constituyen el arsenal terapéutico disponible. Para ello se están poniendo a punto diferentes nanosistemas capaces de vehicular fármacos a las células o tejidos enfermos, tal como se expone en detalle en el apartado 7.10.
Tanto en diagnóstico como en terapia, uno de los campos de la medicina que más se está beneficiando de los avances en nanotecnología tiene que ver con el tratamiento del cáncer. Así, por ejemplo, el uso de nanopartículas metálicas (de las que se habla en el Capítulo 6) aumenta mucho el contraste de las pruebas diagnósticas basadas en resonancia magnética nuclear, con lo que se pueden detectar tumores en etapas muy tempranas de formación. En otros casos, estas nanopartículas permiten la destrucción de tejidos cancerosos o infectados mediante procesos de «ablación térmica»: una vez que han llegado a su diana (gracias a los anticuerpos que la recubren), utilizando campos electromagnéticos exteriores se induce un aumento rápido y muy localizado de su temperatura, destruyendo las células cercanas. Por otra parte, el desarrollo de nanosistemas dispensadores específicos para cada tejido tumoral permitirá reducir la dosis del fármaco (o combinación de ellos) administrado, y así limitar los efectos secundarios de la quimioterapia actual.
Otra de las aproximaciones terapéuticas más prometedoras es la denominada «nanomedicina regenerativa», que consiste en el desarrollo de tejidos mixtos entre moléculas biológicas y materiales nanoestructurados. Esta combinación está resultando muy útil para dirigir la proliferación, migración y diferenciación celular, para organizar o reparar la matriz extracelular de los tejidos (lo que se conoce como ingeniería tisular), y para construir prótesis o implantes biocompatibles que no originen problemas de rechazo. Como ejemplo, se han desarrollado nanofibras artificiales de péptidos (polímeros cortos formados por aminoácidos) que poseen un diámetro de unos 7 nm y son capaces de autoensamblarse y solidificar la solución que los contiene, lo que permite reconstruir tejidos humanos dañados. Se trabaja también con nanopolímeros diseñados para recubrir dispositivos artificiales que van a estar en contacto con la sangre, como válvulas cardíacas o catéteres, lo que dificulta la formación de coágulos y minimiza las respuestas adversas del organismo. Por otra parte, una línea de investigación desarrollada en la Universidad de Edimburgo (Reino Unido), que combina nanotecnología y medicina regenerativa, consiste en introducir nanopartículas magnéticas en células madre que, al ser inyectadas en el torrente sanguíneo, permiten seguir sus movimientos por el organismo mediante resonancia magnética nuclear. En el primer estudio clínico publicado se ha determinado que las células con nanopartículas se comportan igual que cualquier otra célula madre, y no se han detectado efectos secundarios debidos a dichos nanomateriales. Además, se ha podido seguir la migración de las células madre marcadas durante la semana siguiente a la inoculación, mostrándose cómo llegan a las zonas inflamadas que requerían regenerarse.
Otra línea de investigación relevante se basa en que, al poder manipular las moléculas biológicas individualmente, es posible construir «nanointerruptores genéticos» con los que se logra, por ejemplo, activar o desactivar un determinado gen. Ello podrá servir en el futuro para ralentizar o anular procesos celulares asociados con el cáncer, con otras enfermedades, o incluso con el envejecimiento. En este ámbito, se han desarrollado nanopartículas metálicas recubiertas con anticuerpos específicos que las dirigen a unas proteínas que ciertas células tienen insertadas en sus membranas y que funcionan como «canales» transportadores de sustancias, cuya apertura requiere un aumento local de la temperatura. Así, cuando las nanopartículas ya han llegado a su diana son estimuladas por radiación electromagnética con longitud de onda de las radiofrecuencias. Esta radiación atraviesa los tejidos biológicos sin modificarlos, calienta las nanopartículas al llegar a ellas, y la consiguiente apertura del canal proteico permite la entrada en la célula de iones calcio (Ca2+) presentes en el medio extracelular. Estos cationes son capaces de estimular la producción de insulina (una hormona de naturaleza proteica que desempeña un papel fundamental en la diabetes) intracelular, ya que dicha célula había sido modificada genéticamente para contener el gen que produce esta proteína bajo el control de un promotor (la región del genoma que actúa como interruptor para que un gen se exprese o no) inducible por calcio. Así, esta elegante combinación de nanotecnología e ingeniería genética ha permitido un logro impensable hace pocos años: desencadenar la producción de una hormona por control remoto.
7.10. Nanosistemas dispensadores de fármacos
La medicina actual requiere administrar fármacos a los pacientes de forma más eficiente, simplificando los sistemas tradicionales (que hasta ahora obligan a tomarlos repetitivamente por vía oral, nasal o tópica) y eliminando en lo posible los métodos más invasivos (por vía parenteral, en sus variantes subcutánea, intramuscular o intravenosa). En este sentido, desde hace algunos años se están desarrollando dispositivos electrónicos que se implantan bajo la piel y liberan automáticamente las dosis diarias de fármacos que necesita cada enfermo. Uno de los sistemas más modernos, fabricados por la compañía MicroCHIPS (originada en el Instituto de Tecnología de Massachusetts, MIT, EE.UU.), tiene un tamaño menor de 1 cm2, y se controla desde el exterior mediante tecnología inalámbrica. En el primer ensayo clínico concluido se ha utilizado con éxito durante un año para liberar cada día la dosis de un medicamento necesario para tratar la osteoporosis. Este fármaco estaba alojado en tantas microceldas como dosis eran necesarias durante el ensayo, que se abrían al recibir un impulso eléctrico desde el dispositivo de control exterior. Éste es un ejemplo de tecnología «micro» y aún no «nano», pero indica los nuevos caminos por los que está transitando la medicina.
Dando el salto al nanomundo, el desarrollo de nanosistemas dispensadores de fármacos busca generar estructuras capaces de dirigirse con precisión a un tejido enfermo y liberar en él los fármacos necesarios para sanarlo. Con ello, frente a los sistemas usados en la farmacología convencional, se logra aumentar la estabilidad y biodisponibilidad del fármaco, y además disminuir los efectos secundarios que podría producir en otros tejidos. Esta estrategia está siendo muy exitosa tanto en la investigación como en la industria, ya que distintas empresas farmacéuticas comercializan actualmente cerca de doscientos fármacos que incluyen nanosistemas dispensadores o coadyuvantes. Algunos de estos productos que ya están en el mercado se describirán en el Capítulo 8. Además, un dato relevante es que del total de nuevos compuestos en evaluación clínica para el tratamiento de distintos tipos de cáncer, aproximadamente un 10% (es decir, entre 40 y 50) implican nanoestructuras para su transporte y liberación.
Los fármacos transportables pueden ser moléculas orgánicas (naturales o de síntesis) de distintos tamaños, péptidos, enzimas, anticuerpos, proteínas, o distintos tipos de ácidos nucleicos. Entre estos últimos están los que bloquean determinados genes al hibridarse con ellos (por ejemplo los «ARN interferentes»), así como las moléculas obtenidas mediante procesos artificiales de «selección in vitro» (incluyendo los «aptámeros»: ácidos nucleicos cuya estructura tridimensional les permite unirse a cualquier molécula diana, de forma similar a como lo hace un anticuerpo con su antígeno). Por su parte, entre los nanosistemas dispensadores de estos fármacos están los formados por átomos metálicos (como las nanopartículas de oro, o las que poseen un núcleo magnético) o por una única entidad molecular (como los dendrímeros o los nanotubos de carbono). Además de estos nanosistemas (descritos en los Capítulos 4 y 6), otros contienen múltiples unidades moleculares ensambladas entre sí mediante enlaces no covalentes (como micelas, vesículas, liposomas, nanopartículas poliméricas o nanocápsulas), y también pueden utilizarse nanocontenedores naturales como cápsidas víricas vacías o virus completos inactivados. Algunos de estos ejemplos se muestran en la Figura 7.11. Para dirigir tales nanosistemas hacia su diana terapéutica (por ejemplo, una célula tumoral, una célula infectada, o una bacteria patógena) en su exterior se colocan biomoléculas como anticuerpos o ligandos específicos de dicha diana. En conjunto, estos nanosistemas dispensadores ofrecen la ventaja adicional de que, al proteger el fármaco durante su transporte por la sangre u otro fluido biológico, permiten preservar la funcionalidad de moléculas muy activas terapéuticamente pero que en condiciones normales se degradarían antes de llegar a su destino.

FIGURA 7.11. Ejemplos de nanosistemas dispensadores de fármacos: A. Dendrímero. B. Nanopartícula. C. Liposoma. D. Cápsida vacía de un virus.
Los nanosistemas dispensadores basados en vesículas artificiales o liposomas son contenedores esféricos formados por ácidos grasos o lípidos, respectivamente, y poseen por lo general entre 20 y 100 nm de diámetro. En su cavidad interior llevan una solución acuosa en la que está disuelto el fármaco, y en su membrana se pueden insertar proteínas que dirijan el nanosistema hacia su diana y desencadenen la fusión de ambas membranas. Algo similar se puede lograr empleando un virus modificado, al que se ha extraído o inactivado el genoma para que no sea infectivo, y que sirve únicamente como un vehículo de transporte especializado. En ambos casos, cuando la vesícula o el virus modificado llegan a la célula, la carga terapéutica se libera directamente en su interior.
En esta misma línea, pero sin necesidad de que el nanosistema vaya cargado con un fármaco, se ha demostrado que es posible modificar algunos virus para que sean capaces de dirigirse a células diferentes de sus dianas naturales, entrar en ellas y destruirlas. Así, uno de los ejemplos más esperanzadores se ha diseñado recientemente por colaboración entre el Instituto Catalán de Oncología y el Hospital Niño Jesús de Madrid, y consiste en el empleo de adenovirus del catarro (cuyo diámetro es de unos 100 nm) modificados para que reconozcan exclusivamente células tumorales del sistema nervioso. La replicación viral en su interior produce la lisis o ruptura de la célula, con lo que nuevos virus se liberan y siguen atacando más células del tumor. Tras los ensayos previos de seguridad (especialmente estrictos porque esta terapia va destinada a niños), ya está en marcha un ensayo clínico que estudia la eficacia terapéutica de este prometedor sistema.
Por su parte, un ejemplo reciente del uso de nanopartículas con estos fines ha permitido desarrollar nanopartículas porosas que liberan selectivamente fármacos en células humanas senescentes (es decir, envejecidas), o bien en aquellas que han entrado en fase degenerativa. En esta línea de investigación, llevada a cabo por el Instituto de Biología Molecular y Celular de Plantas de Valencia en colaboración con otros centros de nuestro país, las nanopartículas contienen en su superficie externa una molécula que impide la salida de la carga terapéutica hasta llegar a su destino, donde el fármaco se libera de forma selectiva. Las aplicaciones de este avance de la nanomedicina en cáncer, en Alzheimer o en la enfermedad de Parkinson son evidentes y muy esperanzadoras. Finalmente, los nanotubos de carbono también han demostrado su potencialidad para transportar moléculas bioactivas en su interior, en proyectos de investigación como uno recientemente financiado por la UE en el cual los nanotubos funcionalizados incluyen en su interior dos fármacos antitumorales: el nanosistema llega únicamente a las células cancerígenas y libera en ellas su carga terapéutica.
En resumen, a lo largo de este apartado se ha comprobado que la nanomedicina está poniendo en nuestras manos herramientas con las que se podrían lograr tres de las aspiraciones clásicas en la práctica clínica: ofrecer a cada paciente una medicina personalizada, ajustar exactamente la dosis de cada fármaco a las necesidades del enfermo, y dirigir con precisión y eficiencia los principios activos a los puntos concretos del cuerpo donde deben actuar. De hecho, los nanosistemas dispensadores de fármacos actuales son las aproximaciones más cercanas al concepto de «balas mágicas» propuesto hace un siglo por P. Ehrlich, el padre de la quimioterapia moderna. No obstante, a pesar de las buenas perspectivas que se derivan de la experiencia en cultivos celulares, en animales de laboratorio y en los primeros ensayos clínicos, hay que ser muy cautos antes de generalizar su uso en medicina. En la actualidad se están llevando a cabo ensayos en los que se analiza la posible toxicidad que alguno de estos vehículos (en particular, las nanopartículas metálicas) podría tener en nuestro organismo, los efectos secundarios producidos a distintas dosis, su estabilidad en diferentes fluidos biológicos y las reacciones que desencadenan en nuestro sistema inmune. Como se expondrá en el Capítulo 8, la bioseguridad es una condición imprescindible para la incorporación definitiva de la nanotecnología a la medicina.
7.11. Los nanorrobots del futuro
En el apartado anterior hemos visto que distintos tipos de nanosistemas pueden actuar como «nanosubmarinos» dispensadores de fármacos dentro de nuestro cuerpo. Ya que esto es posible, llevando la tecnología hasta el extremo podríamos preguntarnos si sería esperable que también lleguen a desarrollarse «nanorrobots» con funciones terapéuticas. Tales nanorobots o nanobots fueron propuestos por K. E. Drexler en 1986, en su obra Engines of Creation: the coming era of nanotechnology. Este libro imagina un futuro en el que distintos tipos de nanomáquinas (totalmente artificiales, o mixtas entre nanoestructuras artificiales y biomoléculas), con un tamaño menor o igual a nuestras células, podrían circular por el organismo para mejorar sus capacidades, destruir células cancerígenas, eliminar patógenos, o reparar rápidamente el daño sufrido en cualquier tejido.
En el mundo «micro» ya se han dado pasos hacia esa aún lejana meta. Por ejemplo, ingenieros y médicos del Real Instituto de Tecnología de Melbourne en Australia han inventado un micromotor que, con un tamaño de 250 μm, es capaz de navegar por las arterias cerebrales en busca de obstrucciones y aneurismas, tirando de un catéter al que guía hasta el punto exacto en el que debe actuar. Su uso podría aumentar la eficiencia en las intervenciones de neurocirugía, y reduciría el daño producido en los vasos sanguíneos cuando un catéter se introduce por ellos de forma convencional.
Evidentemente, para llegar al nanomundo se requeriría que las máquinas construidas tuvieran dimensiones entre mil y diez mil veces menores. Así, por el momento los nanorrobots son sólo ficción y no realidad. No obstante, merece la pena citar algunos de los que se han planteado durante los últimos años, principalmente por el grupo de R. A. Freitas (uno de los padres de la nanomedicina). Por ejemplo, han imaginado un dispositivo artificial que sería conceptualmente análogo a nuestros glóbulos rojos. Estas células, también llamadas eritrocitos o hematíes, tienen forma de disco bicóncavo de unos 7 μm de diámetro y son las encargadas de transportar oxígeno en nuestra sangre gracias a la presencia en ellas de la hemoglobina, una proteína que se une al oxígeno a través de un átomo de hierro que contiene (y que es el responsable del color de tales células y de nuestra sangre). Pues bien, el nanorrobot imaginado por Freitas se denomina «respirocito», tendría un diámetro de 1 μm y estaría dotado con la capacidad de almacenar y liberar hasta 236 veces más O2 que un glóbulo rojo (Figura 7.12A). Llevaría incorporados sensores químicos y de presión, y podría activarse y manipularse empleando ultrasonidos. Se ha llegado a proponer que una inyección de respirocitos nos permitiría vivir con el corazón parado durante cuatro horas o, sin llegar a esos extremos, contener la respiración (por ejemplo, para bucear «a pulmón») durante dos horas y media.
Otro curioso nanorrobot imaginado por el grupo de Freitas es el denominado «microbívoro»: una especie de macrófago artificial que sería capaz de destruir cualquier microorganismo patógeno presente en nuestro torrente sanguíneo, con una eficiencia mil veces mayor que las células del sistema inmune (Figura 7.12B).

FIGURA 7.12. Dos ejemplos de nanorrobots que se han propuesto durante los últimos años, pero que no podrán ser viables con esas configuraciones: A, Respirocitos; B, Microbívoros. Imágenes de R. A. Freitas (Instituto de fabricación molecular, California, EE.UU.).
A pesar de lo espectacular de estas propuestas, es altamente improbable que lleguen a hacerse realidad algún día. La principal razón es que nuestro sistema inmune es el resultado de millones de años de evolución biológica, y durante ese tiempo la selección natural ha estado optimizando constantemente la sensibilidad y especificidad de las células que lo componen. La bionanotecnología está avanzando mucho en la construcción de nanodispositivos que imitan o incluso mejoran ciertas capacidades de los seres vivos, pero la robustez, adaptabilidad y versatilidad de los sistemas biológicos complejos (en este caso, el sistema inmune) es por el momento inalcanzable para los nanotecnólogos.
La nanociencia y la nanotecnología están poniendo en nuestras manos ideas y productos revolucionarios, y como hemos visto a lo largo de este capítulo muchos de ellos son cada vez más útiles en biotecnología y medicina. Pero en cuanto a los nanorrobots, nada de lo propuesto hasta ahora tiene visos de poder llegar a existir. Las leyes de la física se cumplen siempre, también en el nanomundo, y esto incluye lo relacionado con las leyes de escala. Como se comentó en el Capítulo 2, ningún nanorrobot podrá ser el equivalente a una máquina artificial de nuestro mundo reducida a dimensiones nanométricas. Si alguna vez llegan a existir, los nanorrobots probablemente se parezcan a las nanomáquinas naturales de las que hablábamos en el apartado 7.4, quizá asociadas a algún nanomaterial que las ayude a realizar una función concreta. Frente a la lógica y eficiencia que nos ofrecen las biomoléculas naturales y sus agregados, los textos de Drexler y Freitas sobre nanorrobots son, al igual que la famosa película Viaje alucinante, obras entretenidas e incluso sugerentes… pero situadas en el ámbito de la literatura, no en el de la ciencia.