БОЛЬ И УДОВОЛЬСТВИЕ
@neurovarvara
Ещё давно философы, такие как Бентам, Спиноза и Декарт, предполагали, что боль и удовольствие являются частями одного континуума. С биологической точки зрения вознаграждение (удовольствие) и наказание (боль) помогают животным чего-то достигать или избегать, соответственно, что способствует их выживанию. Например, добывать пищу и избегать хищников. Система боли-удовольствия существует также для поддержания гомеостаза (постоянства внутренней среды) организма, и боль в ней свидетельствует об отклонении каких-то параметров внутри организма от нормы (Cabanac, 1979; Cannon, 1932; Craig, 2003).
Связь между болью и удовольствием существует благодаря тому, что нейронные сети, регулирующие боль и удовольствие, перекрываются, что позволяет им ощущаться одновременно (Leknes & Tracey, 2008; Silva, 2015). Известное явление аналгезии (уменьшения болевой чувствительности), вызванной удовольствием, в том числе сексуальным (Forsberg et al., 1987; Szechtman, Hershkowitz & Simantov, 1981), существует благодаря тесной взаиморегуляции нейромедиаторных систем, включённых в регуляцию приятных и болевых ощущений.
На анатомическом уровне, за модуляцию и боли, и удовольствия отвечают одинаковые области мозга, такие как миндалина, бледный шар и прилежащее ядро. Все три области могут выделять эндогенные мю-опиоиды во время болевой стимуляции у людей (Zubieta et al., 2005; Wager, Scott, & Zubieta, 2007). Данные вещества вызывают позитивный настрой, снижают болевую чувствительность, увеличивают удовольствие от приятных стимулов и уменьшают от неприятных, в том числе болевых (Fields, Basbaum & Heinricher, 2005). Миндалина модулирует болевые ощущения через прямые связи с нисходящей болевой ингибиторной системой (Fields, 2007; Bingel et al., 2006), то есть с системой, идущей от головного мозга к спинному и уменьшающей болевые сигналы.
Нисходящая модуляторная (изменяющая болевую чувствительность) цепь подавляет болевые ощущения путём посыла тормозных сигналов, которые заставляют «замолчать» нервные клетки определенного сегмента спинного мозга (Ossipov et al., 2010). Определенные нейромедиаторы, такие как серотонин, норадреналин и дофамин, играют роль в спинальном нисходящем ингибировании боли (Basbaum & Fields, 1978; Cui et al., 1999; Wood, 2008).
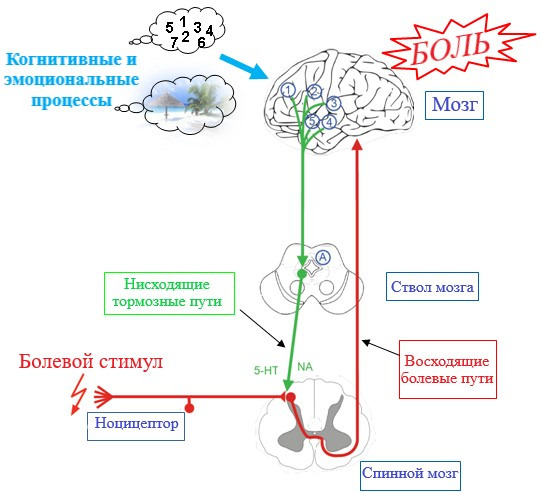
Также мозг регулирует переживание боли с помощью нисходящих импульсов, опосредованных эндорфинами (Ossipov, Dussor, & Porreca, 2010). Эти вещества блокируют в центральной нервной системе другой нейромедиатор – гамма-аминомасляную кислоту (ГАМК). В свою очередь, блокировка ГАМК увеличивает выработку дофамина, который связан с ожиданием получения вознаграждения/удовольствия. Было показано, что люди испытывают удовольствие от болевых ощущений, в частности, из-за эндорфина, выброс которого сопровождает боль (Hébert & Weaver, 2015).
Болевые воздействия, даже не причиняющие физического вреда, вызывают повышения уровня адреналина в организме (Dietrich & McDaniel, 2004), который вызывает мобилизацию всего организма. Кроме того, стимуляция болевых рецепторов активирует эндоканнабиноидную систему (Richardson, 2000; Richardson, Kilo & Hargreaves, 1998; Calignano et al., 2000). Эндоканнабиноиды, в том числе анандамид, повышают настроение, создают ощущение благополучия, уменьшают тревогу и болевые ощущения (Calignano et al., 1998; Dietrich & McDaniel, 2004; Ogles & Masters, 2003; Sachs & Pargman, 1979; Watkins & Mayer, 1982). Также они напрямую воздействуют на половые гормоны и влияют на половое поведение (Gorzalka, Hill & Chang, 2010).
Психологические и эмоциональные факторы, а также контекст, тоже могут модулировать передачу болевого сигнала (см. обзор Lumley et al., 2011). На переживание боли также могут влиять присутствие любимого человека (Montoya et al., 2004), зрительные стимулы (Kamping et al., 2016), сексуальное возбуждение (Kender et al., 2008), эмоции (Franklin, 1998) и воспоминания (Sacco & Sacchetti, 2010).
Список литературы:
Basbaum A.I., Fields H.S. Endogenous pain control mechanisms: Review and hypotheses. Annals of Neurology. 1978. 4: 451–462.
Bingel U., Lorenz J., Schoell E., Weiller C., Buchel C. Mechanisms of placebo analgesia: rACC recruitment of a subcortical antinociceptive network. Pain. 2006. 120: 8–15.
Cabanac M. Sensory pleasure. Q. Rev. Biol. 1979. 54: 1–29.
Calignano A., Katona I., Desarnaud F., Giuffrida A., La Rana G., Mackie K., Freund T.F., Piomelli D. Bidirectional control of airway responsiveness by endogenous cannabinoids. Nature. 2000. 408: 96–101.
Calignano A., La Rana G., Giuffrida A., Piomelli D. Control of pain initiation by endogenous cannabinoids. Nature. 1998. 394: 277–281.
Cannon W.B. The wisdom of the body.Norton and Co., New York. 1932.
Craig A.D. A new view of pain as a homeostatic emotion. Trends Neurosci. 2003. 26: 303–307.
Cui M., Feng Y., McAdoo D.J., Willis W.D. Periaqueductal gray stimulation-induced inhibition of nociceptive dorsal horn neurons in rats is associated with the release of norepinephrine, serotonin, and amino acids. Journal of Pharmacology and Experimental Therapeutics. 1999. 289: 868–876.
Dietrich A., McDaniel W.F. Endocannabinoids and exercise. British Journal of Sports Medicine. 2004. 38: 536–541.
Fields H.L. Understanding how opioids contribute to reward and analgesia. Regional Anesthesia and Pain Medicine. 2007. 32: 242–246.
Fields H.L., Basbaum A.I., Heinricher M.M. Central nervous system mechanism of pain modulation. In S. McMahon & M. Koltzenburg (Eds.), Textbook of pain (5th ed., pp. 125–142). Burlington, MA: Elsevier Health Sciences. 2005.
Forsberg G., Wiesenfeld-Hallin Z., Eneroth P., Sodersten P. Sexual behavior induces naloxonereversible hypoalgesia in male rats. Neurosci. Lett. 1987. 81: 151–154.
Franklin K.B.J. Analgesia and abuse potential: An accidental association or a common substrate? Pharmacology Biochemistry and Behavior. 1998. 59: 993–1002.
Gorzalka B.B., Hill M.N., Chang S.C. Male–female differences in the effects of cannabinoids on sexual behavior and gonadal hormone function. Hormones and Behavior. 2010. 58: 91–99.
Hébert A., Weaver A. Perks, problems, and the people who play: A qualitative exploration of dominant and submissive BDSM roles. The Canadian Journal of Human Sexuality. 2015. 24: 49–62.
Kamping S., Andoh J., Bomba I.C., Diers M., Diesch E., Flor H. Contextual modulation of pain in masochists: Involvement of the parietal operculum and insula. Pain. 2016. 157: 445–455.
Kender R.G., Harte S.E., Munn E.M., Borszcz G.S. Affective analgesia following muscarinic activation of the ventral tegmental area in rats. The Journal of Pain. 2008. 9: 597–605.
Leknes S., Tracey I. A common neurobiology for pain and pleasure. Nature Reviews Neuroscience. 2008. 9: 314–320.
Lumley M.A., Cohen J.L., Borszcz G.S., Cano A., Radcliffe A.M., Porter L.S., Schubiner H., Keefe F.J. Pain and emotion: A biopsychosocial review of recent research. Journal of Clinical Psychology. 2011. 67: 942–968.
Montoya P., Larbig W., Braun C., Preissl H., Birbaumer N. Influence of social support and emotional context on pain processing and magnetic brain responses in fibromyalgia. Arthritis & Rheumatism. 2004. 50: 4035–4044.
Ogles B.M., Masters K.S. A typology of marathon runners based on cluster analysis of motivations. Journal of Sport Behavior. 2003. 26: 69–85.
Ossipov M.H., Dussor G.O., Porreca F. Central modulation of pain. The Journal of Clinical Investigation. 2010. 120: 3779–3787.
Richardson J.D. Cannabinoids modulate pain by multiple mechanisms of action. The Journal of Pain. 2000. 1: 2–14.
Richardson J.D., Kilo S., Hargreaves K.M. Cannabinoids reduce hyperalgesia and inflammation via interaction with peripheral CB 1 receptors. Pain. 1998. 75: 111–119.
Sacco T., Sacchetti B. Role of secondary sensory cortices in emotional memory storage and retrieval in rats. Science. 2010. 329: 649–656.
Sachs M.L., Pargman D. Running addiction: A depth interview examination. Journal of Sport Behavior. 1979. 2: 143–155.
Silva A.D. Through pain, more gain? A survey into the psychosocial benefits of sadomasochism (Master’s thesis). 2015. Retrieved from https://www.duo.uio.no/handle/10852/48652
Szechtman H., Hershkowitz M., Simantov R. Sexual behavior decreases pain sensitivity and stimulated endogenous opioids in male rats. Eur. J. Pharmacol. 1981. 70: 279–285.
Wager T.D., Scott D.J., Zubieta J.K. Placebo effects on human μ-opioid activity during pain. Proc. Natl Acad. Sci. USA. 2007. 104: 11056–11061.
Watkins L.R., Mayer D.J. Organization of endogenous opiate and nonopiate pain control systems. Science. 1982. 216: 1185–1192.
Wood P.B. Role of central dopamine in pain and analgesia. Expert Review of Neurotherapeutics. 2008. 8: 781–797.
Zubieta J.‑K., Bueller J.A., Jackson L.R., Scott D.J., Xu Y., Koeppe R.A., Nichols T.E., Stohler C.S. Placebo effects mediated by endogenous opioid activity on μ-opioid receptors. J. Neurosci. 2005. 25: 7754–7762.