Амиксин Суспензия

🛑 👉🏻👉🏻👉🏻 ИНФОРМАЦИЯ ДОСТУПНА ЗДЕСЬ ЖМИТЕ 👈🏻👈🏻👈🏻
Для специалистов здравоохранения!
Соглашение об использовании
catad_tema Патология иммунной системы - статьи
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Если Вы медицинский специалист,
войдите
или зарегистрируйтесь
Если Вы уже регистрировались, введите e-mail и пароль
С. Григорян 1 , доктор медицинских наук, профессор, Е. Исаева 1 , кандидат биологических наук, B. Бакалов 1 , Е. Осипова 2 , кандидат медицинских наук, А. Бевз 2 , кандидат медицинских наук, И. Простяков 3 , кандидат медицинских наук, C. Надоров 3 , кандидат биологических наук 1 Федеральный научно-исследовательский центр эпидемиологии и микробиологии им. Н.Ф. Гамалеи, Москва 2 ПАО Отисифарм, Москва 3 ОАО Фармстандарт, Долгопрудный E-mail: aybevz@otcpharm.ru
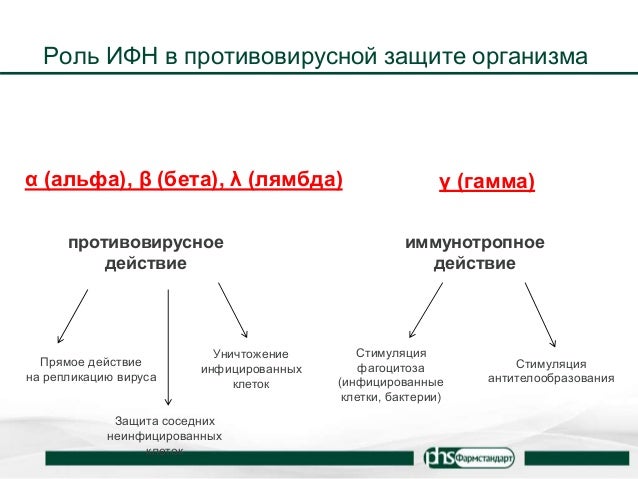
В строго контролируемых лабораторных условиях, соответствующих принципам доказательной медицины, идентифицированы все известные 3 типа ИФН (α/β, γ, λ ), которые индуцируются препаратом Амиксин в крови и легочной ткани. Подробно изучены динамика, последовательность и профиль их системной и локальной продукции. Индукция препаратом Амиксин эндогенных ИФН 1-го, 2-го и 3-го типов в крови и легочной ткани активирует врожденный и адаптивный иммунный ответ, сохраняет иммунный гомеостаз собственного организма и предотвращает и (или) прерывает синтез вирусных нуклеиновых кислот и вирус-специфических белков, не вызывая характерных для экзогенных препаратов ИФН побочных эффектов.
Ключевые слова: индукция синтеза интерферонов, Амиксин, активация врожденного и адаптивного иммунного ответа.
Амиксин (тилорон) — низкомолекулярный синтетический индуктор синтеза интерферона (ИФН) — относится к классу флуоренонов, ИФН-индуцирующая способность которого при пероральном введении была впервые установлена в 1970 г. G. Mayer, R. Kruger [1]. Из имеющихся сегодня на фармацевтическом рынке индукторов ИФН Амиксин наиболее изучен. Более чем 30-летний опыт клинического применения свидетельствует о его безопасности и эффективности при широком круге заболеваний инфекционного и неинфекционного генеза [2]. Несмотря на разнообразие генетического материала вирусов, Амиксин, как и ИФН, подавляет фундаментальные процессы их репродукции на стадиях, обязательных для всех вирусов: блокирует адсорбцию вирусов; синтез вирусспецифических белков и сборку зрелых вирусных частиц, распознавая и дискриминируя вирусные информационные РНК от клеточных; подавляет внутриклеточное размножение вирусов. Именно поэтому к действию Амиксина чувствительны практически все РНК- или ДНК-содержащие вирусы [3, 4].
Семейство ИФН является ключевым компонентом врожденного и адаптивного иммунитета, обеспечивающим 1-ю линию защиты организма от инфекционных агентов [5]. В настоящее время идентифицированы 3 типа ИФН:
Известно, что Амиксин стимулирует выработку в организме эндогенных ИФН, которые в ранних исследованиях тестировались биологическим методом — по противовирусному действию — и были отнесены к ИФНα, -β (1-й тип) и -γ (2-й тип) [2, 3]. Хотя 1-й мишенью контакта и воздействия Амик-сина является ЖКТ, где ведущую роль в продукции ИФН выполняют ассоциированные с тонким кишечником лимфо-идные образования (GALT — gut associated lymphoid tissue) — пейеровы бляшки, иммунокомпетентные клетки кишечника обладают уникальной способностью к миграции, и потому их стимуляция взывает активацию иммунной системы не только ЖКТ, но и легочного, урогенитального трактов и системного иммунитета [17]. Амиксин вызывает длительную циркуляцию в крови терапевтических доз ИФН, которые предотвращают инфицирование незараженных клеток и создают барьерное антивирусное состояние. Максимальная продукция ИФН в крови людей после 4-кратного еженедельного приема Амик-сина достигает в среднем 64—128 ед/мл, и она сохраняется до 8-й недели включительно [18].
Для оптимизации клинического применения индуктора ИФН — Амиксина — представлялось целесообразным: в рамках доклинического исследования, в строго контролируемых лабораторных условиях, основанных на принципах доказательной медицины, идентифицировать и провести сравнительное изучение индукции препаратом Амиксин ИФНα (1-й тип), -β (1-й тип), -γ (2-й тип) и -γ (3-й тип) в сыворотке крови и легочной ткани экспериментальных животных с использованием современных методов определения типовой принадлежности индуцируемых ИФН; определить последовательность их продукции, продолжительность аккумуляции и установить зависимость динамики индукции — продукции ИФН 1-го, 2-го и 3-го типов — в сыворотке и легочной ткани от дозы вводимого препарата. Подобные исследования препарата Амиксин ранее не проводились.
Целью настоящего исследования было идентифицировать на молекулярном уровне экспериментальные данные по индукции ИФНа и β (1-й тип), -γ (2-й тип) и - λ
(3-й тип) в сыворотке крови и легочной ткани мышей препаратом Амиксин (таблетки, покрытые пленочной оболочкой, 125 мг, производитель ОАО Фармстандарт-Томскхимфарм, Россия) при его однократном пероральном (внутрижелудочном) введении в 3 дозах: 20; 40 и 400 мг/кг, рассчитанных эквивалентно разовой, максимальной суточной и десятикратной суточной дозам для человека [19], и оценить динамику продукции ИФНа, -β, -γ и -λ2/3 в сыворотке и легочной ткани мышей под действием препарата Амиксин в 3 разных дозах в течение 120 ч; продукция ИФН отслеживалась в сроки: 0; 4; 8; 12; 24; 48; 72; 96 и 120 ч.
Исследования проводились в 2 этапа:
На 1-м этапе использовались самки 55 мышей линии СВА/СаО1аНМ массой 19—30 г, полученные из вивария Harlan Laboratories (Нидерланды), на 2-м — самки 85 мышей линии СВА/CaOlaHsd массой 18—20 г, полученные из питомника Андреевка Научного центра биомедицинских технологий РАМН.
Содержание животных, их питание и уход за ними в ходе эксперимента соответствовали требованиям Правил проведения работ с использованием экспериментальных животных (Приказ Минздравсоцразвития России от 23.08.10 №708н). Этические принципы обращения с лабораторными животными соблюдались в соответствии с European Convention for the Protection of Vertebral Animals Used for Experimental and Other Scientific Purposes. CETS №123. Перед исследованием животные подвергались 5-дневному карантину
Исследуемый препарат — Амиксин (тилорон), лекарственная форма: таблетки, покрытые пленочной оболочкой, 125 мг, ОАО Фармстандарт-Томскхимфарм, 634009 (Россия, Томск).
Исследуемый препарат растворяли в стерильной дистиллированной воде в концентрациях, соответствующих вводимым дозам (20; 40 и 400 мг/кг). Экспериментальные животные распределялись на 2 или 3 группы соответственно этапу исследования и дозам вводимого препарата. Подбор животных в группы осуществлялся случайным образом. Каждую дозу препарата Амиксин вводили мышам однократно перо-рально (внутрижелудочно) в объеме 50 мкл специальными дозированными зондами, размеры которых соответствовали физиологической длине пищевода животных. В каждый срок исследования использовали по 3 мыши.
Мышей выдерживали под легким эфирным наркозом до исчезновения ноцицептивных рефлексов. Забор крови производили методом декапитации в стерильных условиях. Образцы крови, полученные в каждый срок исследования, состояли из пула (смеси) крови от 3 мышей в объеме 3 мл (по 1 мл от каждой особи), из которого после центрифугирования в режиме 5000 об/мин в течение 15 мин отбирали надосадочную сыворотку в объеме 1,0 мл в стерильные пробирки типа Эппен-дорф. Сыворотки крови мышей, соответствующие каждому сроку забора, разделяли на аликвоты по 0,3 мл в 3 стерильные пробирки Эппендорф, каждую из которых хранили при температуре -70°C до проведения соответствующего иммунофер-ментного анализа (ИФА). Для получения суспензии легочной ткани обескровленных мышей фиксировали на специальных парафиновых подложках, в асептических условиях вскрывали грудную клетку, изолировали и извлекали легкие (правое и левое), которые последовательно 3-кратно промывали в буфере Hepes и в питательной среде №199, взвешивали и размельчали сначала в ступке, а затем — в специальном гомогенизаторе. Все процедуры проводились в кратчайшие сроки и на холоде. Разрушение клеток ткани легкого достигалось 3-кратным замораживанием и оттаиванием. Готовилась 10% суспензия го-могената в питательной среде №199. Супернатанты суспензии гомогената легочной ткани после низкоскоростного центрифугирования (при 1600 об/мин в течение 30 мин) отбирали и замораживали при температуре -70°С до последующего исследования методом ИФА.
ОПРЕДЕЛЕНИЕ ИФН а, β, -γ И - λ
В СЫВОРОТКЕ КРОВИ И ЛЕГОЧНОЙ ТКАНИ МЫШЕЙ
Содержание ИФНа, β, -γ, и -λ2/3 в пробах сывороток и супернатантов 10% суспензии гомогенатов легочной ткани мышей определяли в сроки 0; 4; 8; 12; 24; 48; 72; 96 и 120 ч (3 мыши в каждый срок) после однократного перорально-го (внутрижелудочного) введения Амиксина в дозах 20; 40 и 400 мг/кг.
Содержание ИФНа, β, -γ и -Я2/3 (ИЛ28А/В) в сыворотке крови и надосадочной жидкости 10% суспензии легочной ткани c последующим пересчетом соответственно на 1 мл и 1 мг легочной ткани определяли методом ИФА с использованием следующих коммерческих тест-систем согласно инструкции производителя:
Расчет оптической плотности исследуемых проб проводили на спектрофотометре — ридере Anthos Labtec — c использованием вошера и шейкера (Instruments GmbH, Австрия) с последующей обработкой и преобразованием данных в пикограммы в 1 мл и 1 мг (пкг/мл и пкг/мг) по компьютерной программе Software ADAP. Все исследования повторяли 2 раза.
Результаты подвергали статистической обработке путем расчета среднего арифметического (M) и стандартной ошибки (+a). Статистическую значимость различий при межгрупповых сравнениях оценивали, используя двусторонний t-критерий Стьюдента для независимых групп. Для статистических расчетов применяли компьютерную программу Microsoft Excel 2009.
ИНДУКЦИЯ ИФН а, β, -γ И - λ В СЫВОРОТКЕ КРОВИ МЫШЕЙ ПРЕПАРАТОМ АМИКСИН
Однократное пероральное введение Амиксина в дозах 40 и 400 мг/кг вызывало дозозависимую индукцию и продукцию ИФНа и ИФНλ2/3 в сыворотке крови мышей; максимальное их содержание через 24 ч после введения препарата в дозе 40 мг/кг составляло соответственно 176,0±1,0 и 398±12 пкг/мл, а в дозе 400 мг/кг — соответственно 1337+93 и 2231+93 пкг/мл. Уровень продукции ИФНλ2/3 в сыворотке крови мышей под действием Амиксина в дозе 40 и 400 мг/кг в этот срок значительно (соответственно в 7,5 и 5,6 раза) был выше, чем ИФН (рис. 1).
Сопоставимыми были динамика индукции и накопления в крови ИФНβ и -γ под действием Амиксина, максимальный уровень которых достигался также через 24 ч после однократного введения препарата. Однако содержание ИФН-β и -γ в сыворотке крови экспериментальных животных на пике их продукции было ниже, чем ИФН-а и -λ2/3. При дозе Амиксина 40 мг/кг максимальный уровень синтеза ИФН-β и ИФН-γ в крови определялся на уровне фоновых терапевтических значений (соответственно 8,1+4,3 и 4,4+1,2 пкг/мл). При дозе 400 мг/кг максимальные количества ИФНр и -γ через 24 ч после введения препарата увеличивались в среднем в 10 раз в сравнении с таковыми при дозе 40 мг/кг, а в сравнении с контролем — соответственно в 110 и 46 раз (рис. 2).
По совокупности результатов, представленных на рис. 1 и 2, однократное пероральное введение Амиксина в дозах 40 и 400 мг/кг вызывало индукцию в сыворотке крови экспериментальных животных всех типов ИФН — ИФНа, β, -γ, -λ, но количество ИФНλ, и α было выше, чем ИФН-β и -γ в среднем в 10 раз.
ИНДУКЦИЯ ИФН а И -X В ЛЕГОЧНОЙ ТКАНИ МЫШЕЙ ПРЕПАРАТОМ АМИКСИН
Таким образом, по результатам 1-го этапа исследования были установлены индукция Амиксином всех 3 типов ИФН в сыворотке крови мышей и преобладание в ней продукции ИФНа и -λ2/3. На 2-м этапе была более детально изучена динамика локальной продукции ИФНа и -λ2/3 в легочной ткани мышей при введении препарата в 3 дозах: 20; 40 и 400 мг/кг.
Инициация индукции ИФНа в легочной ткани мышей выражалась в 2-кратном повышении через 24 ч после введения Амиксина в дозе 400 мг/кг среднестатистических значений его выработки относительно нулевой точки, а максимальные количества (1125 пкг/мг) синтезировались и аккумулировались только через 48 ч после индукции той же дозой препарата (рис. 3).
Низкая доза препарата через 96 ч после его введения также вызывала 2-кратное повышение содержания ИФН-а по сравнению с контролем. Увеличение дозы вводимого препарата до 40 мг/кг сопровождалось сокращением срока индукции максимальных количеств ИФНа в легочной ткани мышей к 48 ч (595,0 пкг/мг), причем в течение последующих 24 ч синтез ИФН-а сохранялся на уровне 335,0 пкг/мг
В целом под действием разных доз Амиксина в легочной ткани мышей определялась дозозависимая, но более поздняя, чем в сыворотке крови, продукция ИФН-а (см. рис. 3).
Амиксин в возрастающих от 20 до 400 мг/кг дозах вызывал также индукцию продукции в легочной ткани мышей ИФНλ, среднестатистические значения количества которого на пике продукции составляли соответственно 675,0 и 1547,5 пкг/мг. Из данных, представленных на рис. 4, следует, что через 48 ч после введения Амиксина в низкой дозе — 20 мг/кг — в легочной ткани мышей определялось 6-кратное повышение содержания ИФНλ2/3 относительно контроля в нулевой точке.
Увеличение дозы препарата до 40 мг/кг повышало содержание в легочной ткани мышей ИФНλ2/3 до 1405,0 пкг/мг и сокращало срок индукции его максимальной продукции на 24 ч относительно низкой дозы. Иными словами, 2-кратное увеличение дозы однократно вводимого Амиксина приводило к 2-кратному повышению количества синтезированного ИФНλ2/3 и 2-кратному сокращению срока достижения пика его продукции. Максимальная доза препарата — 400 мг/кг — смещала пик индукции ИФНλ2/3 в легочной ткани мышей к 12 ч, а уровень его продукции достигал 1547,5 пкг/мг. При использовании Амиксина в дозах 20 и 40 мг/кг продолжительность синтеза ИФНλ2/3 относительно нулевой точки и его аккумуляции в легочной ткани экспериментальных животных составляла соответственно 96 ч и 72 ч. Максимальная доза препарата — 400 мг/мг — вызывала более быстрый (12 ч) и значительный подъем продукции ИФНλ2/3 (1547,5 пкг/мг), которая сохранялась на достаточном уровне (347,5 пкг/мг) относительно контроля до 24 ч включительно.
Таким образом, динамика продукции ИФНλ2/3 в легочной ткани мышей показала, что увеличение однократной пероральной дозы препарата Амиксин сокращает срок достижения пика продукции ИФНλ2/3. В дозах 20; 40 и 400 мг/ кг максимальный синтез ИФНλ2/3 в легочной ткани тестируется соответственно через 48; 24 и 12 ч после введения препарата. При этом 2-кратное повышение дозы Амиксина с 20 до 40 мг/кг вызывает более чем 2-кратное увеличение количества синтезированного в легочной ткани ИФНλ2/3 на пике его максимальной продукции соответственно с 675,00+5,94 до 1405,00+9,86 пкг/мг. При последующем 10-кратном повышении дозы препарата — с 40 до 400 мг/кг — срок достижения максимальной продукции сокращается до 12 ч, но ее уровень практически сохраняется таким, как при введении препарата в дозе 40 мг/кг через 24 ч — соответственно 1547,5+3,7 и 1405,00+9,86 пкг/мг (см. рис. 4).
СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА ДИНАМИКИ ПРОДУКЦИИ ИФН а И - λ
В СЫВОРОТКЕ И ЛЕГОЧНОЙ ТКАНИ МЫШЕЙ ПРЕПАРАТОМ АМИКСИН
Сравнительный анализ индукции ИФН-а в сыворотке крови и легочной ткани мышей препаратом Амиксин в дозе 400 мг/кг показал, что его продукция в легочной ткани значительно (в 2,8 раза) выше, чем в сыворотке крови. Однако пик продукции ИФНа в сыворотке крови определялся через 24 ч после однократного введения препарата, максимальная же продукция ИФН-а в легочной ткани мышей тестировалась только через 48 ч. Иными словами, продукция ИФНа под действием Амиксина определялась сначала в сыворотке крови (через 24 ч после введения), а затем — в легочной ткани (через 48 ч), но в легочной ткани ИФН-а было больше (рис. 5).
Максимальный уровень продукции ИФН-λ2/3 в легочной ткани мышей под действием Амиксина в дозе 400 мг/кг достигался через 12 ч после введения препарата и составлял 1547,5+3,7 пкг/мг, а пик его продукции в сыворотке крови тестировался через 24 ч после введения препарата и составлял 2231+93 пкг/мл, что превышало содержание ИФНλ2/3 в легочной ткани на пике его продукции в 1,4 раза. Иными словами, максимальный синтез ИФН-λ2/3 в легочной ткани достигался быстрее, чем в сыворотке крови мышей, но его количество было меньше (рис. 6).
Таким образом, индукция и продукция ИФНа в сыворотке крови опережает таковую в легочной ткани на 24 ч, но на пике продукции количество ИФН-а в сыворотке крови значительно уступает таковому в легочной ткани (в 2,8 раза), а индукция и продукция ИФНλ2/3 в легочной ткани опережает таковую в сыворотке крови мышей на 12 ч, но на пике продукции количественно тестируется на более низком уровне, чем в сыворотке крови мышей (в 1,4 раза; см. рис. 6).
Сравнительный анализ результатов индукции ИФНа и -λ2/3 в сыворотке крови мышей под действием однократной дозы Амиксина 400 мг/кг показал, что срок достижения их максимальной продукции совпадает — через 24 ч после введения препарата. Однако количество в крови ИФНλ2/3 на пике его продукции в 5,6 раза выше, чем ИФНа (соответственно 2231+93 и 398+12 пкг/мл; рис. 7).
В легочной ткани мышей максимальный синтез ИФНλ2/3 под действием Амиксина в той же дозе опережает синтез ИФНа на 36 ч и превосходит его количественно в 1,4 раза (соответственно 1547+3 и 1125,00+14,43 пкг/мг; рис. 8).
Итак, исходя из суммарных данных исследования и их сравнительного анализа, препарат Амиксин в дозе 40 мг/кг (эквивалентной суточной дозе для человека) вызывает пролонгированную системную индукцию и продукцию ИФНа, -β, -γ и- λ в сыворотке крови, максимальный уровень которых определяется уже через 24 ч после введения препарата, а фоновые значения сохраняются до 120 ч (5 сут) включительно. Одновременно Амиксин в дозе 40 мг/кг индуцирует пролонгированную локальную продукцию ИФНλ, и α в легочной ткани экспериментальных животных, максимальный уровень которой тестируется соответственно через 24 и 48 ч после введения препарата и также сохраняется на терапевтических значениях до 96 и 120 ч включительно.
Динамика аккумуляции ИФНа, β, -γ и - λ в крови при использовании препарата Амиксин в дозе 400 мг/кг (эквивалентной курсовой для людей) аналогична таковой при дозе 40 мг/кг, но количества ИФНа и -Я, синтезированных на пике продукции, увеличиваются в среднем в 2 раза, а ИФНр и -γ — в 10 раз и сохраняются на уровне терапевтических значений в течение 120 ч. Максимальная локальная продукция ИФНа в легочной ткани мышей под действием Амиксина в дозе 400 мг/кг определяется через 48 ч, а синтез максимальных количеств ИФНλ2/3 увеличивается и ускоряется на 36 ч, опережая максимальную продукцию ИФНа в легочной ткани при дозе препарата 400 мг/кг. В последующие сроки исследования до 120 ч включительно в легочной ткани экспериментальных животных определяется локальная продукция терапевтического количества как ИФНа, так и ИФНλ.
Таким образом, однократный прием препарата Амиксин в дозе, эквивалентной суточной дозе для человека, в течение первых 24 ч инд
Поможет Ли Амброксол
Амбробене Стоптуссин Для Ингаляций
Актовегин Уколы Применение Внутримышечно
Аллохол С Похмелья Отзывы
Аллегра Коул И Долли Фокс
Амиксин® (Amixin), инструкция, способ применения и дозы ...
Амоксициллин (суспензия) - STADA
Амиксин при ОРВИ: как применять, официальная инстру…
«Арбидол» и «Амиксин» — отличие средств и что лучше | В ...
Амизон: аналоги, инструкция по применению, цена, отзывы
Амиксин 125 мг - современный мощный противовирусный и ...
Амоксициллин - инструкция по применению, аналоги, отзывы, ц…
Амиксин 60 мг - современный мощный противовирусный и ...
Амиксин применение для детей и взрослых, инструкция по ...
Амиксин Суспензия



































-amiksin-is-0%2c125-g-tabletki-%e2%84%963-20.jpg)