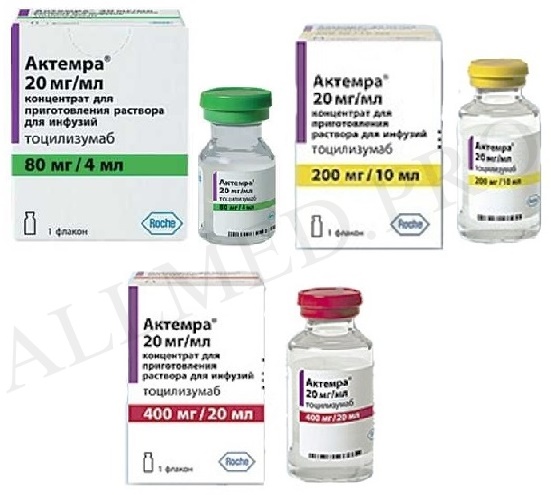
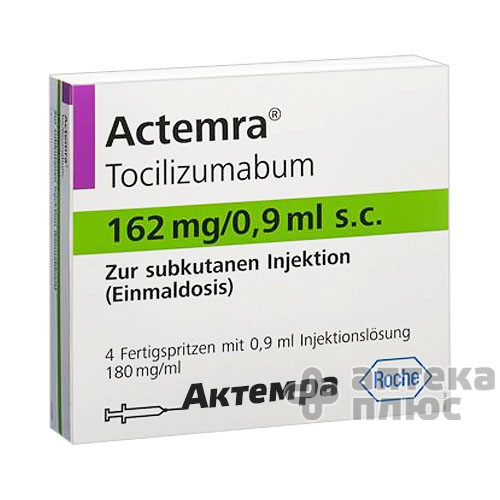
Актемра 162

🛑 👉🏻👉🏻👉🏻 ИНФОРМАЦИЯ ДОСТУПНА ЗДЕСЬ ЖМИТЕ 👈🏻👈🏻👈🏻
Актемра раствор для инъекций 162мг/0,9мл
Источники информации: ЕГК , Государственный реестр лекарственных средств
концентрат для приготовления инъекционного раствора 20мг/мл 4мл
концентрат для приготовления инъекционного раствора 20мг/мл 10мл
концентрат для приготовления инъекционного раствора 20мг/мл 20мл
Иммунодепрессивные средства (иммуносупрессоры)
Состав Актемра раствор для инъекций 162мг/0,9мл
Действующее вещество: Тоцилизумаб - 162 мг.
Вспомогательные вещества: полисорбат 80- 0.18 мг, L-аргинин - 0.132 мг, L-аргинина гидрохлорид - 18.8 мг, L-метионин -
4.03 мг, L-гистидин -1.4 мг, L-гистидина гидрохлорида моногидрат - 1.9 мг, вода для инъекций до 0,9 мл.
Веттер Фарма/Ф.Хоффманн-Ля Рош(Германия)
Фармакодинамика. Механизм действия. Тоцилизумаб - рекомбинантное гуманизированное моноклональное антитело к человеческому рецептору интерлейкина-6 (ИЛ-6) из подкласса иммуноглобулинов G1 (lgG1|). Тоцилизумаб селективно связывается и подавляет как растворимые, так и мембранные рецепторы ИЛ-6 (sIL-6R и mIL-6R). ИЛ-6 является многофункциональным цитокином, вырабатываемым различными типами клеток, и участвует в паракринной регуляции, системных физиологических и патологических процессах, таких как стимуляция секреции иммуноглобулинов (lg), активация Т-клеток, стимуляция выработки белков острой фазы в печени и стимуляция гемопоэза. ИЛ-6 вовлечен в патогенез различных заболеваний, в том числе воспалительных заболеваний, остеопороза и новообразований. Нельзя исключить вероятность отрицательного воздействия тоцилизумаба на противоопухолевую и противоинфекционную защиту организма. Роль ингибирования рецептора ИЛ-6 в развитии опухолей неизвестна. Доклинические данные безопасности. Канцерогенность: исследования по изучению канцерогенности тоцилизумаба не проводились. Имеющиеся доклинические данные демонстрируют вклад плейотропного ИЛ-6 в прогрессирование злокачественных новообразований и устойчивость к апоптозу при различных формах рака. Эти данные не предполагают, что лечение тоцилизумабом приводит к существенному риску развития и прогрессирования рака.
Мутагенность: стандартные генотоксические тесты как в прокариотических, так и в эукариотических клетках были отрицательными. Влияние на фертильность: имеющиеся доклинические данные не предполагают влияния аналогов тоцилизумаба на фертильность.Тератогенность: не обнаружено прямого или опосредованного неблагоприятного влияния на беременность или внутриутробное развитие при внутривенном введении тоцилизумаба яванским макакам на ранних сроках гестационного периода. Прочее: отмечалось незначительное увеличение случаев спонтанного выкидыша/внутриутробной гибели плода при высоком уровне системного кумулятивного воздействия (более чем в 100 раз превышающего таковое у человека) при введении дозы 50 мг/кг/сутки в сравнении с плацебо или меньшим уровнем вводимых доз. Частота выкидыша была в пределах ретроспективного контроля для яванских макак, содержащихся в неволе; отдельные случаи выкидыша/внутриутробной гибели не демонстрировали какой-либо взаимосвязи между данными явлениями и дозой или продолжительностью введения тоцилизумаба. Несмотря на то, что ИЛ-6, по-видимому, не играет решающей роли в развитии плода или иммунологической регуляции системы мать-плод, взаимосвязь этих явлений с введением тоцилизумаба не может быть исключена. Наблюдалась экскреция мышиного аналога тоцилизумаба в молоко лактирующих мышей. Применение мышиного аналога тоцилизумаба не оказывало токсичного действия на ювенильных мышей. В частности, не наблюдалось нарушения роста скелета, иммунной функции и полового развития. Доклинические данные безопасности при внутривенном применении тоцилизумаба у яванских макак не отличаются от таковых при подкожном применении тоцилизумаба.
Клиническая эффективность у пациентов с ранним ревматоидным артритом (рРА), ранее не получавших терапию метотрексатом (МТ). При применении тоцилизумаба в монотерапии в дозе 8 мг/кг и тоцилизумаба в дозе 4 или 8 мг/кг каждые 4 недели в комбинации с МТ индекс активности заболевания по шкале DАS28 существенно снижается в группах, получавших тоцилизумаб в дозе 8 мг/кг, по сравнению с пациентами, получавшими монотерапию МТ. Число пациентов, достигших клинической ремиссии (DАS28<2,6) на 24 неделе, значительно больше в группах, получавших тоцили¬зумаб, (38,7-44,8%) по сравнению с группой монотерапии МТ (15%). К 52 неделе число па¬циентов, достигших DАS28 <2,6 в группах терапии тоцилизумабом, увеличивается до 39,4- 49% по сравнению с 19,5% в группе монотерапии МТ. Число пациентов, достигших ответа АКР 20, 50, 70 (thе Аmerican Сollege of Rheumatology, Американская Коллегия Ревматологов), также существенно выше в группах терапии тоцилизумабом (70.2-74.5%, 47.6-56.9%, 30.1-38.6% на 24 неделе и 63-67.2%, 49.3-55.9%, 36-43.1% на
52 неделе, соответственно) по сравнению с группой монотерапии МТ (65.2%, 43.2%, 25.4% на 24 неделе и 57.1%, 40.8%, 28.9% на 52 неделе, соответственно). При монотерапии тоцилизумабом
(в дозе 8 мг/кг внутривенно каждые 4 недели у пациентов с РА, с непереносимостью МТ или при нецелесообразности продолжения терапии МТ (в том числе при неадекватном ответе на терапию МТ)) наблюдалось более выраженное статистически значимое снижение активности заболевания по шкале DАS28 по сравнению с монотерапией адалимумабом (в дозе 40 мг подкожно каждые 2 недели). Количество пациентов, ответивших на терапию с показателями DАS28 <2.6 и ОА828 <3.2, было больше при терапии тоцилизумабом, чем при терапии адалимумабом (39.9% против 10.5% и 51.5% против 19.8%, соответственно). Ответы АКР 20, 50, 70 наблюдались у 65%, 47.2%, 32.5% пациентов, получавших тоцилизумаб, по сравнению с 49.4%, 27.8%, 17.9% пациентов, получавших адалимумаб. Фармакокинетика. Всасывание. У пациентов с ревматоидным артритом, получающих тоцилизумаб подкожно, время достижения пиковой концентрации тоцилизумаба составляет около 2.8 дней. Биодоступность тоцилизумаба при подкожном введении составляет 80%. Распределение. Тоцилизумаб претерпевает двухфазное выведение из системного кровотока. У пациентов с ревматоидным артритом объем распределения в центральной камере составляет 3.5 л, в пе-риферической камере - 2.9 л, объем распределения в равновесном состоянии составляет 6.4 л. Выведение. Общий клиренс тоцилизумаба зависит от концентрации и представляет собой сумму линейного и нелинейного клиренса. Линейный клиренс составляет 12.5 мл/ч у пациентов с ревматоидным артритом. Нелинейный клиренс, зависящий от концентрации, имеет наибольшее значение при низких концентрациях тоцилизумаба. При более высоких концентрациях тоцилизумаба преобладает линейный клиренс в связи с насыщением пути нелинейного клиренса. При ревматоидном артрите зависимый от концентрации кажущийся период полувыведения (T1/2) для тоцилизумаба в равновесном состоянии при подкожном введении в дозе 162 мг 1 раз в неделю составляет до 13 дней, а для тоцилизумаба при подкожном введении в дозе 162 мг 1 раз в 2 недели - до 5 дней. Фармакокинетика у особых групп пациентов. Пациенты с печеночной недостаточностью. Фармакокинетика тоцилизумаба у пациентов с печеночной недостаточностью не изучалась. Пациенты с почечной недостаточностью. Специальных исследований на пациентах с почечной недостаточностью не проводилось. У большинства пациентов с ревматоидным артритом, учтенных в популяционном фармако-кинетическом анализе, была нормальная функция почек или нарушение функции почек легкой степени тяжести
(клиренс креатинина по формуле Кокрофта-Голта <80 мл/мин и >50 мл/мин), которое не влияло на фармакокинетику тоцилизумаба. Коррекции дозы тоцилизумаба пациентам с нарушением функции почек легкой степени тяжести не требуется.
Пол, раса, пожилой возраст. Популяционный фармакокинетический анализ у взрослых пациентов с ревматоидным артритом показал, что возраст, пол и раса не влияют на фармакокинетику тоцилизумаба. Коррекции дозы тоцилизумаба не требуется.
Побочное действие Актемра раствор для инъекций 162мг/0,9мл
Для описания частоты нежелательных реакций используются следующие категории: очень часто (>1/10), часто (>1/100 и <1/10), нечасто (>1/1000 и <1/100), редко (>1/10000 и <1/1000), очень редко (<1/10000, включая отдельные случаи). Приведенные ниже нежелательные реакции перечислены в порядке клинической значимости для пациента. Обобщенные данные о нежелательных реакциях, зарегистрированных у пациентов с ревматоидным артритом, получавших препарат Актемра в качестве монотерапии или в комбинации с метотрексатом или другими базисными противовоспалительными препаратами (вся контролируемая популяция). Инфекции: очень часто - инфекции верхних дыхательных путей; часто - флегмона, пневмония, инфекции, вызванные Нerpes simples 1 типа и Нerpes zoster; нечасто - дивертикулит.
Со стороны системы пищеварения: часто - боли в животе, язвы
ротовой полости,гастрит; нечасто - стоматит, язва желудка, перфорация ЖКТ. Со стороны кожи и ее придатков: часто - сыпь, зуд, крапивница. Со стороны нервной системы: нечасто - головная боль, головокружение. Изменения лабораторных показателей: часто - повышение активности «печеночных»
трансаминаз, увеличение массы тела, повышение общего билирубина. Со стороны сердечно-сосудистой системы: часто - повышение артериального давления (АД). Со стороны крови и
лимфатической системы: часто - лейкопения, нейтропения.
Со стороны обмена веществ: очень часто - гиперхолестеринемия; нечасто - гипертриглицеридемия.
Со стороны организма в целом и реакции в месте введения: часто - периферические отеки, реакции гиперчувствительности,
реакции в месте введения (эритема, боль); нечасто - анафилактические реакции. Со стороны дыхательной системы: часто - кашель, одышка. Со стороны органа зрения: часто - конъюнктивит. Со стороны мочевыделительной системы: нечасто - нефролитиаз. Со стороны эндокринной системы: нечасто - гипотиреоз.
Профиль безопасности тоцилизумаба, исследованный у пациентов с рРА средней и высокой степени активности, которые не получали ранее терапию МТ и терапию биологическими препаратами, сопоставим с известным профилем безопасности тоцилизумаба. Ниже представлена дополнительная информация по отдельным нежелательным реакциям. Профиль безопасности и иммуногенности, наблюдаемый при подкожном введении тоцили-зумаба, коррелирует с известным профилем безопасности тоцилизумаба при внутривенном (в/в) введении, новых нежелательных реакций не выявлено. Более высокая частота реакций в месте введения наблюдалась при подкожном применении тоцилизумаба по сравнению с подкожными инъекциями плацебо. Инфекции. Регистрировались следующие серьезные инфекционные заболевания: пневмония, флегмона, инфекции, вызванные Herpes zoster, гастроэнтерит, дивертикулит, сепсис, бактериальный артрит, некоторые из них сопровождались фатальным исходом. Известны случаи развития оппортунистических инфекций. Перфорации ЖКТ. Главным образом случаи перфорации ЖКТ сообщались как осложнения дивертикулита и включали разлитой гнойный перитонит, перфорацию нижних отделов ЖКТ, свищ и абсцесс.
Реакции в месте введения. Реакции в месте введения тоцилизумаба (включая эритему, зуд, боль и гематому) были легкой или средней степени тяжести, в большинстве случаев разрешались без лечения и не приводили к отмене препарата.
Иммуногеиность. Антитела к тоцилизумабу были выявлены у 0,8% обследованных пациентов, из них у 0,2% были выявлены иммуноглобулины класса Е (lgЕ). У всех пациентов выявлены нейтрализующие антитела. Из всех 434 пациентов, получавших тоцилизумаб каждые 2 недели в дозе 162 мг, у 1,6% пациентов были выявлены антитела к тоцилизумабу, из них у 1,4% были обнаружены нейтрализующие антитела к тоцилизумабу. У 0,9% пациентов были выявлены иммуноглобулины класса Е (lgЕ).
Не обнаружено корреляции между наличием антител к тоцилизумабу и клиническим ответом или развитием нежелательных явлений.
Изменения со стороны лабораторных показателей. При рутинном мониторинге лабораторных показателей отмечались следующие изменения: снижение числа нейтрофилов ниже 1 х 10000000000/л отмечалось у 2,9% пациентов, получавших препарат Актемра подкожно в дозе 162 мг 1 раз в неделю; не отмечалось четкой связи между снижением числа нейтрофилов ниже 1 х 10000000000/л и развитием серьезных инфекционных заболеваний; снижение числа тромбоцитов < 50 х 10000/мкл не наблюдалось; повышение активности АЛТ или АСТ, в >3 раза превышающее верхнюю границу нормы, зарегистрировано у 6,5% и 1,4% пациентов, соответственно. Транзиторное повышение активности АЛТ (более чем в 3 раза превышающее ВГН), наблюдавшееся у взрослых пациентов с рРА средней или высокой степени активности (средняя продолжительность заболевания < 6 месяцев), которые ранее не получали терапию МТ, имело более выраженную тенденцию возврата к нормальным значениям по сравнению с популяцией пациентов с РА.; повышение показателя общего холестерина > 6,2 ммоль/л
(240 мг/дл) наблюдалось у 19% пациентов, а стойкое повышение показателя ЛПНП >4,1 ммоль/л (160 мг/дл) - у 9% пациентов.
Постмаркетинговое наблюдение. Профиль безопасности препарата при постмаркетинговом применении согласуется с данными клинических исследований, за исключением случаев развития фатальной анафилаксии, зарегистрированных при внутривенном применении препарата Актемра. При постмаркетинговом применении препарата Актемра для внутривенного введения серьезные явления гиперчувствительности, включая анафилаксию, возникали у пациентов, получавших различные дозы препарата Актемра независимо от наличия сопутствующей терапии для лечения ревматоидного артрита, премедикации и/или реакций гиперчувствительности в анамнезе. В ходе постмаркетингового применения наблюдался синдром Стивенса-Джонсона.
Показания к применению Актемра раствор для инъекций 162мг/0,9мл
Ревматоидный артрит. Ревматоидный артрит со средней или высокой степенью активности у взрослых как в виде монотерапии, так и в комбинации с метотрексатом и/или с другими базисными противовоспалительными препаратами, в том числе для торможения рентгенологически доказанной деструкции суставов.
Противопоказания Актемра раствор для инъекций 162мг/0,9мл
Гиперчувствительность к тоцилизумабу, любому компоненту препарата в анамнезе. Активные инфекционные заболевания (в том числе туберкулез). Комбинация с ингибиторами фактора некроза опухоли (ФНО)-альфа или применение в течение 1 месяца после лечения анти-ФНО антителами.
Детский возраст до 18 лет. С осторожностью. Инфекции: у пациентов, получающих иммуносупрессанты (в том числе и препарат Актемра), наблюдались серьезные случаи возникновения инфекционных заболеваний (иногда с летальным исходом) (см. раздел «Побочное действие»). Не следует начинать лечение препаратом Актемра пациентам с активными инфекционными заболеваниями. При развитии серьезных инфекций терапия препаратом Актемра должна быть прервана до устранения инфекции. Следует соблюдать осторожность при использовании препарата Актемра у пациентов с рецидивирующими инфекционными заболеваниями в анамнезе, а также при сопутствующих заболеваниях, предрасполагающих к развитию инфекций (например, при дивертикулите, сахарном диабете). Следует проявлять особую осторожность с целью раннего выявления серьезных инфекционных заболеваний у пациентов с ревматоидным артритом средней и высокой степени активности, поскольку признаки или симптомы острого воспаления могут быть стерты в связи с подавлением реакции острой фазы. Осложнения дивертикулита: у пациентов с ревматоидным артритом отмечались случаи перфорации дивертикула. Следует соблюдать осторожность при применении препарата Актемра у пациентов с язвенным поражением органов желудочно-кишечного тракта (ЖКТ) или дивертикулитом в анамнезе. Пациенты с признаками, возможно указывающими на осложненный дивертикулит (боль в животе), должны быть немедленно обследованы с целью раннего выявления перфорации ЖКТ. Активные заболевания печени и печеночная недостаточность: терапия препаратом Актемра, особенно одновременно с метотрексатом, может быть ассоциирована с повышением активности «печеночных» трансаминаз, поэтому следует проявлять осторожность у пациентов с активным заболеванием печени или печеночной недостаточностью. Демиелинизирующие заболевания: следует проявлять особую осторожность с целью раннего выявления симптомов, возможно указывающих на развитие демиелинизирующих заболеваний центральной нервной системы (ЦНС). В настоящее время способность тоцилизумаба вызывать демиелинизирующие заболевания ЦНС не известна. Повышение активности «печеночных» трансаминаз: наблюдалось легкое или умеренное повышение активности «печеночных» трансаминаз без признаков печеночной недостаточности (см. раздел «Побочное действие»). Частота возникновения подобных изменений возрастала при использовании препарата Актемра совместно с препаратами, обладающими потенциальным гепатотоксическим действием (например, метотрексатом). Следует соблюдать осторожность при решении вопроса о начале терапии препаратом Актемра у пациентов с показателями аланинаминотрансферазы (АЛТ) или аспартатаминотрансферазы (АСТ), превышающими верхнюю границу нормы (ВГН) более чем в 1.5 раза. Терапия препаратом Актемра не рекомендуется при показателе АЛТ или АСТ, превышающем ВГН более чем в 5 раз. При ревматоидном артрите следует мониторировать АЛТ и АСТ один раз в период с 4-ой по 8-ую неделю после начала терапии, а в дальнейшем в соответствии с клинической практикой. Рекомендации по дозированию препарата в зависимости от активности «печеночных» трансаминаз представлены в разделе «Способ применения и дозы». Изменение показателей липидного обмена: наблюдалось повышение показателей липидного обмена (общего холестерина, липопротеинов низкой плотности (ЛПНП), триглицеридов) (см. раздел «Побочное действие»). При ревматоидном артрите следует оценивать показатели липидного обмена один раз в период с 4-ой по 8-ую неделю после начала терапии препаратом Актемра. При ведении пациентов следует руководствоваться национальными рекомендациями по лечению гиперлипидемии.
Применение во время беременности и в период грудного вскармливания. Безопасность и эффективность применения препарата Актемра при беременности изучены недостаточно. Исследования у обезьян не обнаружили дисморфогенетического потенциала препарата Актемра. Однако при введении препарата в высоких дозах обнаружен повышенный риск спонтанного выкидыша/внутриутробной гибели. Значение данной информации для людей неизвестно (см. раздел «Фармакологические свойства», подраздел «Фармакодинамика»). Не следует применять тоцилизумаб во время беременности, за исключением тех случаев, когда имеется очевидная клиническая необходимость.
Неизвестно, выводится
Аксамон При Травме Нерва
Белосалик Акридерм Ск
Акридерм Чем Отличаются Друг От Друга
Аксамон Цена Спб
Мазь Акридерм Ск Цена В Аптеках
Актемра раствор для подкожн. введения, 162 мг/0,9 мл шпри…
Актемра инструкция по применению: показания ...
Актемра 162 мг в наличии по цене 118500 руб. ЕвроФарма
Инструкция по применению: Актемра раствор для инъекци…
Актемра - официальная инструкция по применению, а…
Актемра раствор для подкожн. введения, 162 мг/0,9 мл шпри…
Актемра® (Actemra®), инструкция, способ примене…
АКТЕМРА Розчин 162 мг/0,9 мл: інструкція, аналоги, ціна ...
ACTEMRA ® 162 MG S.C. (АКТЕМРА 162 МГ ПОДКОЖН…
АКТЕМРА инструкция по применению, цена в аптеках …
Актемра 162