Строение и метаболизм мышечной ткани.


Движение. Как много и как мало в данном слове. Для человека такое естественное свойство его опорно-двигательного аппарата открывает тысячи возможностей, и каждый наш день наполнен движением. И человек вовсе не заключён в своем теле, как в душной камере, напротив, люди вольны использовать ресурсы, данные им природой во всю мощь. Мышцы — удивительная ткань, возможности которой в условиях меняющихся нагрузок поражают воображение, а функциональные возможности скелетно-мышечной системы восхищают изящностью исполнения. А потому интересно было бы взглянуть на то, как же обеспечивается мышечная работа в целом.
В мышечной ткани происходит преобразование химической энергии в механическую работу. В качестве источника энергии химических связей используется АТФ, получаемая мышечными клетками в результате метаболических процессов.
Миоциты разных типов мышечной ткани обладают различным набором ферментов, а также отличаются по количеству митохондрий и миоглобина — белка, осуществляющего перенос кислорода. Мышечные волокна, выполняющие взрывную работу за короткое время, покрывают необходимые энергетические затраты посредством анаэробного гликолиза, ферменты для осуществления которого присутствуют в клетках в норме в надлежащем количестве. За счёт сравнительно низкого содержания миоглобина в клетках таких мышечных волокон под микроскопом они выглядят светлыми и потому называются белыми волокнами. Им в противоположность существуют красные мышечные волокна, которые обеспечивают совершение продолжительной работы мышцами и характеризуются более высоким содержанием миоглобина. Клетки красных мышечных волокон, которые, кроме прочего, составляют и сердечную мускулатуру, нуждаются в кислороде и потому имеют много митохондрий, а также богаты ферментами цикла Кребса и дыхательной цепи.
Глюконеогенез в мышечной ткани не протекает из-за отсутствия в ней нужных для его свершения ферментов. Продукты обмена веществ в мышечной ткани (лактат, возникающий при анаэробном гликолизе из пирувата, и аланин, являющийся продуктом трансаминирования из пирувата и аминокислот), пройдя циклы Кори и аланина, транспортируются по кровеносному руслу в печень для глюконеогенеза: в результате реакции повторного трансаминирования в печени возрастает количество необходимого пирувата. Гликоген печени при необходимости может стать источником глюкозы для мышечной ткани, что замыкает данный цикл. Синтез и разрушение гликогена в мышцах подчиняется гормональному контролю: инсулин способствует захвату глюкозы клетками и синтезу гликогена, тогда как катехоламины путем повышения уровня цАМФ стимулируют активность гликогенфосфорилазы. Катаболическое воздействие глюкокортикоидов ведёт к разрушению мышечных белков и мобилизации аминокислот, которые в печени задействуются в глюконеогенезе.
Гидролитическое отщепление фосфатных групп от молекул АТФ даёт мышечным клеткам необходимую для сокращения энергию. Ещё одним макроэргическим фосфатом, используемым в мышцах, является креатинфосфат, отщеплённая от которого креатинкиназой фосфатная группа переносится на АДФ. Неферментативно образующимся побочным продуктом превращения креатинфосфата является креатинин, который регулярно обнаруживается в крови и выводится через почки (суточное выводимое с мочой количество креатинина пропорционально мышечной массе). Таким образом, креатинфосфат представляет собой своего рода энергетический резерв, обеспечивая скорое восстановление количества молекул АТФ. У такой системы восстановления АТФ есть важное преимущество перед накоплением АТФ, заключающееся в том, что после превращения АТФ в АДФ, вследствие разрыва фосфодиэфирной связи, не создаётся невыгодного соотношения АТФ/АДФ, что могло бы негативно сказываться на функции АТФ из-за концентрационной зависимости от энергии Гиббса. Есть и ещё одна система, служащая восстановлению АТФ в мышечной ткани, ключевым её ферментом является аденилаткиназа (миокиназа), способная образовывать АТФ за счёт АДФ, а также фосфорилировать АМФ до АДФ.
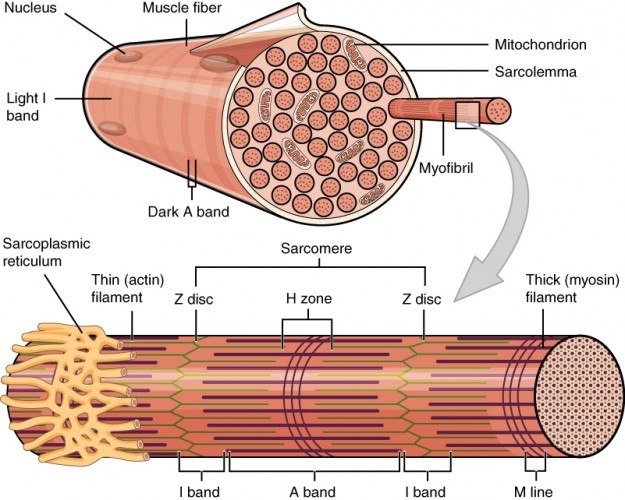
Строение мышечных волокон
Клетки поперечно-полосатой мускулатуры отличаются от клеток гладкой мышечной ткани и ткани сердечной мышцы. Они образуют единый многоядерный синцитий. Клеточные ядра при этом смещены к краю клеток, а основное внутриклеточное пространство занято миофибриллами. Миофибриллы окружены саркоплазматическим ретикулумом, что достигается посредством формирования продольных и поперечных трубочек, а также лабиринтообразных впячиваний плазматической мембраны, благодаря чему возбуждение достигает этих участков. Плазматическая мембрана миоцитов — сарколемма — укреплена с внутренней стороны белками цитоскелета. В связывании с интегральными мембранными белками задействован белок дистрофин, мутации в гене которого приводят к развитию миодистрофии.
Скелетные мышцы структурно строго организованы в мышечные пучки, волокна, фибриллы и филаменты. Фибриллы поперечно-полосатых мышц состоят, прежде всего, из толстых миозиновых филаментов и тонких филаментов. Первый тип состоит из миозина и молекулярных моторных единиц. Второй тип филаментов включает F-актин и актин-связывающие белки — тропомиозин и тропонин. Головки тяжёлых цепей миозина выдаются кнаружи и способны формировать связи с тонкими актиновыми филаментами. Актиновые филаменты, в свою очередь, закреплены на структурных белках, образующих так называемые Z-диски. Типичная поперечная исчерченность данного типа мышечной ткани, узнаваемая гистологически, создается благодаря устройству и расположению саркомера — функциональной единицы мышцы — который представляет собой участок миофибриллы между двумя Z-мембранами. Актиновые филаменты связываются как между собой, так и с Z-белками. Два других белка — титин и небулин — принимают участие в структурировании миофибрилл в процессе сокращения и расслабления. Титин прикрепляется к белкам Z-структуры и к М-линиям, сформированным миозином и структурными белками. Небулин закреплён в Z-структурах и исполняет регуляторную роль в построении тонких филаментов.
Несмотря на строгую организацию, скелетная мускулатура являет собой крайне гетерогенную систему относительно устройства и выполняемых функций. С одной стороны, это позволяет подстроиться мышцам под возлагаемую на них нагрузку путем разборки / увеличения количества саркомеров или миофибрилл, с другой стороны — обмен различными изоформами белков разных свойств и качеств обуславливает функциональную реорганизацию.
Мышечное сокращение
Сокращение мышц находится в зависимости от концентрации ионов кальция. Передача возбуждения на нейромышечные окончания поперечно-полосатых волокон ведет к деполяризации наружной мембраны и открытию кальциевых каналов в мембране саркоплазматического ретикулума, простирающегося через все саркомеры. Концентрация ионов кальция в цитозоле резко возрастает, и они связываются с тропонином С. Это приводит к конформационным изменениям субъединиц тропонинового комплекса, что имеет следствием смещение позиции тропомиозина. Это событие делает возможным связывание участков цепей миозина с актином. Головки миозина расщепляют АТФ до АДФ и остатка фосфорной кислоты, а высвобождающаяся при этом энергия обеспечивает смену её конформации. Свершившееся связывание ионов кальция с тропонином С является необходимым для взаимодействия миозина с актиновыми волокнами, которое влияет на изменение угла между леёгкой и тяжёлой цепями миозина. Такой сдвиг оканчивается перемещением актинового филамента к центру саркомера. Скольжение тонких филаментов относительно толстых приводит к укорочению саркомеров и сокращению мышцы. После этого происходит экзергоническая смена конформации головки миозина, а продукты гидролиза АТФ выносятся из клетки. Для повторения цикла необходимо очередное внесение АТФ в систему. Если мотонейроны перестают получать раздражение извне, то в работу вступает АТФ-зависимый кальциевый насос, перекачивающий более не востребованные ионы кальция из цитоплазмы в цистерны саркоплазматического ретикулума, где они связываются с кальсеквестрином, обладающим высокой связывающей способностью. В связи с этим концентрация свободных ионов кальция снижается, что энергетически облегчает последующее поглощение этих ионов.
Молекулярные компоненты системы, осуществляющей впоследствии высвобождение кальция из саркоплазматического ретикулума, известны только частично. Начало сигнальной цепочки опосредуют дигидропиридиновые рецепторы плазматической мембраны, которые сменяют свою конформацию под влиянием деполяризации мембраны. Это приводит к открытию кальциевых каналов и активации рианодиновых рецепторов терминальных цистерн саркоплазматического ретикулума. Преходящее повышение концентрации ионов кальция в цитоплазме мышечных клеток ведёт и к метаболическим изменениям. Например, дефосфорилированная форма киназы гликогенфосфорилазы может активироваться комплексом кальмодулина с ионами кальция, а потому мышечное возбуждение связано с кратковременным разрушением гликогена.
На этом наше повествование не оканчивается. В последующих постах обязательно подробнее рассмотрим биохимические превращения в мышцах, а также обратимся к особенностям, происходящим с мышцами при физических нагрузках.
Источники:
Löffler, Petrides Biochemie und Pathobiochemie, Springer, 2007
Волков, Несен Биохимия мышечной деятельности, 2000
Ленинджер, Основы биохимии