Новые оральные антикоагулянты (НОАК). Часть 2
https://t.me/medach
Фармакологию ривароксабана, апиксабана и эдоксабана можно рассмотреть единым блоком ввиду незначительных различий в их фармакокинетике и фармакодинамике [1].
Механизм действия.
Механизм действия ривароксабана/апиксабана/эдоксбана связан с обратимым ингибированием свободного и связанного с тромбом фактора Ха (рис. 1). Для реализации своей прямой функции им не требуется наличие антитромбина III. Помимо этого, тот же апиксабан способен ингибировать активность протромбиназы, а также опосредованно ингибировать агрегацию тромбоцитов, индуцированную тромбином [1, 3].

Фармакокинетика.
Биодоступность:
— Ривароксабан: для 10 мг дозы — 80–100 %, для 20 мг дозы — 66 %; при этом если совместить прием ривароксабана с приемом пищи, то биодоступность увеличивается до 80 %;
— Апиксабан — 50 %;
— Эдоксабан — 62 %.
Все 3 препарата быстро всасываются, Cmax достигается через 2–4 часа у риваро- и апиксабана, через 1–2 часа у эдоксабана (рис. 2). Здесь стоит отметить тот факт, что для первых двух представителей данной подгруппы НОАК характерна значительная фармакокинетическая вариабельность в отношении их плазменных концентраций (изменение Css в среднем до 40 %) [2, 16]. Также для ривароксабана характерно уменьшение Cmax в зависимости от места высвобождения его в ЖКТ. Было показано, что максимальная его концентрация снижалась на 30 % при всасывании ривароксабана в дистальном отделе тонкой кишки.
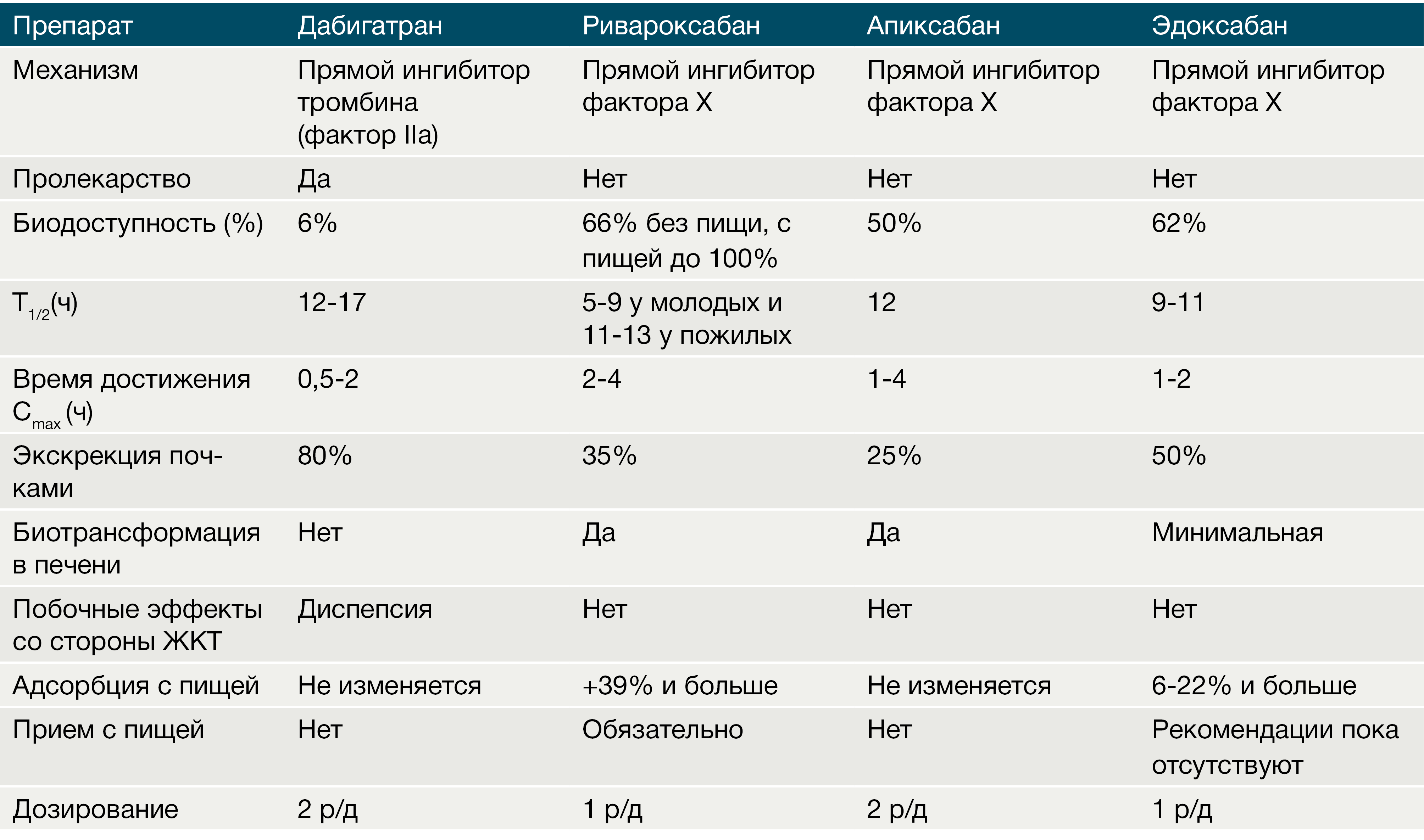
Наибольший объем распределения имеет эдоксабан — 107 литров (связь с белками плазмы —55 %), наименьший — апиксабан, 21 литр (связь с белками плазмы — 87 %). Ривароксабан на 92–95 % связывается с белками плазмы (объем распределения — 50 литров). Период полувыведения для данной группы в среднем составляет 8,5 часов (у ривароксабана — 5–9 часов, может увеличиться до 11–13 часов у людей пожилого возраста; у апиксабана в среднем 12 часов; у эдоксабана — 10–14 часов). Для данной группы не характерна зависимость периода полувыведения от функционального состояния почек, потому что все 3 препарата в основном метаболизируются в печени, а через почки выводятся в неизменном виде (в отличие от дабигатрана этаксилата) [1, 2].
Биотрансформация и элиминация.
После приема внутрь 60 % от принятой дозы ривароксабана подвергается метаболизму в печени при помощи системы цитохрома р450 (в основном CYP3A4/5, CYP2J2), а также путем окисления морфолиновой группы и гидролиза амидных связей, неизмененная же часть препарата выводится через почки (до 30 %) [1, 3]. Ривароксабан не образует активных метаболитов в крови, кроме своей неизмененной формы, через почки выводится до 66 % препарата: 30 % в неизменном виде, до 33 % после метаболизма в печени, 28 % препарата выводится с калом [3].
Ривароксабан является субстратом Р-гликопротеина (P-gp) и белка резистентности рака молочной железы (BCRP), при этом он не подавляет и не индуцирует изофермент CYP3A4 и другие важные изоформы цитохрома. Об этом следует помнить при комбинировании его с сильными индукторами Р-gp и CYP3A4, например, карбамазепином [1]. Такая комбинация может приводить к снижению плазменных концентраций ривароксабана до 50 % со снижением его фармакодинамических эффектов. При этом совместное использование ингибиторов Р-gp и CYP3A4 (например, верапамила) с ривароксабаном у пациентов с нарушенной функцией почек может повышать время нахождения препарата в крови [1].
После приема внутрь 25 % апиксабана метаболизируется в печени в основном при помощи изофермента CYP3A4/5; в меньшей степени — с использованием CYP1A2, CYP2C8, CYP2C9, CYP2C19, CYP2J2. Апиксабан, так же как и ривароксабан, не образует активных метаболитов, а значит, его неизмененная форма является главным основным веществом в крови. Кроме того, апиксабан является субстратом P-gp, BCRP и изофермента CYP3A4/5, поэтому одновременное его использование с сильными двойными ингибиторами изоферментов системы цитохрома и Р-gp, например кетоконазолом, будет приводить к увеличению концентрации апиксабана в крови (требует снижения используемой дозировки на 50 %).
Касаемо выведения апиксабана: в основном он выводится через кишечник, и только 27 % его метаболитов выводится через почки (рис. 3). О чем это может свидетельствовать? Апиксабан — единственный НОАК, который можно использовать при значении СКФ ниже 15 мл/мин, что роднит его со старичком варфарином. Но при этом стоит помнить о печени: не рекомендуется его использование у пациентов с печеночной недостаточностью тяжелой степени (класс С по Чайлд-Пью) [1].

Эдоксабан на сегодняшний день — самый малоизученный НОАК. После приема внутрь минимально метаболизируется в печени с помощью изофермента CYP3A4/5, в основном метаболизм происходит при помощи механизмов, независимых от системы цитохромов — путем гидроксилирования и окисления. При этом в крови образуется активный метаболит М-4, который составляет не более 10 % от основного вещества и является субстратом Р-gp. Сильные ингибиторы Р-gp будут повышать плазменные концентрации эдоксабана, что требует снижения используемой дозировки 2 раза. Половина дозы эдоксабана выводится через почки в неизменном виде, другая половина элиминируется через желчь и кишечник.
В исследовании ENGAGE-AF было показано, что снижение дозы эдоксабана (до 30 мг в сутки) при одновременном использовании ингибитора P-gp (верапамила, хинидина, дронедарона) приводило к повышению риска развития инсульта или системной эмболии в сравнении с варфарином. Поэтому эдоксабан в дозе 60 мг не рекомендуется использовать при СКФ выше 95 мл/мин (“терапевтическое окно” при СКФ от 50 до 95 мл/мин), а также надо помнить о том, что при СКФ в диапазоне от 15 до 50 мл/мин и одновременном использовании с ингибиторами Р-gp необходимо снижать дозировку до 30 мг.
Показания и режим дозирования.
Ривароксабан.
Общие показания для ривароксабана схожи с таковыми у дабигатрана.
Основными из них являются:
— Профилактика инсульта, системных тромбоэмболий и снижение сердечно-сосудистой смертности у пациентов с фибрилляцией предсердий;
— Профилактика ВТЭ у пациентов после протезирования тазобедренного и/или коленного сустава;
— Лечение острого и рецидивирующего тромбоза глубоких вен (ТГВ) и/или ТЭЛА и профилактика смертельных исходов, вызываемых этими заболеваниями.
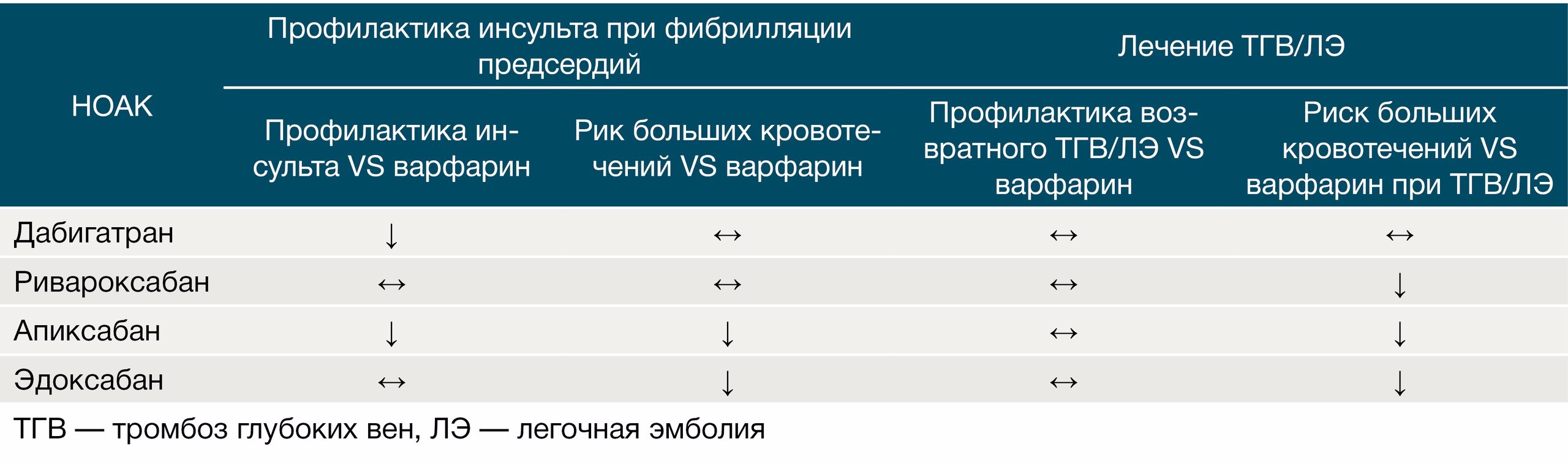
Ривароксабан считается самым продаваемым НОАК с наибольшей доказательной базой (около 20 РКИ). Эффективность и безопасность использования ривароксабана в качестве средства профилактики инсульта и системных эмболий при неклапанной фибрилляции предсердий были выяснены в крупных исследованиях ROCKET-AF (в сравнении с варфарином) и XANTUS (первое в мире проспективное исследование IV фазы НОАК на предмет его безопасности) [4, 5, 6]. Благоприятный профиль эффективности и безопасности ривароксабана подтверждает то, что в РКИ у пациентов группы более высокого риска наблюдалась низкая частота больших кровотечений, инсультов/системных эмболий и инфарктов миокарда [15]. Это в совокупности с однократным приемом в течении суток (20 мг, вечером, во время приема пищи) делает его практически «идеальным бойцом».
Эффективность применения ривароксабана с целью профилактики венозных тромбоэмболических осложнений (ВТЭО) после протезирования тазобедренного и коленного суставов была изучена в 4-х РКИ (RECORD 1, 2, 3, 4; в сравнении с эноксапарином). По итогам по профилю безопасности оба препарата показали приблизительно равные результаты, а по эффективности ривароксабан превзошел эноксапарин на 30–70 % в зависимости от исследования (10 мг однократно независимо от приема пищи в течение 35 дней при протезировании тазобедренного сустава и в течение 12 дней при протезировании коленного сустава) [7].
Безопасность использования ривароксабана в качестве средства лечения острого эпизода ТГВ/ТЭЛА, а также профилактики рецидивов ТГВ/ТЭЛА была проверена в исследованиях EINSTEIN-DVT, EINSTEIN-РЕ, EINSTEIN-Extension [8]. Как и в других исследованиях, ривароксабан (15 мг 2 раза в сутки во время приема пищи в первые 3 недели с дальнейшим переходом на 20 мг однократно) превосходил по эффективности стандартную терапию (эноксапарин с переходом на варфарин), а по безопасности был на том же уровне, что и комбинация эноксапарин + варфарин. Однако позже при сравнении с апиксабаном были выявлены его некоторые преимущества в терапии острого эпизода ТЭЛА. Об этом будет сказано ниже.
Ривароксабан является единственным НОАК, для которого было доказано влияние на снижение риска развития ВТЭО у пациентов со стабильным течением ИБС или заболеванием периферических артерий (в комбинации с аспирином) [9]. По итогам исследования COMPASS, совместный прием ривароксабана в дозе 2,5 мг 2 раза/сут и аспирина в дозе 100 мг по сравнению со стандартной терапией аспирином 100 мг/сут достоверно снижал смертность от ССЗ и инсульта (в среднем на 25 %) и обладал большей суммарной клинической эффективностью в сравнении с монотерапией ривароксабаном.
Помимо этого, ривароксабан также является единственным НОАК, допущенным к использованию при двойной антиагрегантной терапии (ДААТ) в качестве средства вторичной профилактики атеротромботического события (сердечно-сосудистая смерть, инфаркт миокарда или инсульт) в первый год после перенесенного ОКС с подъемом сегмента ST (STEMI). В исследовании ATLAS ACS 2-TIMI 51 было доказано, что добавление ривароксабана в дозировке 2,5 мг 2 раза/сут к стандартной ДААТ (аспирин + клопидогрел) в течение 12 месяцев (лечение может быть продлено до 24-х месяцев для отдельных групп лиц) достоверно снижало риск повторных атеротромботических событий; помимо этого, применение ривароксабана приводило к снижению частоты тромбоза стентов [11]. Добавление ривароксабана к стандартной ДААТ возможно в следующей клинической ситуации: «у больных ОКС без предшествовавшего инсульта или транзиторной ишемической атаки, с высоким коронарным риском и малой вероятностью кровотечений».
Также было проведено спланированное проспективное исследование X-VeRT (в сравнении с варфарином), в котором ривароксабан в дозе 20 мг однократно был использован в качестве антикоагулянта при проведении кардиоверсии у пациентов с ФП [11]. Была показана возможность проведения ранней кардиоверсии в срок от 4 часов до 5 суток после приема первой дозы препарата при отсутствии тромба в ушке левого предсердия, подтвержденного при помощи чреспищеводной ЭхоКГ (ЧПЭхоКГ). При проведении отсроченной кардиоверсии ривароксабан чаще позволял обеспечить готовность к кардиоверсии через 3 недели от начала приема препарата, не удлиняя этот период из-за подбора дозы в сравнении со стандартной схемой эноксапарин + варфарин. Безопасность была сравнима с данными проведенных исследований по ривароксабану.
Апиксабан.
На данный момент показания для его применения полностью повторяют основные показания к назначению, характерные для всех НОАК, которые были описаны выше.
В исследованиях ARISTOTLE и AVERROES было продемонстрировано, что апиксабан в дозе 5 мг 2 раза в сутки у пациентов с неклапанной ФП более эффективен в отношении снижения риска инсульта и системной эмболии (по сравнению с варфарином и АСК), общей смертности и больших кровотечений (в сравнении с варфарином) при сходном риске кровотечений с АСК в исследовании AVERROES (суточная дозировка в среднем составляла 165 мг) [12]. Коррекция дозировки апиксабана (снижение до 2,5 мг 2 раза в сутки) при использовании его по данному показанию требуется при наличии 2 из 3 следующих показателей: СКФ < 15 мл/мин, возраст > 80 лет, масса тела < 60 кг [1, 3].
С целью подтверждения эффективности применения апиксабана в качестве средства лечения острого эпизода ТГВ/ТЭЛА и профилактики рецидива были проведены 2 исследования AMPLIFY (лечение острого эпизода ВТЭО; по сравнению с плацебо), в котором эффективность и безопасность монотерапии апиксабаном сравнивали со стандартной антикоагулянтной терапией (эноксапарин + варфарин); в AMPLIFY-EXT оценивалась целесообразность продления антикоагулянтной терапии после окончания основного 6–12-месячного курса лечения [13]. По итогам этих исследований апиксабан показал себя с наилучшей стороны: по эффективности он оказался на одном уровне со стандартной терапией (эноксапарин + варфарин), но был более безопасен в отношении развития геморрагических осложнений (снижение риска на 69 %); в качестве средства длительной терапии данные свидетельствовали о снижении риска рецидива ВТЭО на 80–82 % без повышения риска геморрагических осложнений. Таким образом, у апиксабана имеются изученные в клинических исследованиях дозы для каждого периода лечения и профилактики ВТЭО: 10 мг 2 раза/сут — для лечения острого периода в течение 7 дней; 5 мг 2 раза/сут — для дальнейшего лечения и профилактики рецидива, минимум 3 месяца; 2,5 мг 2 раза/сут — для длительной вторичной профилактики [1, 3].
Были проведены сравнительные исследования между апиксабаном и ривароксабаном (EINSTEIN-DVT и EINSTEIN-РЕ) [12]. По их результатам при лечении острого эпизода ТЭЛА предпочтительным представляется назначение апиксабана, а при лечении острого эпизода изолированного ТГВ — ривароксабана. Эффективность ривароксабана и апиксабана в отношении вторичной профилактики ВТЭО оказалась одинаковой (снижение риска рецидива ВТЭО в EINSTEIN-Extension составило 82 %), но профиль безопасности ривароксабана был несколько хуже. Если сравнивать безопасность апиксабана с дабигатраном и ривароксабаном, то на данный момент он является наиболее безопасным из них с точки зрения развития риска массивных кровотечений при длительном приеме в течение, как минимум, 6 месяцев (рис. 4).
При использовании апиксабана в качестве средства профилактики ВТЭО после протезирования тазобедренного или коленного суставов режим дозирования выглядит следующим образом: 2,5 мг 2 раза/сут в течение 35 дней после протезирования тазобедренного сустава и в течение 12 дней после протезирования коленного сустава (исследования ADVANCE-2 и ADVANCE-3) [1, 3, 14].
Побочные эффекты.
Побочные эффекты, связанные с приемом риваро-/апиксабана, практически не отличаются от таковых при использовании других НОАК. Необходимо быть осторожным в следующих ситуациях:
— снижение СКФ менее 15 мл/мин (для ривароксабана);
— наличие в анамнезе печеночной недостаточности (класс С по Чайлд-Пью), наличие в анамнезе гиперчувствительности к ривароксабану, двухкратное увеличение АЛТ/АСТ (для апиксабана);
— прием риваро-/апиксабана вместе с сильными ингибиторами/индукторами цитохрома p450 [1, 3].
Общим побочным эффектом для этих препаратов является повышенный риск развития скрытого или явного кровотечения, и, как следствие, развитие постгеморрагической анемии. Прием ривароксабана часто сопровождается зудом, кожной сыпью, развитием подкожных кровоизлияний. Также отмечаются головные боли и головокружения (остается открытым вопрос, являются ли они первичными или представляют собой признаки скрытого кровотечения). Прием апиксабана, так же, как и дабигатрана, может сопровождать «гастритоподобными» жалобами со стороны пациента. К «особенному» побочному эффекту апиксабана можно отнести меноррагию. Как говорилось выше, при использовании НОАК нельзя исключить риск развития большого или малого клинически значимого кровотечения (рис. 5).

Эдоксабан — последний из НОАК, был одобрен к использованию FDA и ЕМА в 2015 году; в нашей стране по состоянию на 2018 год он проходит регистрацию. Его можно использовать пока по двум показаниям:
— Профилактика инсульта, системных тромбоэмболий и снижение сердечно-сосудистой смертности у пациентов с фибрилляцией предсердий;
— Лечение острого тромбоза глубоких вен (ТГВ) и/или ТЭЛА.
Эффективность и безопасность применения эдоксабана по вышеуказанным показаниям была изучена в двух РКИ III фазы: Hokusai-VTE и ENGAGE AF-TIMI 48.
Результаты Hokusai-VTE, в котором эдоксабан сравнивали с НМГ или с комбинацией НМГ + варфарин у пациентов с острым эпизодом ТГВ и/или ТЭЛА, показали, что терапия эдоксабаном (60 мг 1 раз/сут) после начального лечения НМГ в течение 5–10 дней оказалась не менее эффективной, чем эталонное лечение варфарином у пациентов с широким спектром эпизодов венозной тромбоэмболии различной степени тяжести [17]. Эдоксабан также продемонстрировал меньшую частоту кровотечений в сравнении с варфарином.
В исследовании ENGAGE AF-TIMI 48 (сравнение с варфарином) была изучена эффективность и безопасность эдоксабана в качестве средства профилактики инсульта/системных эмболий у пациентов с ФП с использованием двух дозировок: 30 мг 2 раза/сут или 60 мг 1 раз/сут [18]. По результатам эдоксабан не уступает варфарину в отношении профилактики инсульта и системной эмболии при условии хорошего контроля МНО на варфарине (70 % времени пребывания МНО в терапевтическом диапазоне) при значительно меньшем риске развития больших кровотечений. Однако Американская ассоциация сердца (American Heart Association, AHA) не рекомендует использовать эдоксабан в дозировке 60 мг 1 раз в сутки при СКФ выше 95 мл/мин в связи с повышенным риском развития ишемического инсульта в сравнении с тем же варфарином. Исследования на тему режима дозирования продолжаются и сейчас.
На данный момент было проведено спланированное проспективное исследование ENSURE-AF, в котором изучили возможность использования эдоксабана при проведении кардиоверсии у больных с ФП без предшествующего использования антикоагулянтов [19]. Согласно его результатам эдоксабан — эффективная и безопасная альтернатива традиционной 3-недельной комбинации эноксапарин/варфарин для пациентов, подвергающихся плановой электрической кардиоверсии неклапанной ФП. Его однократный прием (60 мг 1 раз/сут) позволяет провести раннюю кардиоверсию (ФП < 48 часов) под контролем ЧП-ЭхоКГ уже через 2 часа, а также в течение более чем 3 недель в случае отсроченной кардиоверсии без ЧП-ЭхоКГ контроля при практически одинаковом профиле безопасности в сравнении с варфарином.
Исследования по поиску точек приложения данного препарата продолжаются и сейчас. Также рано говорить и о конкретных побочных эффектах, связанных с приемом эдоксабана, поэтому стоит держать в уме общий для всех НОАК побочный эффект в виде повышенного риска развития массивного или клинически значимого малого кровотечения.
Антидотная терапия.
Как говорилось в первой части, на данный момент проводятся исследования еще 2 антидотов, способных устранить действие апиксабана — андексанета альфа и антидота «против всех» — цирапарантага/арипазина (PER977).
Андексанет альфа представляет собой рекомбинантный человеческий Ха фактор, который дозозависимо связывает прямые ингибиторы Ха фактора с той же аффинностью, что и нативный Ха фактор (рис. 6) [20, 21].
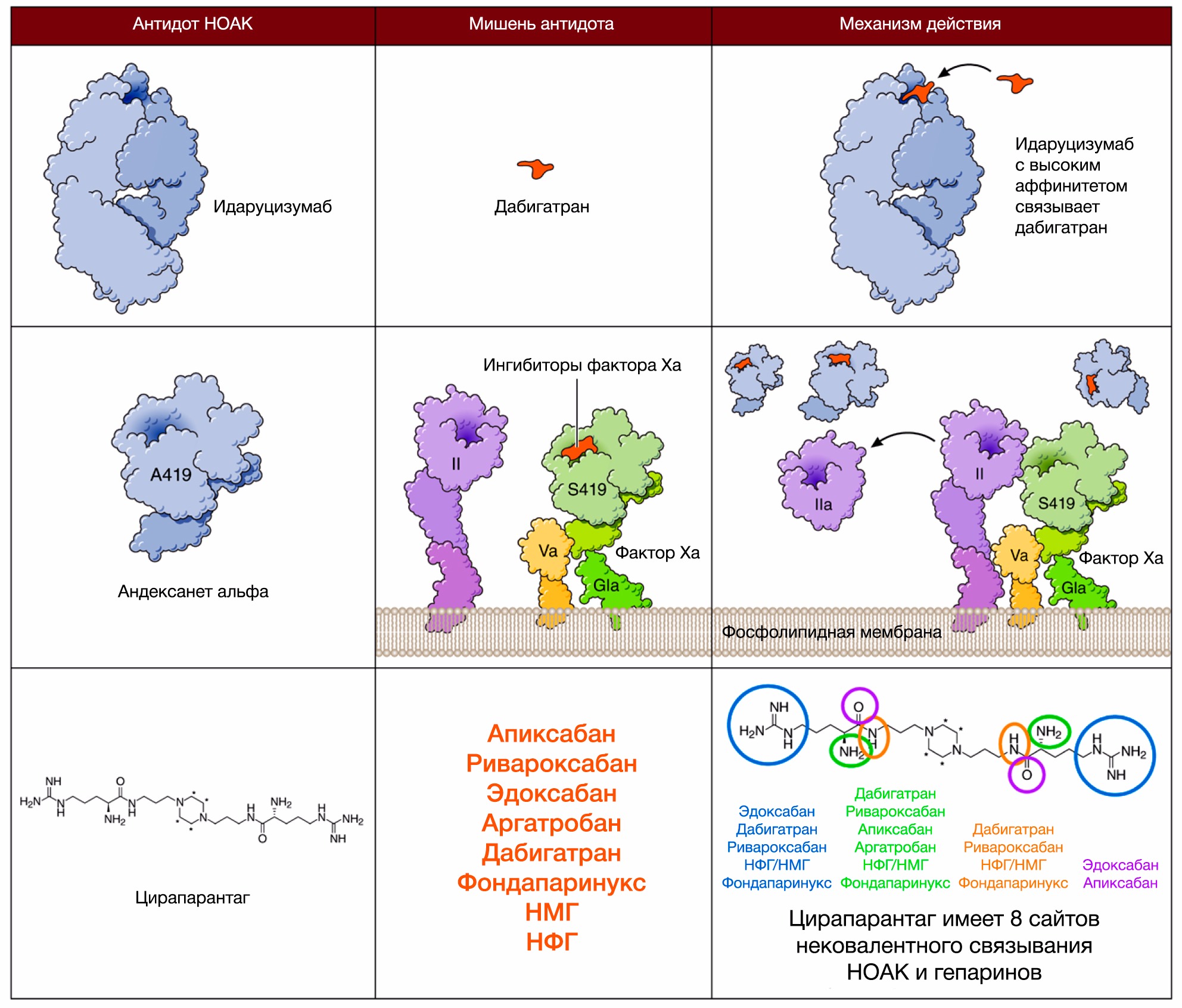
Помимо этого, он также способен препятствовать связыванию НМГ и фондапаринукса с антитромбином III, тем самым «выключая» их из работы. Исследование ANNEXA-4 (III фазы), которое проводило оценку как профиля эффективности, так и безопасности андексанета у пациентов с большими кровотечениями на фоне терапии всеми известными на сегодняшний момент ингибиторами Xa фактора, должно было дать почву FDA для одобрения этого антидота еще в конце 2016 года. В связи с чем образовалась подобная задержка в регистрации препарата, остается загадкой. Подробнее об ANNEXA-4 - https://goo.gl/uhGEHx.
Цирапарантаг представляет собой положительно заряженную молекулу, которая связывает НОАК при помощи водородных связей, однако такой механизм взаимодействия до конца не подтвержден (рис. 6) [21]. Цирапарантаг не связывается с белками плазмы и не имеет никаких лекарственных взаимодействией, что может быть его неоспоримым преимуществом. Но к настоящему времени опубликованы результаты лишь одного исследования I фазы (выборка составила около 80 человек), поэтому рано делать какие-либо выводы, остается надеяться и верить в конечный успех данного антидота.
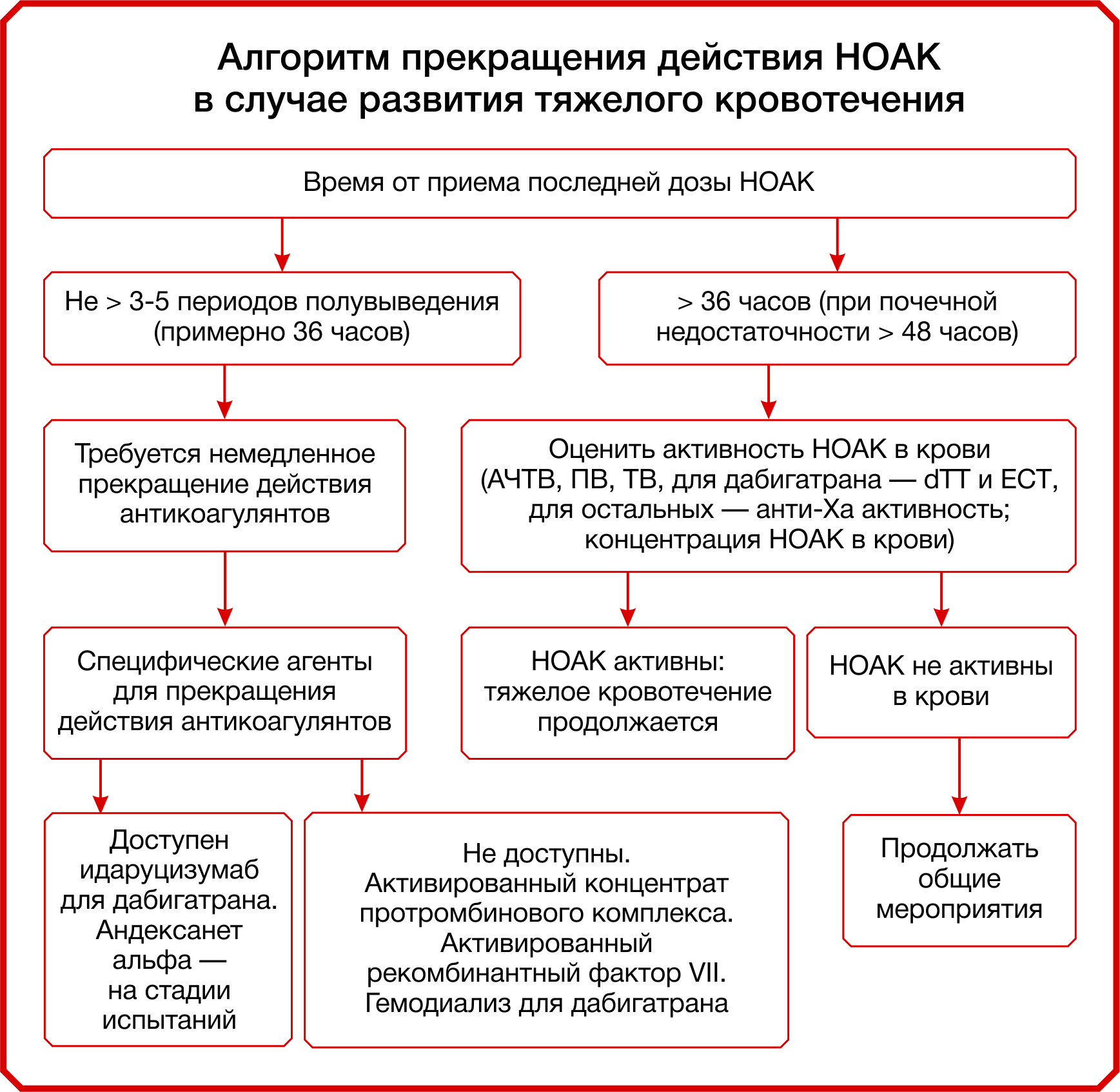
Показания к применению антидотов; показатели, которые следует оценить перед введением антидота, а также алгоритм экстренного прекращения действия НОАК будут приложены к посту в виде схем (рис. 7, 8, 9). Приятного прочтения!


Источники:
1. Raval A. N. et al. Management of Patients on Non–Vitamin K Antagonist Oral Anticoagulants in the Acute Care and Periprocedural Setting: A Scientific Statement From the American Heart Association //Circulation. – 2017. – Т. 135. – №. 10. – С. e604-e633.
2. Yeh C. H., Fredenburgh J. C., Weitz J. I. Oral direct factor Xa inhibitors //Circulation research. – 2012. – Т. 111. – №. 8. – С. 1069-1078.
3. Hinojar R. et al. New oral anticoagulants: a practical guide for physicians //European Heart Journal-Cardiovascular Pharmacotherapy. – 2015. – Т. 1. – №. 2. – С. 134-145.
4. Patel M. R. et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation //New England Journal of Medicine. – 2011. – Т. 365. – №. 10. – С. 883-891.
5. Camm A. J. et al. XANTUS: a real-world, prospective, observational study of patients treated with rivaroxaban for stroke prevention in atrial fibrillation //European heart journal. – 2015. – Т. 37. – №. 14. – С. 1145-1153.
8. Аверков О. В., Вечорко В. И. Современные подходы к антикоагулянтной терапии тромбоэмболии ветвей легочной артерии: фокус на ривароксабан //Медицинский совет. – 2017. – №. 12.
9. Eikelboom J. W. et al. Rivaroxaban with or without aspirin in stable cardiovascular disease //New England Journal of Medicine. – 2017. – Т. 377. – №. 14. – С. 1319-1330.
10. Mega J. L. et al. Rivaroxaban in patients with a recent acute coronary syndrome //New England Journal of Medicine. – 2012. – Т. 366. – №. 1. – С. 9-19.
11. Cappato R. et al. Rivaroxaban vs. vitamin K antagonists for cardioversion in atrial fibrillation //European heart journal. – 2014. – Т. 35. – №. 47. – С. 3346-3355.
12. Карпов Ю. А. Апиксабан: новые возможности профилактики осложнений у больных с фибрилляцией предсердий //Атмосфера. Новости кардиологии. – 2013. – №. 4.
13. Воробьёва Н. М., Панченко Е. П. Апиксабан: новые возможности в лечении венозных тромбоэмболических осложнений //Атмосфера. Новости кардиологии. – 2015. – №. 2.
14. Гиляров М. Ю., Константинова Е. В. Пероральные антикоагулянты в лечении венозных тромбоэмболических осложнений: фокус на апиксабан //Медицинский совет. – 2017. – №. 7.
15. Gómez-Outes A. et al. Dabigatran, rivaroxaban, or apixaban versus warfarin in patients with nonvalvular atrial fibrillation: a systematic review and meta-analysis of subgroups //Thrombosis. – 2013. – Т. 2013.
16. Gulilat M. et al. Interpatient Variation in Rivaroxaban and Apixaban Plasma Concentrations in Routine Care //Canadian Journal of Cardiology. – 2017.
17. Hokusai-VTE Investigators et al. Edoxaban versus warfarin for the treatment of symptomatic venous thromboembolism //N Engl J Med. – 2013. – Т. 2013. – №. 369. – С. 1406-1415.
18. Giugliano R. P. et al. Edoxaban versus warfarin in patients with atrial fibrillation //New England Journal of Medicine. – 2013. – Т. 369. – №. 22. – С. 2093-2104.
19. Goette A. et al. Edoxaban versus enoxaparin–warfarin in patients undergoing cardioversion of atrial fibrillation (ENSURE-AF): a randomised, open-label, phase 3b trial //The Lancet. – 2016. – Т. 388. – №. 10055. – С. 1995-2003.
20. Lu G. et al. Reversal of low molecular weight heparin and fondaparinux by a recombinant antidote (r-antidote, PRT064445). – 2010.
21. Hu T. Y., Vaidya V. R., Asirvatham S. J. Reversing anticoagulant effects of novel oral anticoagulants: role of ciraparantag, andexanet alfa, and idarucizumab //Vascular health and risk management. – 2016. – Т. 12. – С. 35.