Молекулярные основы работы мышечной ткани.
2. Пластичность мышц и тренировочные нагрузки: молекулярные основы
Клетки сформировавшейся скелетной мускулатуры представляют собой конечную форму дифференцировки и в целом могут быть поделены на два типа:
- Клетки, формирующие многоядерный синцитий, или миосимпласты, представляющие собой вытянутые мышечные тубы, заполненные миофибриллами со смещенными на периферию ядрами. Слившиеся в синцитий клетки более не делятся. В качестве структурной единицы каждой из миофибрилл, заполняющих симпласт, выделяют саркомер;
- Клетки, остающиеся самостоятельными и располагающиеся на поверхности симпластов — их называют миосателлитами. Этот пул клеток является регенеративным источником мышечной ткани, а также обеспечивает увеличение мышечной массы в ответ на силовые нагрузки.
Нагрузки, оказываемые на мышцы, могут быть различными по характеру, и ответное мышечное сокращение будет соответствовать типу нагрузки. Выдающаяся способность мышц откликаться на тренировки изменением экспрессии сократительных белков и метаболических ферментов приводит к тому, что происходит увеличение плотности и количества мышечных волокон того типа, который необходим для наиболее эффективного выполнения возлагаемой нагрузки. Например, может происходить смена быстро сокращающихся и быстро утомляемых волокон типа II на медленно сокращающиеся, устойчивые к утомлению волокна I типа. То, какая работа совершалась мышцами, будет непосредственно влиять также на способ их восстановления и вызываемую гипертрофию клеток. Так, к примеру, высокоинтенсивные тренировки с большими свободными весами ведут к гипертрофии волокон типа II, тогда как продолжительные тренировки с меньшей нагрузкой — к увеличению мышечных волокон типа I.
Итак, одной из исключительнейших характеристик скелетной мускулатуры является мышечная пластичность. В зависимости от физиологических потребностей свойства мышечных волокон могут изменяться. Наряду с физиологически обусловленными изменениями типов волокон вследствие активности мышц их преобразования происходят и при отсутствии активности (например, по причине малоподвижного образа жизни), а также при разрушении мышечных белков в пожилом возрасте и в случае развивающихся миопатий (например, мышечная дистрофия Дюшенна). Два основных типа мышечных волокон, быстрые (тип II) и медленные (тип I), отличаются друг от друга составляющими их сократительными белками, ферментами энергетического обмена и белками, отвечающими за секвестирование ионов кальция, а значит, и уровнем внутриклеточного содержания Са2+. Изоформы тяжелых цепей миозина (MyHC, myosin heavy chain), различные по своей АТФ-азной активности, представляют собой главный параметр для определения типа мышечных волокон. Как было сказано чуть выше, разные внешние стимулы могут инициировать превращение одного типа волокон в другой. Таким стимулом может быть различная по объему и интенсивности нагрузка.
Во время силовой нагрузки на мышечные клетки оказывают воздействие многочисленные стимулы (например, пассивные механические силы, ток ионов через плазматическую мембрану, пониженное парциальное давление кислорода, факторы роста и т. д.), которые инициируют пути передачи сигналов внутри клеток, опосредующие транскрипцию соответствующих генов, а также регулируют процесс трансляции. Преобразование мышечными клетками оказываемых стимулов в активность специфических генов может быть изучено на моделях клеточных культур (например, линия миобластов С2С12, культуры клеток миосателлитов).
Изменения путей передачи внутриклеточных сигналов и генной экспрессии, сопровождающие преобразования типов волокон мышечной ткани, идентифицированы пока только частично. Важным исходным сигналом является рост внутриклеточной концентрации ионов кальция и Са2+/кальмодулин-зависимой фосфатазы кальцинейрина. Кальцинейрин дефосфорилирует семейство факторов транскрипции — NFAT (nuclear factor of activated T-cells). Изоформы NFAT находятся в цитоплазме в фосфорилированном (т. е. неактивном) состоянии. В дефосфорилированной форме они перемещаются в клеточное ядро, где активируют гены-мишени. Различные киназы путем фосфорилирования/рефосфорилирования способны влиять на локализацию NFAT внутри клетки, а потому можно заключить, что расположение этих факторов транскрипции зависит от баланса в действии фосфатаз и киназ. В экспериментах по трансформации быстрых волокон в медленные с помощью ионофора кальция или путем электростимуляции сигнальный путь кальцинейрин/NFAT обнаружил свое незаменимое участие в регуляции экспрессии гена MyHCI/β — тяжелой цепи миозина, характерной для медленных мышечных волокон типа I. При этом при ионофор-индуцированной экспрессии был определен решающий момент, роль которого отведена связыванию с промотором гена MyHCI/β одного из представителей NFAT и рекрутингу коактиватора р300. Кроме того, с помощью комбинирования различного по продолжительности раздражения в культурах клеток удавалось поддерживать стабилизацию мышечных волокон того или иного типа. Например, при более коротком времени стимуляции и более продолжительной фазе покоя транспорт NFAT в ядро не осуществляется и стабилизируются уже волокна второго типа, а не первого. Но для основательного понимания специфической для каждого типа мышечных волокон генной регуляции этих результатов не достаточно. Для этого требуется изучение возможных пересечений путей сигнальной трансдукции с уделением особенного внимания взаимодействию факторов транскрипции с коактиваторами и репрессорами, а также возможным посттрансляционным модификациям (например, сумоилирование, ацетилирование).
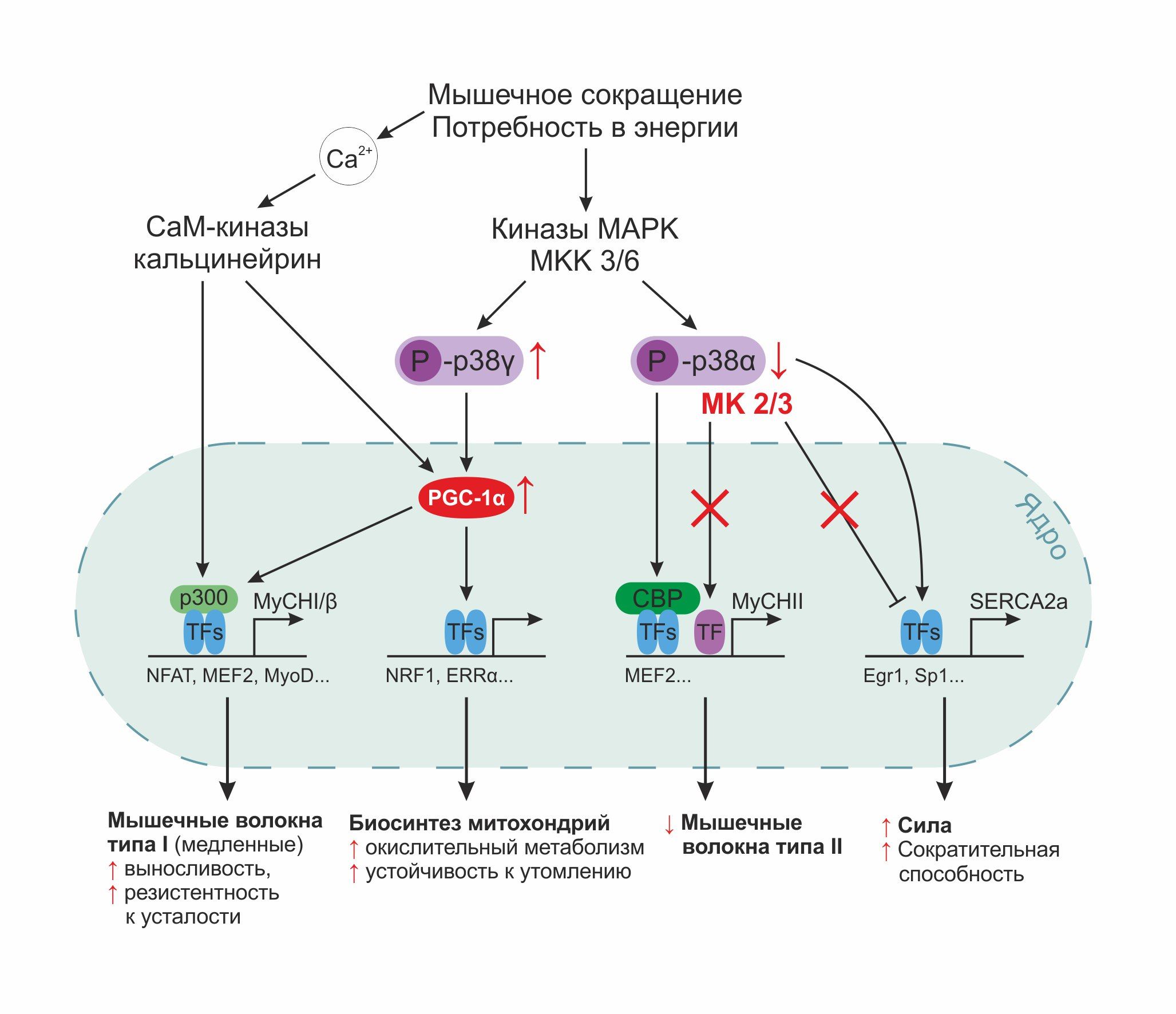
Рисунок 4. Схематическое обобщенное представление влияния путей сигнальной передачи (в частности, р38/МАРК) на экспрессию генов MyHCI и MyHCII, задействованных в дифференцировке и гипертрофии мышечных волокон разного типа.
Особо выделена роль МК2/3 в регуляции внутриклеточной концентрации ионов кальция за счет регуляции промотора гена SERCA2а. МК2 регулирует также промотор гена MyHCII. При выключении работы МК2/3 (на схеме отмечено блокирование путей воздействия красными крестиками) наблюдается усиление синтеза сократительных белков, характерных для мышечных волокон типа I, что подкрепляется компонентами энергетического обмена (PGC-1α).
Еще один важный сигнальный путь, реализуемый в клетках скелетной мускулатуры, связан с р38 митоген-активируемой протеинкиназой (МАРК). Семейство МАРК задействовано в регуляции различных клеточных процессов, таких как пролиферация, дифференцировка, апоптоз, канцерогенез. Активация р38 может быть опосредована стрессовыми реакциями (УФ-излучение, тепловой шок, осмотический шок и т. д.), а также с помощью цитокинов, липополисахаридов, TNFα, ростовых и трофических факторов. Однако стресс-индуцированная активация р38 МАРК не является единственно возможным запуском данного пути. Инициация дифференцировки клеток скелетной мускулатуры представляет собой альтернативный вариант, дающий ход данному пути. С началом миогенеза в эмбриональном периоде киназная активность р38 МАРК повышается и оказывает непосредственное влияние на клеточную дифференцировку путем упорядоченной во времени экспрессии соответствующих генов. Стимуляция р38 МАРК довольно продолжительна и длительное время сохраняется в уже дифференцированных клетках. Поэтому в скелетной мышечной ткани взрослых сигнальный путь р38 МАРК рассматривается в рамках адаптивных процессов при тренинге. р38 МАРК и МАРК-активирующие протеинкиназы 2 и 3 играют роль при силовой нагрузке на мышцы, когда вследствие «утечки» электронов из цепи переноса на молекулярный кислород происходит образование свободных радикалов. Активность р38 МАРК выше в быстрых мышечных волокнах, нежели в медленных. На схеме в приложении наглядно показаны молекулярные механизмы действия р38 МАРК-индуцированной, стрессонезависимой регуляции генов, продуктами которых являются как тяжелая цепь MyHCII, характерная для быстрых мышечных волокон, для чего привлекается коактиватор СВР (CREB-binding protein; CREB-связывающий белок; CREB — cAMP response element-binding protein — клеточный фактор транскрипции), так и тяжелая цепь MyHCI, свойственная волокнам первого типа.
Рисунок 5. Снимок мышечных клеток на микроносителе; растровый электронный микроскоп.
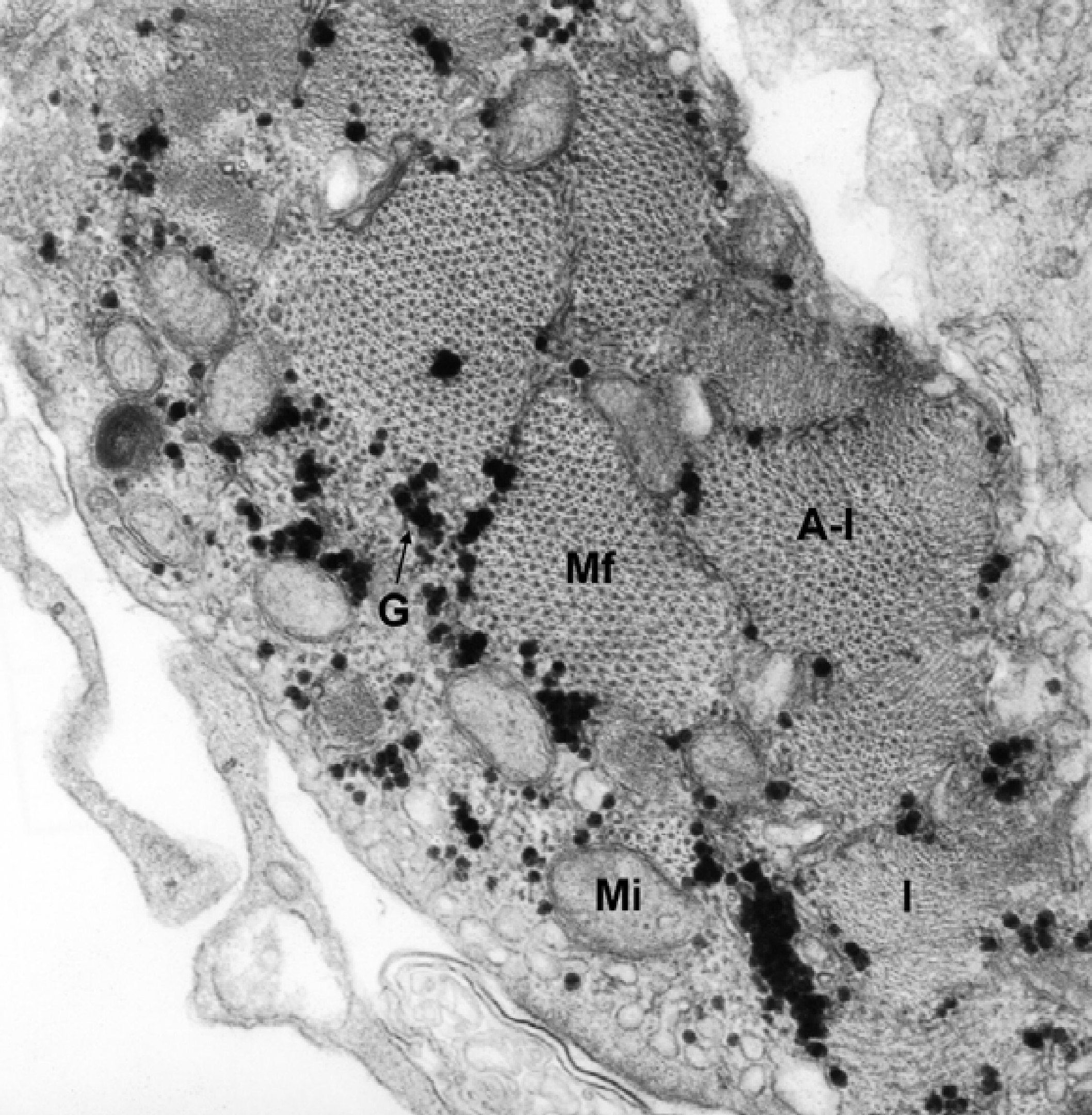
Рисунок 6. Электронно-микроскопический снимок поперечного среза мышечной клетки.
Mi — митохондрия; Mf — миофибриллы; A-I — актиновые и миозиновые филаменты; видно чередование изотропных и анизотропных дисков; I — актиновые филаменты в изотропной области; G — гликоген.
Метаболическая адаптация и мышечная гипертрофия
В ходе приспособления мышечных клеток к даваемым нагрузкам работают не только механизмы, сопряженные с изменением экспрессии изоформ миозина и, как следствие, с преобразованием типов мышечных волокон, но также задействованы и метаболические процессы. К примеру, смена типов волокон с быстрых на медленные влечет за собой увеличение объемов окислительного и снижение анаэробно-гликолитического метаболизма. Эти изменения не зависят от функционирования сигнальных путей, описанных выше, поскольку экспериментально показано, что усиленный синтез того или иного типа сократительных белков, вызванный активацией пути кальцинейрин/NFAT, может происходить и в отсутствие запущенного метаболического каскада процессов, равно как и метаболические процессы не меняются под влиянием, например, блокирования активности кальцинейрина. Поэтому параметры, обуславливающие метаболические приспособительные реакции мышечной ткани в ответ на нагрузку, особенно интересны. Одним из таких параметров может быть количество доступного кислорода, которое может иметь влияние на экспрессию митохондриальных факторов транскрипции (PGC1) и ферментов (фумараза, цитратсинтаза), а также гликолитических ферментов (ЛДГ, ГА-3-ФДГ). Снижение количества кислорода ведет к активации одной из изоформ семейства гипоксия-индуцированных факторов (HIF; hypoxia inducible factor), которая, проникая в ядро и связываясь с конкретным участком ДНК (не без привлечения коактиватора р300), активирует гены, основными результатами экспрессии которых являются усиление гликолиза, увеличение потребления глюкозы и ангиогенез.
Кроме того, немаловажным моментом является сильное изменение соотношения АТФ/АДФ/АМФ при сократительной активности мышц, поскольку АМФ-зависимые протеинкиназы могут воздействовать на факторы транскрипции генов метаболических ферментов. Быстрые мышечные волокна очень чувствительны к снижению уровня АТФ и истощению запасов гликогена, что имеет место при высоконагрузочных изматывающих тренировках. При этом, если поступающих питательных веществ организму после такой тренировки недостаточно, то запущенное стимуляцией мышц увеличение количества мРНК гена MyHCII не будет сопровождаться столь же интенсивным процессом трансляции, и в итоге синтез миозина будет снижаться. Это подчеркивает важность основательного подхода к питанию и отдыху, а также к распределению нагрузок в тренировочные дни.
Метаболически активные гормоны также обладают важным влиянием на профиль генной экспрессии в клетках скелетной мускулатуры. К таким гормонам относятся инсулин, инсулиноподобный фактор роста 1 (IGF1), гормон роста, которые регулируют клеточную дифференцировку и рост, влияя на экспрессию генов через тирозинкиназные рецепторы. При сильном метаболическом и энергетическом истощении запускаются реакции катаболизма, в которых принимают участие все три вышеперечисленных гормона, а также кортизол, действие которого взаимосвязано с уровнем гликогена, но может быть запущено и стрессовыми реакциями. Действуя через стероидные рецепторы, кортизол опосредует прекращение активности множества генов, среди которых тип миозина, присутствующий в быстрых мышечных волокнах.
Отдельно хотелось бы обратить внимание на роль IGF1 и подобных ему факторов роста (среди которых можно выделить MGF — mechanical growth factor) в мышечной гипертрофии. Образование факторов роста инициируется в ходе растяжения мышц и их сокращения. IGF1 и MGF могут действовать как аутокринно, так и паракринно, и ведут, с одной стороны, к повышенному синтезу сократительных белков разных типов мышечных волокон, и, с другой стороны, к пролиферации миосателлитных клеток, которые могут сливаться с уже имеющимися мышечными волокнами, а также формировать новые. Передача сигналов от рецепторов IGF1, имеющая следствием мышечную гипертрофию, регулируется посредством сигнального пути AKT/mTOR, однако к данному пути мы обратимся в следующей части.