Глава 3 .
Когда два атома встречаются, они могут начать друг с другом взаимодейство-
вать . То, как именно протекает их взаимодействие, в первую и основную очередь
зависит лишь от того, как именно устроены их внешние электронные оболочки.
Сколько протонов или нейтронов находится у них в ядрах, совершенно неважно,
ведь они слишком далеко и влияние положительно заряженных протонов прочно эк-
ранировано стадами пасущихся на электронных уровнях электронов. Неважно даже
и то, сколько электронов расположено на предпоследнем электронном уровне, не
говоря уже о более близких к ядру электронах, поскольку и их влияние ничтожно
по сравнению с влиянием тех электронов, которые находятся на самом внешнем
уровне и приходят в непосредственное соприкосновение с внешними электронами
соседнего атома. Так что важно только одно
— сколько электронов на самых
внешних уровнях атомов, и как именно они там располагаются. «Внешним» уровнем
атома мы называем тот уровень, который дальше всех расположен от ядра и при
этом содержит хотя бы один электрон.
Введем важное понятие: «электронная формула атома». Это такая запись, кото-
рая зримо, наглядно показывает
— сколько электронов находится у данного атома
на каких уровнях и подуровнях. Например, электронная запись водорода будет
такой: Is1. Первая цифра показывает номер уровня. Буква показывает
— какой
именно подуровень этого уровня имеется в виду
— s (сферический) или р (три
«гантели») или d (пять сложных «гантелей») или f (семь очень сложных конфигу-
раций) и т.д. А вторая цифра показывает, сколько электронов находится на этом
подуровне.
Отсюда ясно, что если электронная формула атома записывается как Is1, то
это означает, что в этом атоме имеется лишь один электрон, и находится он,
разумеется, на первом s-подуровне
— это хорошо знакомый нам атом водорода.
У кислорода порядковый номер 8 в периодической таблице, а значит в его ядре
8 протонов (плюс сколько-то нейтронов, нам сейчас неважно сколько), и значит
на орбитах вокруг ядра располагаются 8 электронов. На первом уровне есть
только s-орбиталь, на котором помещается максимум 2 электрона, на втором
уровне уже есть два подуровня
— s и р, (на подуровне р максимум может быть 6
электронов
— по два на каждую 2р-орбиталь). Заполнение электронами подуровней
простых атомов идет строго по порядку
— сначала заполняется подуровень Is,
потом 2s, потом 2р, потом 3s, потом Зр. Отсюда ясно, что электронная формула
кислорода будет такой: Is2 + 2s2 + 2р4, или, более коротко: ls22s22p4.
Третий электронный уровень в атоме содержит три подуровня: s, p, d. Мы мо-
жем интуитивно понять и запомнить, что для электронов находиться на сфериче-
ской орбитали s значительно проще, чем на сложной гантелеобразной р, и уж тем
более сложно на еще более замысловатой орбитали d-подуровня. И учитывая тот
факт, что чем дальше от ядра, тем плотнее расположены всё более многочислен-
ные уровни и подуровни, мы совсем не удивимся тому, что для атома энергетиче-
ски выгодней, чтобы электроны сначала заполняли простой по форме сферический
подуровень 4s, и уже лишь потом вскарабкивались на сложный 3d, затрачивая на
это больше энергии. То есть правило последовательного заполнения подуровней
снизу вверх в данном случае нарушается, но нам легко понять
— почему это про-
исходит
. В более сложных атомах порядок заполнения подуровней становится еще
более сложным, и мы конечно сейчас не будем в это углубляться. На самом деле
нам эти сложные атомы с большим количеством электронов почти что и не нужны,
ведь самые основные химические элементы жизни очень просты: водород, углерод,
азот и кислород. В меньшей степени живые организмы используют серу и фосфор,
а остальные элементы еще меньше.
Самый тяжелый элемент из этой главной шестерки - сера, у нее 16 электронов.
Давай посмотрим - входит ли сера в число настолько тяжелых элементов, у кото-
рых уже нарушается порядок последовательного заполнения подуровней? Просто
начнем писать электронную формулу, следя, чтобы количество электронов не пе-
ревалило за 16: ls22s22p63s23p6... стоп, перебор - уже 18, а нам надо 16, значит
два лишних электрона с Зр-подуровня надо убрать, и мы получим итоговую элек-
тронную формулу серы: ls22s22p63s23p4. До Зd-пoдypoвня мы даже не дошли. Жизнь в основном строится из легких, сравнительно простых атомов. Формула
ls22s22p63s23p6 описывает атом, у которого на два электрона, а значит и на два
протона больше, чем у серы, а значит его порядковый номер - 18. Это инертный
газ аргон.
Давай теперь для закрепления знаний еще потренируемся и напишем электронную
формулу атома калия - очень важного для жизни элемента. Его номер - 19, на
один протон больше, чем у аргона. Значит добавляем один электрон на орбиталь
3d? Нет, не добавляем. Вспоминаем, что электрону энергетически выгоднее раз-
меститься на 4s-орбитали, имеющей самую простую форму, и получаем электронную
формулу калия: ls22s22p63s23p64s1. Подуровень 3d у калия остается неиспользо-
ванным. И формулу последующего атома под номером 20
— кальция - также очень
важного для жизни элемента, написать тоже легко: ls22s22p63s23p64s2. И только
теперь, когда у кальция сферический подуровень 4s полностью заполнен двумя
электронами, в следующем атоме - скандии (для биологии совершенно неважен),
имеющем 21 электрон, двадцать первый электрон начнет заполнять подуровень 3d,
так что электронная формула скандия выглядит так: ls22s22p63s23p64s13d1.
Ты уже испытываешь чувство удовольствия и гордости от того, что такие, ка-
залось бы, сложные электронные формулы атомов ты теперь понимаешь с легко-
стью? Есть предвкушение разбираться дальше? Надеюсь, что есть, потому что те-
перь мы можем сформулировать важнейшую закономерность, понимание которой про-
ливает свет на природу химических связей: «правило октета». Эксперименты по-
казывают, что всякий атом изо всех сил стремится иметь комплект завершенных
внешних подуровней s+p. При этом незавершенность уровней d, f и т.д. значения
не имеет. Почему это так, физики и сами до сих пор это достаточно ясно не по-
нимают .
Завершенным подуровнем называется такой, на котором разместилось столько
электронов, сколько это вообще для него возможно по максимуму. Максимум воз-
можного для s-подуровня
— это 2 электрона, и максимум для р-подуровня
— 6.
Ситуация, когда атом имеет частично заполненные подуровни s и р, для него
«некомфортна», т.е. энергетически менее выгодна, чем когда эти подуровни яв-
ляются завершенными. Именно это и приводит к тому, что атомы вступают между
собой во взаимодействие для того, чтобы их электронные s- и р-подуровни как
можно больше приближались к состоянию завершенности за счет того, что их
внешние электроны обобществляются, становятся общими. В этом и состоит физи-
ческая суть химии. Химическое взаимодействие между атомами возможно только
потому, что атомам энергетически выгодно обобществить свои внешние электроны,
чтобы приблизить состояние своих внешних подуровней к завершенности. Как ка-
мень стремится скатиться с горы, так и каждый атом стремится к состоянию с
минимальной энергией, а значит
— к состоянию, когда на его комплексе внешних
(s+p)-подуровней находится ровно 8 электронов. Это правило и называется пра-
вилом октета.
И теперь легко понять, почему так называемые «благородные газы» (гелий, не-
он, аргон, криптон, ксенон и радон) категорически не хотят образовывать ника-
ких химических соединений. Им это просто незачем. У них внешний комплекс
(s+p)-подуровней и так уже завершен, полностью заполнен электронами, и эта
конфигурация настолько энергетически выгодна, что даже всевозможные и много-
летние попытки ученых заставить их вступить в химические реакции терпят не-
удачу. В последнее время кое-что на этом поприще ученым все-таки удалось, но
для этого им пришлось невероятно изворачиваться с помощью очень высоких тем-
ператур и давлений. И именно поэтому благородные газы не входят в биологиче-
ские системы, не включаются в биохимию
— химически они инертны, ни с кем со-
единяться не хотят.
Теперь представим себе, что атомы натрия (Na - номер 11) и хлора (С1 - но-
мер 17) встретились. Чтобы понять, что при этом случится, достаточно написать их электронные формулы:
Na: ls22s22p63s1
CI: ls22s22p63s23p5
Что мы видим? Мы видим, что у атома натрия на 3s-подуровне болтается один
электрон. Ужасно неудобно! Если бы только деть его куда-то, тогда у него сна-
ружи останется 2s22p6
— завершенная пара (s+p)-подуровней
— идеально удобно.
Но просто вот так взять электрон и выкинуть атом не может, ведь у него в яд-
ре, как ни крути, 11 протонов, а не 10, а значит этот неудобный электрон так
и будет сидеть на своем месте, притягиваемый ядром. В то же время мы видим,
что атому хлора не хватает ровно одного электрона на Зр-подуровне до достиже-
ния состояния завершенности своей внешней s-p-пары. И ему тоже чрезвычайно от
этого неуютно. Стоит только ему откуда-то этот электрон взять, как снаружи и
у него будет конфигурация 3s23p6. Но он не может его захватить
— нечем, ведь
в его ядре ровно 17 протонов, а не 18, и нечем ему притянуть еще один элек-
трон. Так вот они и бродят, неудовлетворенные жизнью, пока не встречаются. И
что они тогда делают? Конечно, они бросаются в объятья друг друга, и при этом
натриевый одиночный внешний электрон становится общим. Фактически он хоть и
перетягивается на сторону хлора (позже будет ясно - почему), но и от натрия
не отрывается насовсем, поскольку совокупный положительный заряд ядра атома
натрия совершенно не собирается его с концами отпускать. Но теперь оба атома
вполне удовлетворяются и этой сложившейся ситуацией, образуя соединение NaCl
— хлорид натрия, или, проще говоря, поваренную соль.
Те атомы, которые для достижения октета предпочитают преподносить партнеру
свои электроны, называются «электронными донорами», ну или просто «донорами».
Обычно донорами являются те атомы, у которых совсем мало электронов на внеш-
них подуровнях. А те атомы, которые предпочитают подгребать к себе электроны,
называются «электронными акцепторами», или просто «акцепторами»
— как правило
это те атомы, которым немного не хватает электронов для заполнения s- и р-
подуровней. При этом доноры и акцепторы бывают разной силы, то есть одни ак-
цепторы сильнее притягивают к себе электроны, а другие слабее. Одни доноры
легче отдают свои электроны, а другие упрямятся, и происходит это в зависимо-
сти от:
1. Расстояния подуровня от ядра атома. Если у донора один электрон болтается
где-то на далеких внешних орбиталях, то он уже довольно слабо притягивает-
ся ядром
— толпы лежащих ниже электронов его экранируют, заслоняют от по-
ложительно заряженного ядра. Поэтому чем больше у донора протонов и элек-
тронов, то есть чем дальше он расположен в периодической таблице, тем бо-
лее эффективным донором он является, тем легче он отдает свой этот лишний
электрон в совместное пользование.
2. Количества лишних электронов. Если у атома на внешнем комплексе (s+p)-
подуровней болтается лишь один электрон, то атом с максимальной силой ста-
рается его отдать, ведь предчувствие комфорта так сильно! Если же электро-
нов больше, то и донорная активность атома снижается.
Аналогично обстоят дела и у акцепторов. Чем ближе к началу периодической
таблицы акцептор, тем активней он стремится захватить себе электрон, и тем
более сильным акцептором он является. И чем меньше ему нужно электронов, что-
бы достичь завершенности, тем активнее он их ищет и хватает. Наиболее активны
те акцепторы, которым не хватает лишь одного электрона.
Удобно сравнить фтор и хлор:
фтор: ls22s22p5
хлор: ls22s22p63s23p5
Казалось бы
— ситуация одинакова, ведь им не хватает на внешней паре (s+p)-
подуровней лишь одного электрона, и они будут настойчиво его искать. Но фтор
обладает гораздо большей силой, ведь у него намного меньше электронов, экра-
нирующих положительный заряд ядра. Из всех химических элементов фтор
— самый
мощный акцептор, потому что он яростнее всех стремится заполнить свою пару
подуровней (s+p).
Во всех живых существах непрерывно происходит огромное количество химиче-
ских реакций. Это и реакции разрушения веществ (например, расщепление длинных
молекул белка, добытых из сырников и сметаны, на удобные для дальнейшего ис-
пользования кирпичики-аминокислоты), и созидательные реакции (например, соз-
дание органических молекул растениями из углекислого газа и воды). При этом
термин «химическая реакция» прочно ассоциируется с неким активным процессом,
с бурным выделением разных веществ во все стороны, поэтому иногда бывает уди-
вительно осознавать, что именно химические реакции происходят ежесекундно
везде в твоем теле. Еще удивительнее то, что эти реакции заключаются в пере-
группировке атомов в составляющих наши тела молекулах. То есть клеточные ме-
ханизмы при своей работе оперируют именно атомами, соединяя их или разъеди-
няя, и часто ученые при всех достижениях современной науки не могут повторить
то, на что эти клеточные механизмы способны.
Если представить себе атом как шарик, в центре которого находится ядро, во-
круг которого летают электроны, то не очень понятно
— каким образом такие
штуки могут соединяться друг с другом. Поэтому стоит рассмотреть другую мо-
дель их взаимодействия. Можно представлять электрон не в виде частицы, летаю-
щей вокруг ядра, а в виде облака, окутывающего ядро со всех сторон. Это обла-
ко может быть толще в каких-то местах и тоньше в других, или оно может сдви-
гаться на одну сторону атома сильнее, чем на другую, в зависимости от того,
что происходит в окрестностях атома. Например, если рядом с этим атомом нахо-
дится другой атом, имеющий положительный заряд (т.е. ион), то отрицательно
заряженное электронное облако будет толще со стороны этого второго атома,
ведь положительные и отрицательные электрические заряды притягиваются. А ино-
гда достаточно того, чтобы какой-то соседний атом сильнее притягивал электро-
ны, чем тот, который мы сейчас рассматриваем. Тогда электронное «облако» час-
тично стягивается с рассматриваемого атома и тянется в сторону соседнего, не-
много «оголяя» положительно заряженное ядро, и за счет этого атом приобретает
частичный электрический заряд. Такой заряд по величине меньше, чем единица
измерения электрического заряда: это может быть половина величины заряда про-
тона , или треть.
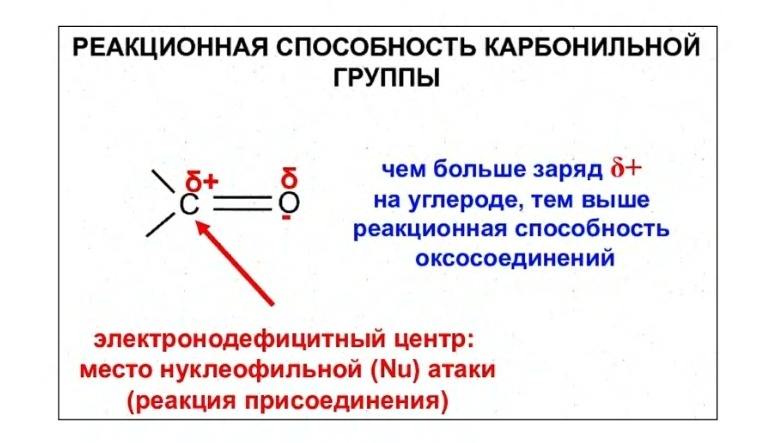
Давай рассмотрим это перетягивание электронного облака на примере молекулы,
образованной атомом углерода (С) и кислорода (О) - это так называемая карбо-
нильная группа2 (или карбонил): >С=0. Здесь и далее значок «>» обозначает две
свободные связи, которые может образовать атом с какими-то другими атомами.
Здесь видно, что между атомами углерода и кислорода стоят две связывающие
их палочки
— это обозначает, что у них две общих пары электронов, т.е. эти
четыре обобществленных электрона принадлежат одновременно обоим атомам. При
этом атом кислорода имеет более сильную электроотрицательность, чем атом уг-
лерода, то есть кислород сильнее тянет общие электроны на себя, и карбониль-
ная группа поэтому становится полярной молекулой: возле кислорода она имеет
частичный отрицательный заряд, а возле углерода
— частичный положительный.
Эти частичные заряды позволяют карбонильной группе активно участвовать в хи-
мических реакциях. Например, положительно заряженный атом углерода начинает
тянуть на себя электроны других атомов, и может дотянуть какие-то из них так,
2 Мнемоническое правило для запоминания этой группы: «что выбрать из двух
почти равных: карбон (углерод) + иль кислород?».что они обобществятся между карбонильной группой и атомом-донором. В резуль-
тате образуется еще одна связь между атомами, и карбонильная группа включится
в часть другой крупной молекулы. В свою очередь и отрицательно заряженный
атом кислорода может притягивать к себе протон, и даже захватывать его, пусть
не очень устойчиво, ведь у кислорода в данной ситуации все-таки не полноцен-
ный , а лишь частичный отрицательный заряд. В такой ситуации карбонильная
группа соединяется с протоном, а протон
— это ядро атома водорода, так что
получается молекула из трех атомов. Получается, что электроны играют роль
подвижного «клея» при химических реакциях.
Логично задаться вопросом: в чём причина того, что количество орбиталей
только нечетное: 1 на s-уровне, З на р-уровне, 5 на d-уровне, 7 на f-уровне?
Ответа никто не знает. Есть разные модели, которые более или менее логично
это объясняют, но, тем не менее, пока что надо просто принимать это как не-
объяснимое явление природы. Мы очень многое не можем объяснить в атомной фи-
зике . Почему у электрона именно такой заряд? Почему именно такая масса? Поче-
му то, почему се
— на огромное число таких вопросов ответа нет. Возможно, что
по крайней мере на часть этих вопросов нам даст ответы теория струн3, которая
является самой многообещающей в современной фундаментальной физике. Первая
проблема тут в том, что развитие теории струн требует невероятно сложной ма-
тематики
— гораздо более сложной, чем та, что требуется для квантовой механи-
ки, квантовой хромодинамики. Поэтому в мире есть буквально несколько десятков
человек, которые разбираются в ней хорошо на том уровне, который достигнут на
данный момент.
И вот всех этих ученых пока что слишком мало, чтобы активно продвигаться
вперед. Вторая проблема состоит в том, что экспериментальная физика почти ни-
чего теории струн дать не может
— наши технологии бесконечно далеки от того,
чтобы достичь параметров, нужных для проверки и развития теории струн. Будем ждать.