Глава 2 .
Рассмотрим атом гелия. В периодической таблице элементов он стоит под вто-
рым номером, что и означает, что в его ядре ровно два протона. Обычно в ядре
гелия есть ещё и два нейтрона, но это сейчас для нас неважно. Раз у гелия два
протона, значит, в обычном состоянии у него есть и ровно два электрона, кото-
рые, в соответствии с принципом стремления системы к минимуму энергии, нахо-
дятся именно на первом, ближайшему к ядру уровне.

Тут вот что очень важно понять. Всё написанное выше не означает, что второ-
го , третьего и четвертого уровней в атоме гелия нет. Они там есть, как и у
любого другого атома, но чтобы электрон перепрыгнул на более высокий уровень,
его надо чем-то туда подтолкнуть. Это происходит, к примеру, когда в электрон
попадает квант света
— фотон, обладающий ровно тем количеством энергии, кото-
рое нужно, чтобы электрон попал на один из более высоких уровней. Если энер-
гии у фотона будет чуть больше или чуть меньше, чем надо для перехода элек-
трона на какой-то вышележащий уровень, то электрон попросту не сможет эту
энергию принять, поглотить, воспользоваться ею и куда-то прыгнуть. Продемон-
стрировать это можно такой моделью: вообрази стенку, в которой на разных вы-
сотах проделаны отверстия. Если мы придадим шарику ровно такое количество
энергии (еще говорят «квант энергии», или просто «квант»), чтобы он долетел в
точности до одного из этих отверстий, то он туда закатится и останется там
лежать, а вот если энергии будет чуть меньше или чуть больше, то шарик уда-
рится о стенку и вернется обратно, на землю. В отличие от такого шарика элек-
трон поступает немного иначе
— он вообще не способен принять такую порцию
энергии. Электрон не может принять такой квант именно потому, что он просто
не способен оказаться между электронными уровнями. Вот такой странный этот
квантовый мир.
Если же в электрон попадёт квант подходящей величины, то электрон эту энер-
гию с удовольствием примет и перескочит на более высокий уровень. Но долго он там находиться не сможет, поскольку система стремится к минимуму энергии, и
поэтому почти сразу электрон снова возвращается так близко к ядру, как только
может
— на самый нижний, самый ближний к ядру уровень, где еще есть для него
свободное место. При этом он отдаёт излишек энергии в виде кванта света, и
этот фотон снова куда-то дальше полетит.
Все то же самое касается и самого простого атома
— водорода. У него один
протон и один электрон. В обычном состоянии этот электрон находится на первом
уровне, и, поглощая энергию фотонов, он может перескакивать выше, затем воз-
вращаясь обратно. И, тем не менее, с точки зрения биохимии между атомами во-
дорода и гелия есть очень принципиальная разница. По причинам, о которых бу-
дет написано позже, гелий является таким элементом, которому нет никакого де-
ла до химии. Нет ему дела и до биологии, и до генетики. Он попросту никаким
образом не участвует в жизни клеток и микроорганизмов
— не входит в состав
сложных молекул, не участвует в обмене веществ (обмен веществ часто называют
термином «метаболизм»). Гелий, как бы сказать, существо возвышенное, причем в
прямом смысле слова. Занимая предельно нейтральную позицию в том, что касает-
ся химических взаимодействий и органической жизни, он, наряду с водородом,
является главным веществом, из которого состоят звезды. А вот водород прини-
мает очень активное участие в нашей жизни. Он входит в главную четверку ато-
мов жизни: кислород, углерод, водород и азот. И поэтому, если физические па-
раметры атома гелия нас интересуют сейчас очень мало, то относительно атома
водорода целесообразно узнать как можно больше в силу его огромной роли в
жизнедеятельности клеток. Пока что запомним хотя бы один его параметр
— его
физический размер.
Точно так же, как бессмысленно «вешать» протон в килограммах, бессмысленно
и измерять его диаметр метрами. Миллиметр тоже нам не подойдет, и даже микро-
метр является слишком большой мерой для атомов. Нам нужна специальная мера
длины, подходящая для отдельных атомов и маленьких молекул - нанометр (нм)
.
Приставка «нано-» означает «одна миллиардная часть», поэтому один нанометр
равен одной миллиардной части метра (Ю-9 метра) или, если так приятней, од-
ной миллионной от миллиметра. Иногда удобно использовать еще одну меру длины - ангстрем (А), равный одной десятой нанометра (10~10 метра). Ангстрем не вхо-
дит в международную систему единиц, которая называется «СИ» и является самой
широко используемой системой единиц в мире, но, тем не менее, он очень часто
используется в химии и биохимии, когда речь идет о расстояниях или размерах
порядка размеров атомов и межатомных расстояний.
Размером атома мы можем считать диаметр воображаемой окружности, центр ко-
торой лежит в ядре атома, а сама она проходит через самый дальний от ядра
электрон, принадлежащий атому. Значит размером спокойного, невозбужденного
атома водорода (то есть такого, где электрон находится на первом уровне) мы и
будем считать диаметр орбиты этого электрона. Радиус этого самого первого
электронного уровня водорода имеет специальное название: «боровский радиус»
(в честь Нильса Бора). Он примерно равен 0,5 А, а значит диаметр невозбужден-
ного атома водорода, т.е. его размер, равен примерно 1 А или, что то же са-
мое , 0,1 нм.
Сравним размеры атома водорода с чем-нибудь таким небольшим в клетке. На-
пример, ядерная мембрана, окружающая ядро клетки, имеет специальные ядерные
поры (не путай ядро клетки с ядром атома)
. Предназначены эти поры для того,
чтобы транспортировать разные молекулы в ядро и из ядра. Внутренний диаметр
такой поры
— около 40 нм, так что атом водорода в целых 400 раз меньше. В об-
щем, пора оказалась, как видим, довольно широкой, что естественно, ведь через
поры надо протаскивать не только мелкий водород, но и довольно объемистые мо-
лекулярные комплексы, состоящие из множества атомов. На приведенной ниже фо-
тографии мы видим поверхность клеточного ядра с ядерными порами.

А вот диаметр двойной спирали ДНК равен всего лишь 2 нм
— это лишь двадцать
атомов водорода, выстроенных в цепочку! Отсюда можно понять, насколько исклю-
чительно микроскопически тонкой является спираль ДНК.
Итак, мы знаем, что первый электронный уровень любого атома выглядит очень
просто
— сфера, в центре которой находится ядро.
По этой сфере «размазан» либо один электрон, либо два, но не больше. Что
значит «размазан»? Значит электрон можно обнаружить в любой точке этой сферы
с одинаковой вероятностью. Теперь рассмотрим второй уровень атома. Второй
уровень, в отличие от первого, не так прост - он состоит из двух подуровней.
Первый подуровень
— это такая же сфера, но побольше диаметром. А второй поду-
ровень имеет форму трех перпендикулярных друг1 другу гантелей. На каждой такой
гантели, как и на сфере, может находиться или один, или максимум два электрона.

Теперь давай разберемся с обозначениями подуровней. Подуровень, являющийся
сферой, обозначается латинской буквой «s», причем неважно, на каком уровне он
находится, так что и сферический первый уровень, и сферический подуровень
второго уровня обозначается как «s».
Подуровень, являющийся тройной гантелей, обозначается как «р», и снова не-
важно
— говорим ли мы о тройной гантели второго уровня, третьего или четвер-
того - любой подуровень такой формы всегда обозначается как «р».
Но как нам обозначать подуровни одинаковой формы, принадлежащие разным
уровням, чтобы было понятно - о чем идет речь? Это просто: s-уровень первого
уровня обозначим как Is, а s-подуровень второго уровня
— 2s. Гантельный поду-
ровень 2-го уровня обозначим как 2р. Итак, на первых двух уровнях имеется три
подуровня: два s-подуровня и один р-подуровень (конечно, первый уровень фор-
мально не имеет подуровней, ведь он состоит только из одного s-уровня).

Рассматривая картинки с гантелями можно подумать, что есть вероятность най-
ти электрон также и в ядре атома, и внутри предыдущих уровней, но это не так
— это просто недостаток таких модельных картинок.
Как видишь, все просто. Теперь давай немного посчитаем электроны. На первом
уровне (Is) их максимум два. На 2 s-подуровне
— тоже максимум 2. На 2р-
подуровне
— максимум 6 электронов, так как на каждой гантельной орбите может
находиться одновременно максимум два электрона, а всего на этом подуровне 3
гантели.
Теперь легко подсчитать
— сколько максимум электронов может находиться на
первых двух уровнях любого атома: 2+2+6=10. Десять. Меньше
— может, а больше
— никогда.
Атом электрически нейтрален в своем обычном состоянии, то есть в нем сколь-
ко положительных зарядов, столько и отрицательных. Атом можно ионизировать,
т.е. добавить ему электроны или забрать у него электроны
— один или несколь-
ко, и тогда такой атом приобретет отрицательный или положительный электриче-
ский заряд, и мы такой атом называем отрицательно или положительно заряженным
«ионом». Это легко продемонстрировать на том же атоме гелия. В нейтральном
состоянии атом гелия имеет два протона и два электрона, т.е. у него имеется
электрический баланс: « + + » и «
— — », а если он отдаст один электрон, то
будет « + + » и «
— », поэтому он и становится в целом положительно заряжен-
ным. При каких условиях у атома может оказаться больше электронов, чем в
обычном, нейтральном состоянии, мы узнаем в позже, когда будем изучать разные
виды ковалентной связи между атомами.
Но сейчас мы не будем говорить про ионы, а будем говорить про атомы в их
обычном, т.е. неионизированном состоянии.
Так как на первых двух уровнях может располагаться максимум 10 электронов,
получается, что тот атом, в ядре которого 10 протонов, будет последним из
тех, кто обходится лишь двумя электронными уровнями. Атому с порядковым номе-
ром 11 уже не хватит двух уровней, состоящих из трех подуровней, и поэтому
одиннадцатый электрон этого атома будет вынужден поместиться на третий уро-
вень, а точнее
— на первый (сферический) подуровень третьего уровня.
Третий электронный уровень устроен еще сложнее, чем второй, но мы легко
разберемся и в нем, потому что тут очень простая логика: если первый уровень
имеет только один подуровень (Is), а второй
— два подуровня (2s, 2p), то тре-
тий уровень содержит уже три подуровня: 3s, Зр и 3d. Про d-подуровень напишем
попозже.
Есть и еще одна простая закономерность, которую надо запомнить: на s-уровне
или s-подуровне размещается максимум 2 электрона, потому что s-уровень или s-
подуровень
— это лишь одна сфера. Будь то первый s-уровень, или будь то s-
подуровень второго уровня или третьего - неважно, s-уровень или s-подуровень
состоят только из одной сферы. На р-подуровне размещается максимум 6 электро-
нов, потому что р-подуровень
— это три гантели, на каждой из которых макси-
мально может быть 2 электрона. Снова неважно - какой именно р-подуровень име-
ется в виду - второго уровня или третьего или какого угодно
— р-подуровень
состоит ровно из трех гантелей, и вмещает в себя максимум 6 электронов. Соот-
ветственно на d-подуровне есть целых пять «гантелей» усложненной формы, на
каждой из которых опять-таки может поместиться максимум по 2 электрона, зна-
чит d-подуровень может вместить в себя максимум 10 электронов.
Есть удобный термин «орбиталь», которым мы будем активно пользоваться. Ор-
биталью называется любая «орбита», на которой могут разместиться (и летать
вокруг ядра атома) максимум 2 электрона. Значит Is - это орбиталь, и 2s-
подуровень и Зэ-подуровень - тоже орбитали, и любая из трех гантелей 2р-
подуровня, и любая из трех гантелей Зр-подуровня - тоже орбитали, и любая из
пяти «сложных гантелей» Зd-пoдypoвня
— тоже орбиталь.Повторим эту закономерность еще раз: у s-подуровня есть только одна орби-
таль, причем неважно - имеется в виду s-уровень первого уровня, или s-
подуровень второго или какого угодно более высокого уровня. У любого р-
подуровня есть три орбитали. У любого d-подуровня
— пять орбиталей. Помня эту
простую закономерность, мы легко сможем узнавать - как расположены электроны
в простых атомах.
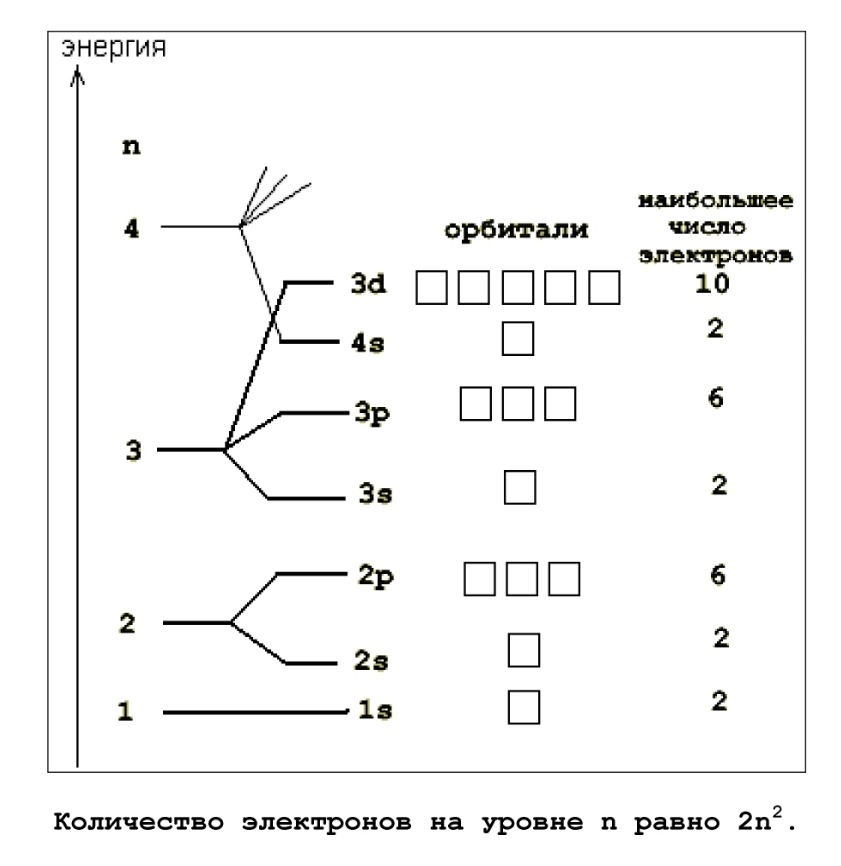
Не заблудись в трех соснах: уровни, подуровни, орбитали. На первом уровне
есть один подуровень (s), на втором уровне - два подуровня (s и р), на треть-
ем уровне - три подуровня (s, р, d). Подуровень s имеет одну орбиталь, поду-
ровень р
— три, подуровень d - пять. На каждой орбитали - максимум 2 электро-
на . Стоит повторить это пару раз, и больше уже не забудешь.
Давай потренируемся и подсчитаем
— сколько всего может быть электронов на
третьем уровне? На сфере 3s
— максимум 2 электрона. На трех гантелях Зр
—
максимум 6. На пяти сложных траекториях 3d
— максимум 10. Итого: на третьем
уровне максимум может быть 2+6+10=18 электронов.
А сколько максимум может быть электронов на всех первых трех уровнях? На
первом (сфера): 2. На втором (сфера + 3 гантели): 8. На третьем: 18. Итого:
2+8+18=28. Всё просто.
Термином электронное облако называется общая совокупность всех орбиталей
данного атома, на которых есть хотя бы один электрон.
Мы видим, что каждый новый уровень имеет на один подуровень больше, чем
предыдущий. Можно это объяснить так, что чем дальше от ядра, тем более сво-
бодно, тем больше там пространства, и уже можно не толпиться и образовывать
больше и больше разных подуровней. Так что четвертый уровень уже имеет 4 по-
дуровня, и этот четвертый подуровень обозначается буквой «f». Значит на чет-
вертом уровне у нас есть подуровни s, p, d, f , обозначаемые как 4s, 4p, 4d,
4f.
Легко запомнить
— из скольких орбиталей состоит f-подуровень. Первый поду-
ровень (s) состоит из одной орбитали, второй подуровень (р) состоит из трех
орбиталей, третий подуровень (d) состоит из 5 орбиталей, а четвертый подуро-
вень (f) состоит из 7 орбиталей. Соответственно, f-подуровень может содержать
максимум 7x2=14 электронов. А сколько максимум может быть электронов на всём
четвертом уровне, т.е. на всех его четырех подуровнях? 2+6+10+14=32. И теперь
— сколько максимум может быть электронов на всех первых четырех уровнях?
2+8+18+32=60.
Давай подытожим и перечислим все подуровни первых 4-х уровней:
1: s
2: s, p
3: s, p, d
4: s, p, d, f
Теперь еще укажем количество орбиталей, каждая из которых вмещает максимум
2 электрона:
1: s (1)
2: s (1), р (3)
3: s (1), р (3), d (5)
4: s (1), р (3) , d (5) , f (7)
Поскольку каждая орбиталь вмещает в себя максимум 2 электрона, мы теперь
можем переписать эту таблицу еще раз, в скобках уже указывая максимальное ко-
личество электронов, находящихся на данном подуровне:
1: s (2)
2: s (2), р (6)
3: s (2), р (6), d (10)
4: s (2), р (6) , d (10) , f (14)
Просуммировав эти электроны, мы теперь можем написать таблицу с указанием
того
— сколько максимум электронов помещается на каждом уровне в атоме:
1 уровень: 2 электрона
2 уровень: 8 электронов
3 уровень: 18 электронов
4 уровень: 32 электрона
Если мы знаем, что в каком-то атоме заполнены первые два уровня, а на более
высоких уровнях электронов нет, то это значит, что в нем находится
(2)+(2+6)=10 электронов, и значит в его ядре 10 протонов, а значит в периоди-
ческой таблице он находится под номером 10
— это химический элемент неон
(Ne)
. Больше всего неона во Вселенной мы сможем найти там же, где находится
больше всего водорода и гелия
— внутри звезд, в газовых туманностях, в атмо-
сфере газовых гигантов типа Юпитера и Сатурна. Как и гелий, неон не вступает
в химические реакции, и поэтому он не играет никакой роли ни в биохимии, ни в
генетике или цитологии. Почему гелий и неон не вступают в химические реакции - это станет понятно чуть позже.
Все электроны в атоме абсолютно идентичны, при этом электрон ведет себя не-
сколько по-разному в зависимости от того, на каком подуровне и на какой орби-
тали он находится. Для того, чтобы было легче говорить про электроны в атоме,
ввели добавочные простые термины: «s-электрон»
— это электрон, находящийся на
любой орбитали типа «s», «р-электрон»
— это электрон, находящийся на любой
орбитали типа «р», и т.д.